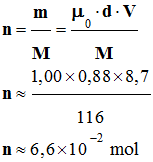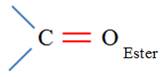|
Chap. N° 12 |
Transformations en chimie organique : Aspect microscopique. Exercices |
|
|
|
I-
Exercice 6 page 313 : Déterminer la polarisation d’une
liaison.
|
On considère les molécules dont
les formules sont données ci-dessous : a)-
Hydrure de lithium : Li –
H ; b)-
Phosphine :
c)-
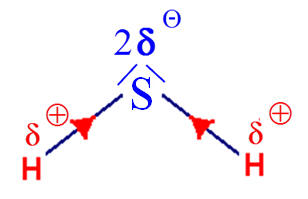
Sulfure de dihydrogène :
H – S – H ; 1)-
Quelles sont les liaisons polarisées ? 2)- Lorsque les liaisons sont polarisées, déterminer le signe des charges partielles des atomes liés, puis
recopier la formule des molécules correspondantes en
indiquant les charges portées par chacun des atomes. 3)-
Quelle est la liaison la plus polarisée ? Justifier. - Données ;
- Électronégativité H : 2,2 ; Li : 1,0 ;
P : 2,2 ; S : 2,6. |
|
a)- Hydrure de lithium : - La
liaison Li – H est polarisée car l’atome
d’hydrogène est plus électronégatif que l’atome de
lithium. b)- Phosphine : - La liaison P
– H n’est pas polarisée car l’atome d’hydrogène
et l’atome de phosphore portent la même
électronégativité. c)- Sulfure de dihydrogène : - La
liaison S – H est polarisée car l’atome de
soufre est plus électronégatif que l’atome
d’hydrogène. 2)-
Représentation des liaisons. a)-
Hydrure de lithium :
b)-
Sulfure de dihydrogène :
3)-
Liaison la plus polarisée :
- La liaison la plus
polarisée est la liaison Li – H car l’écart
entre les électronégativités des deux atomes est la
plus grande.
- La liaison S – H
est peu polarisée comme la liaison
C – H. |
II-
Exercice 10 page 313 : Localiser des sites donneurs ou
accepteurs.
|
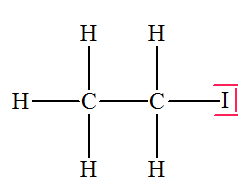
- De l’iodoéthane :
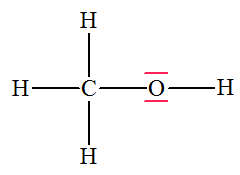
- Du méthanol : 1)-
Quelles sont les liaisons polarisées ? 2)-
Déterminer le signe des charges partielles
éventuelles des atomes. 3)-
Identifier le(s) site(s) donneur(s) ou accepteur(s)
de doublets d’électrons.
- Données : liaison
C – H non polarisée.
- Électronégativité
H : 2,2 ; C : 2,5 ; O : 3,4 ; I :
2,7 |
|
- Cas de l’iodoéthane :
- La liaison C – I
est polarisée car l’atome d’iode est plus
électronégatif que l’atome de carbone.
- Cas du méthanol :
- La liaison C – O
est polarisée car l’atome d’oxygène est plus
électronégatif que l’atome de carbone.
- La liaison H – O
est polarisée car l’atome d’oxygène est plus
électronégatif que l’atome d’hydrogène. 2)-
Signe des charges partielles :
- Cas de l’iodoéthane :
- Liaison
C – I :
- Cas du méthanol :
- Liaison
C – O :
- Liaison
H – O :
3)-
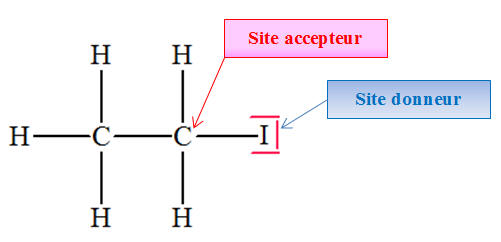
Sites accepteurs et donneurs de doublet d’électrons.
- Cas de l’iodoéthane :
- Site accepteur :
l’atome de carbone C lié à l’atome d’iode
I.
- Site donneur :
l’atome d’iode I.
- Cas du méthanol : - Sites accepteurs : l’atome de carbone C et l’atome d’hydrogène H liés
à l’atome d’oxygène
O.
- Site donneur :
l’atome d’oxygène O.
|
III- Exercice 12 page 314 : Représenter le mouvement des
doublets d’électrons.
|
Recopier cette équation et représenter, par des flèches courbes, le mouvement des doublets d’électrons expliquant la formation et la rupture des liaisons. |
|
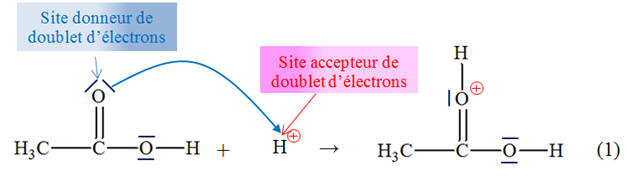
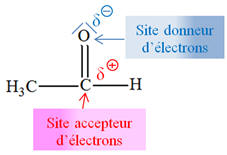
- La réaction résulte
de l’interaction entre le site
donneur de
doublet d’électrons et le site
accepteur de
doublet d’électrons. - La flèche courbe (bleue), orientée du doublet non liant de l’atome d’oxygène vers l’atome de carbone de la molécule de chloroéthane,
représente le mouvement du doublet
d’électrons mis en jeu lors de l’interaction entre
le site donneur de doublet d’électrons
et le site
accepteur de doublet d’électrons.
- Elle permet
d’expliquer la formation de la nouvelle liaison
C
– O.
- La formation de cette
liaison C – O entraîne automatiquement la
rupture de la liaison C – Cl afin que l’atome
de carbone respecte la règle de l’OCTET. - La flèche courbe (rouge) orientée du doublet liant C – Cl vers l’atome de chlore Cl représente le mouvement du doublet d’électrons correspondant :
-
il se forme
alors l’ion chlorure
Cl–. |
IV-
Exercice 15 page 315 : Test à la
DNPH.
|
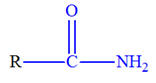
Le test à la 2,4-DNPH, notée R – NH – NH2, est caractéristique des aldéhydes et des cétones. La
réaction se fait en plusieurs étapes. 2,4-DNPH :
2,4-dinitrophénylhydrazine.
- Première étape :
- Deuxième étape :
-
Pour chacune des
étapes ci-dessus : 1)-
Identifier les sites donneurs et accepteurs de
doublet d’électrons dans les réactifs. 2)- Recopier l’équation, puis représenter, par des flèches courbes, le mouvement des électrons permettant d’expliquer la formation et la rupture des liaisons.
- Données :
- Électronégativité
H : 2,2 ; C : 2,5 ; O : 3,4 ; N :
3,0 |
|
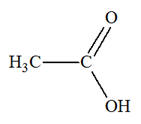
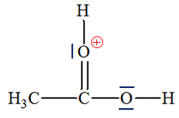
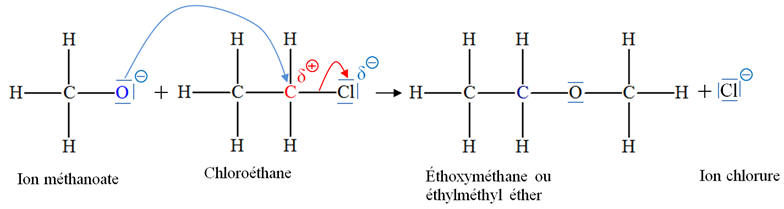
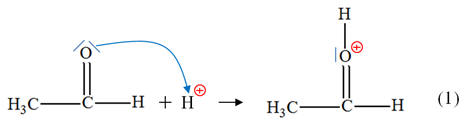
► Première étape :
- Éthanal :
- La liaison C = O
est polarisée car l’atome d’oxygène est plus
électronégatif que l’atome de carbone.
- Ion hydrogène H+ : il provient d’un atome d’hydrogène ayant perdu un électron.
- C’est un site
accepteur de doublet d’électrons.
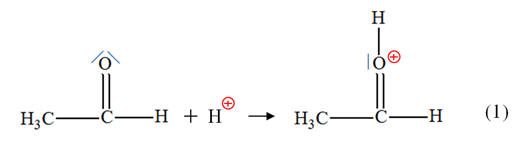
► Deuxième étape : - Au cours de cette étape, le site donneur de doublet d’électrons est l’atome d’azote
et le site accepteur de doublet
d’électrons est l’atome de carbone lié à l’atome
d’oxygène.
- Équation de la
réaction : |
V-
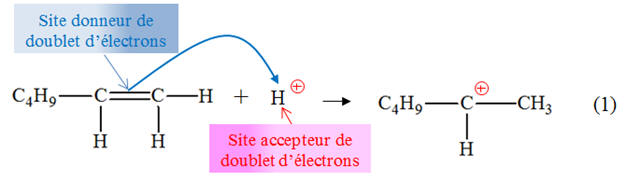
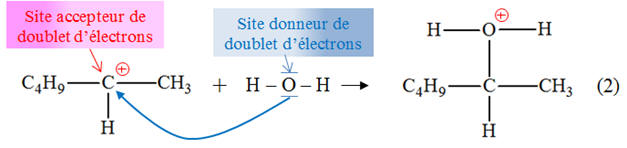
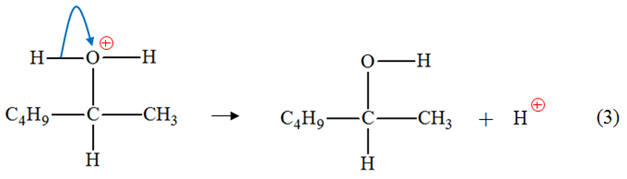
Exercice 18 page 315 – 316 : Hydratation de hex-1-ène.
|
V
= 20 mL d’hex-1-ène à une solution aqueuse d’acide
sulfurique. Après lavage, séchage et
distillation, une masse m (ol) = 8,22
g d’hexan-2-ol est obtenue. 1)- Équation bilan : a)-
Écrire l’équation de la réaction entre l’eau
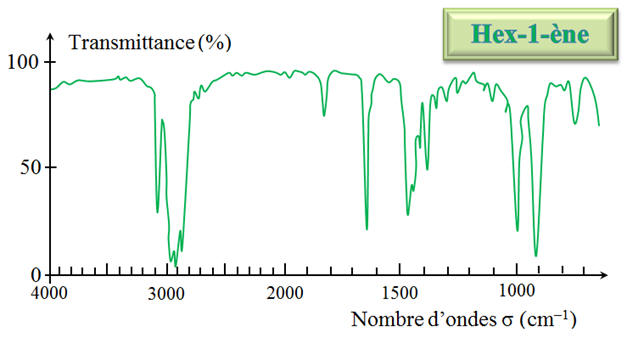
et l’hex-1-ène. b)- À quelle catégorie de réactions appartient-elle ?c)- Quelle modification de structure s’est produite au cours de cette réaction ?2)- Les spectres IR de l’hex-1-ène et du produit sont donnés ci-dessous. Comment permettent-ils de
vérifier que l’alcène de départ a été hydraté ? 3)- Le mécanisme réactionnel de l’hydratation de
l’hex-1-ène est donné ci-dessous : - Pour les étapes (1) et (2) : a)- Identifier les sites donneurs et accepteurs de doublet d’électrons dans les réactifs.b)- Recopier l’équation, puis représenter, par des flèches courbes,le mouvement des électrons
permettant d’expliquer la formation et la rupture de
liaisons observées. c)- Représenter la flèche courbe qui permet d’expliquer la rupture de liaison qui a lieu lors de l’étape (3).4)- Quel est le rôle joué par les ions hydrogène
apportés par l’acide sulfurique ? 5)- L’hexan-2-ol est-il chiral ? Si oui, donner
la représentation de Cram de ses deux énantiomères. 6)- Déterminer le rendement de cette synthèse. - Données : densité de l’hex-1-ène d
= 0,67 - Masse volumique de l’eau : µ0
= 1,00 kg / L |
|
a)-
Équation de la réaction entre l’eau et
l’hex-1-ène : b)-
Catégorie de la réaction : - On est en présence d’une réaction
d’addition. c)- Modification de structure :- Changement de groupe caractéristique :
- On passe d’un groupe alcène
2)- Exploitation des spectres : - Superposition des deux spectres : - On remarque que dans le spectre
IR du produit, il y a - Apparition de la bande large entre
3200 cm–1 et 3500 cm–1
caractéristique de la liaison
O–H - Disparition de la bande fine vers 3200
cm–1 caractéristique de
la liaison Ctri
– H - Disparition de la bande fine vers 1650
cm–1 caractéristique de la liaison
C =
C - Au cours de la réaction chimique,
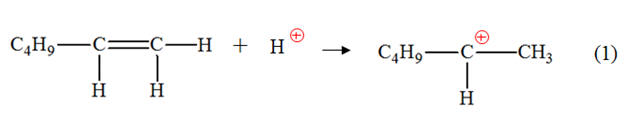
l’hex-1-ène a bien été hydraté. 3)- Mécanisme réactionnel : a)- Sites donneurs et sites accepteurs de doublet d’électrons.- Étape (1) :
- Site donneur de doublet d’électrons :
la double liaison C = C (la double liaison
est un site riche en électrons) - Site accepteur de doublet
d’électrons : ion hydrogène H+. - Étape (2) :
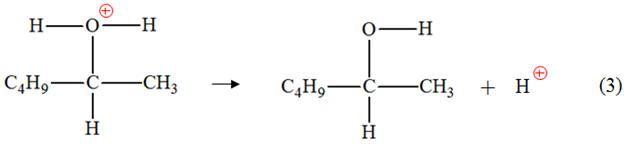
- Site donneur de doublet d’électrons :
l’atome d’oxygène de la molécule d’eau qui possède
deux doublets d’électrons non liants - Site accepteur de doublet
d’électrons : l’atome de carbone C qui porte
une charge positive. b)-
Mouvement des électrons : - Étape (1) : - Étape (2) : c)-
Étude de l’étape (3). - Mouvement des doublets d’électrons : 4)- Rôle joué par les ions hydrogène apportés
par l’acide sulfurique. - Bilan de la réaction : - Les ions hydrogène H+,
apportés par l’acide sulfurique, n’apparaissent pas
dans le bilan de la réaction. - Ils interviennent lors de la première
étape où ils sont consommés, mais ils sont régénérés lors de la troisième étape. - En conséquence, les ions hydrogène H+ catalysent la réaction d’hydratation de l’hex-1-ène. 5)- Représentation de Cram de ses deux
énantiomères : - L’hexan-2-ol :
- La molécule possède un atome de
carbone tétragonal lié
à 4 groupes différents.
- La molécule possède donc un carbone asymétrique. - On est en présence d’une molécule
chirale qui possède deux énantiomères :
diastéréoisomères images l’un de l’autre dans un
miroir. - Représentation de CRAM : 6)- Rendement de la réaction : ► Quantité de matière d’hex-1-ène
utilisé : - Volume d’hex-1-ène utilisé : V
= 20 mL d’hex-1-ène - Densité de l’hex-1-ène d = 0,67 - Masse molaire de l’hex-1-ène : M
= 84 g / mol - m = µ . V et
- m = µ0 . d
.V avec µ0 = 1,00 kg / L =
1,00 g / mL - Quantité de matière d’hex-1-ène : - ► Quantité de matière d’hexan-2-ol
obtenu : - M (ol) = 102 g / mol -
m (ol) = 8,22 g
d’hexan-2-ol - Quantité de matière d’hena-2-ol : n
(ol) : -
- Rendement de la réaction : - Le rendement d’une synthèse, noté ρ, est égal au quotient de la quantité de produit obtenu nexp,
par la quantité
maximale de produit attendu nmax. - nexp = n (ol)
≈ 8,06
× 10–2 mol et nmax
= n ≈ 0,16 mol -
-
- Ou ρ ≈ 51 % (en utilisant les
résultats des calculs intermédiaires contenus dans
la mémoire de la calculatrice). |
VI-
Exercice 20 page 317 : Synthèse de l’éthanamide.
|
L’éthanamide
entre dans la composition de la chitine, constituant
essentiel de l’exosquelette des crustacés, insectes,
coléoptères, etc. Au laboratoire, l’éthanamide
peut être obtenu par réaction entre
l’ammoniac
NH3
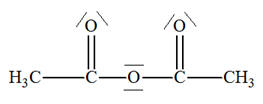
et l’anhydride éthanoïque
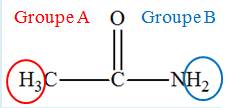
Anhydride éthanoïque (ou anhydride acétique) 1)- a)-
Quelle est la formule
semi-développée de l’éthanamide ? Quelle est sa
fonction chimique ? b)-
Écrire l’équation de la
réaction sachant qu’il se forme de l’acide
éthanoïque. c)-
À quelle catégorie de
réaction appartient-elle ? 2)-
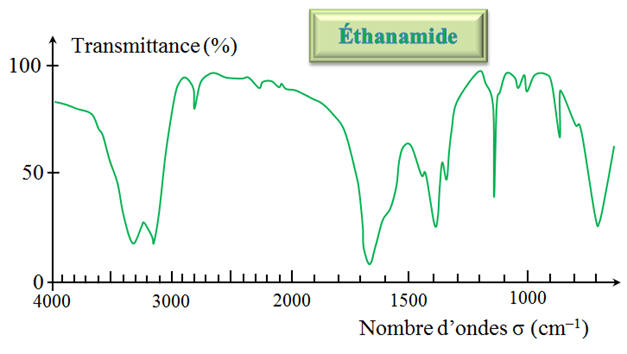
Le spectre IR de l’éthanamide est donné
ci-dessous : a)-
Le spectre IR
permet-il de vérifier la présence du groupe
caractéristique du produit ? b)-
Combien observera-t-on de
signaux dans le spectre de RMN de
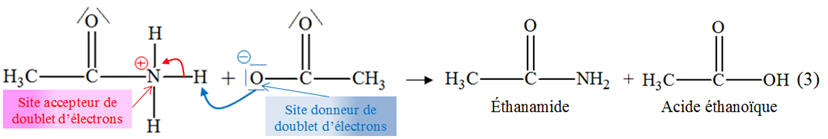
l’éthanamide et quelle sera leur multiplicité ? 3)-
Les étapes du mécanisme réactionnel sont données
ci-dessous : Pour les étapes (1) et (2) : a)- Identifier les sites donneurs et accepteurs de doublet d’électrons dans les réactifs.b)- Recopier l’équation, puis représenter, par des flèches courbes, le mouvement des doublets d’électrons expliquant la formation et la rupture des liaisons observées.4)- Quels sont les produits formés lors de l’étape (3) ? Recopier et compléter son équation. 5)- a)- À quelle catégorie de réaction appartient la réaction d’étape (2) ?b)- Pourquoi qualifie-t-on souvent la réaction de synthèse étudiée de réaction d’addition-élimination ? |
|
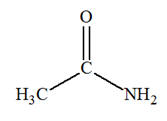
1)- a)-
Formule semi-développée de
l’éthanamide et fonction chimique :
- Formule
semi-développée :
- Fonction chimique :
fonction amide b)-
Équation de la réaction :
c)-
Catégorie de la réaction :
- On est en présence
d’une réaction de substitution.
- On a substitué :
- D’une part le groupe
– NH2 au groupe
- Et d’autre part le
groupe – OH au groupe
2)-
Spectre IR et spectre
RMN : a)-
Mise en évidence d’un groupe
caractéristique : - Mise en évidence de la liaison N – H du groupe caractéristique
–
NH2
par la présence de la bande d’absorption suivante :
- Mise en évidence de
la liaison C = O par la présence de
la bande
d’absorption suivante :
b)-
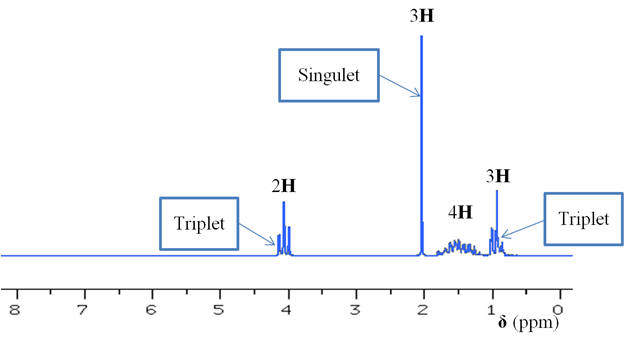
Spectre RMN :
- Nombre des signaux :
- La molécule possède deux groupes de protons équivalents.
- On observe deux
signaux. - Il n’y a pas de couplage entre les deux groupes de protons équivalents.
- On observe deux pics, deux singulets. 3)-
Mécanisme réactionnel : a)-
Sites donneurs et sites
accepteurs :
- Étape (1) : - Site donneur de doublet d’électrons : l’atome d’azote de la molécule d’ammoniac (cet atome porte un doublet non liant).
- C’est un site riche en électrons. - Site accepteur de doublet d’électrons : - l’atome de carbone doublement lié à l’atome d’oxygène de la molécule d’anhydride éthanoïque (Voir réponse 8)- b)-). - L’atome d’oxygène est plus électronégatif que l’atome de carbone. - Il apparaît une charge partielle positive sur cet atome de carbone lié aux atomes d’oxygène.
- C’est un site
appauvri en électrons
- Étape (2) : - Site donneur de doublet d’électrons : - l’atome d’oxygène qui porte la charge négative : - il possède trois doublets d’électrons non liants.
- C’est un site riche en
électrons. - Site accepteur de doublet d’électrons : - l’atome de carbone. - L’atome d’oxygène est plus électronégatif que l’atome de carbone, - il apparaît une charge partielle positive sur cet atome de carbone lié aux atomes d’oxygène.
- C’est un site appauvri en électrons. b)-
Mouvement des doublets
d’électrons :
- Étape (1) :
5)- a)-
Catégorie de réaction de
d’étape (2) :
- La réaction de
l’étape (2) est une élimination. b)-
Réaction
d’addition-élimination : - La première étape est une réaction d’addition et la deuxième étape une réaction d’élimination.
- Le bilan de la réaction
est une
réaction d’addition-élimination. |
VII- Exercice 22 page 318 : Synthèse d’un arôme.
|
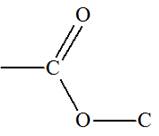
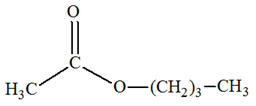
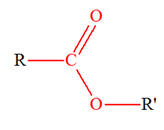
L’éthanoate de butyle est utilisé comme arôme alimentaire. Il peut être obtenu par
réaction entre le butan-1-ol et l’acide éthanoïque. 1)- a)-
Quelle est la fonction chimique de
l’éthanoate de butyle ? b)-
Écrire les formules des espèces mises en jeu
dans la réaction sachant qu’il se forme également de
l’eau. c)-
À quelle catégorie de réaction
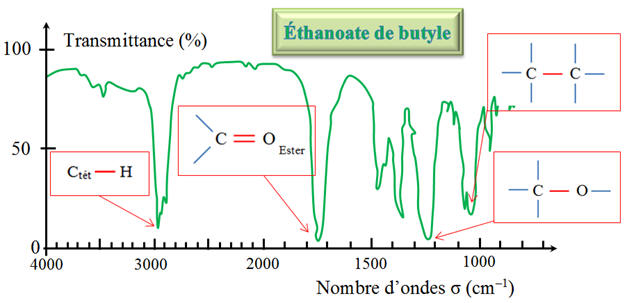
appartient-elle ? 2)- On fait réagir des quantités d’alcool (ol) et d’acide éthanoïque (ac) telles que n0 (ol) = n0 (ac) = 0,10 mol. On obtient un volume V = 8,7 mL d’éthanoate de butyle. Quel est le rendement de la synthèse ? 3)- Les spectres IR et RMN de
l’éthanoate de butyle sont donnés ci-dessous : a)- Le spectre IR permet-il de justifier
que le produit obtenu est celui attendu ? b)-
Attribuer les signaux du spectre de
RMN. 4)- Pour les deux premières étapes du mécanisme
réactionnel données ci-dessous : a)-
Identifier les sites donneurs et accepteurs
de doublet d’électrons dans les réactifs. b)-
Recopier l’équation, puis représenter, par
des flèches courbes, le mouvement des doublets
d’électrons intervenant dans ce mécanisme. - Données : éthanoate de butyle :
densité d = 0,88 -
Fiches : - IR : Groupes caractéristiques et bandes
d’absorption
|
|
1)- a)- Fonction chimique de l’éthanoate de butyle :- L’éthanoate de butyle possède la
fonction ester
b)-
Formules des espèces mises en jeu dans la
réaction sachant qu’il se forme également de l’eau. - Acide éthanoïque : - Butan-1-ol : - Éthanoate de butyle : - Eau : - Équation de la réaction :
c)-
Catégorie de réaction : - On est en présence d’une réaction de
substitution. 2)- Rendement de la synthèse : - Le rendement d’une synthèse, noté ρ, est égal au quotient de la quantité de produit obtenu nexp,
par la quantité
maximale de produit attendu nmax. - Ici, on est en présence d’un mélange stœchiométrique. - Il n’y a pas de réactif limitant - nexp = n
(oate) et nmax = n0
(ol) = n0 (ac) = 0,10 mol - Il faut calculer la quantité de
matière d’éthanoate de butyle obtenue. - On connaît le volume : V = 9,9
mL d’éthanoate de butyle -
Densité de l’éthanoate de butyle d
= 0,88 - Masse molaire de l’éthanoate de
butyle : M = 116 g / mol - m = µ . V et
- m = µ0 . d
.V avec µ0 = 1,00 kg / L =
1,00 g / mL - Quantité de matière d’éthanoate de
butyle : - - Rendement de la réaction : - nexp = n
(oate) ≈ 7,5
x 10–2 mol et nmax
= n0 (ol) = n0
(ac) = 0,10 mol -
3)- Étude des spectres IR et RMN : a)-
Spectre IR et produit : - Bande d’absorption caractéristique de
l’ester:
- Bande d’absorption :
- Bande d’absorption :
- Bande d’absorption :
Le spectre IR permet de justifier que le produit obtenu est un ester puisqu’il ne présente pas la bande d’absorption du groupe hydroxyle de l’alcool – OH (bande 3200 cm–1–3400 cm–1, bande forte) ou du groupe – O – HAcide carb (bande 2500 cm–1–3200 cm–1, bande forte) de l’acide carboxylique, mais présente la bande d’absorption du groupe C = O
du groupe ester. b)-
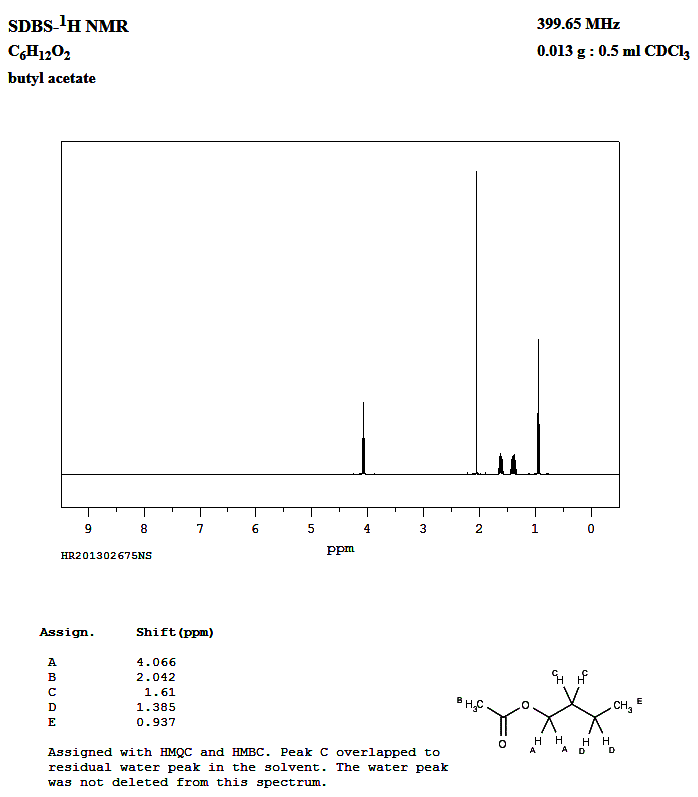
Les signaux du spectre RMN : - Les différents groupes de protons
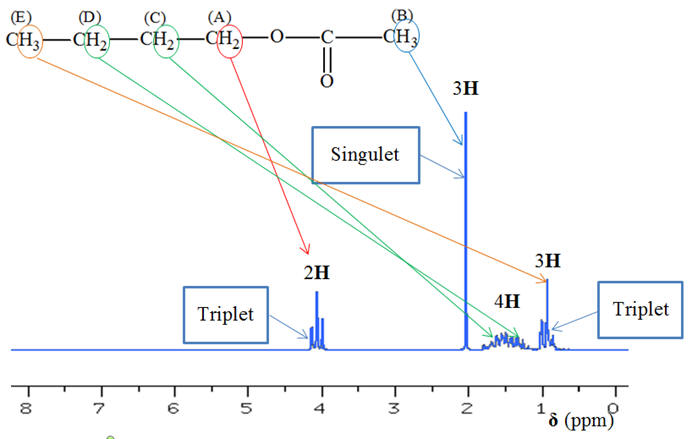
équivalents de la molécule : - - Le groupe (A) : le signal correspondant est le triplet tel que δ ≈ 4,0 ppm. - Il possède deux protons équivalents voisins. - Le groupe (B) : le signal correspondant est le singulet tel que δ ≈ 2,0 ppm. - Il ne possède pas de protons équivalents
voisins. - Les groupes (C) et (D) : le signal correspondant est le multiplet tel que δ ≈ 1,5 ppm. - Chaque groupe possède des protons équivalents à droite et à gauche - (2 à droite et 2 à gauche pour le groupe (C) et 2 à droite et 3 à gauche pour le groupe (D)). - Les deux groupes se
superposent. - Le groupe (E) : le signal correspondant est le triplet tel que δ ≈ 1,0 ppm. - Il possède deux protons équivalents
voisins. - Remarque : le spectre RMN de
l’acétate d’éthyle est très proche de celui du
butan-1-ol.
-
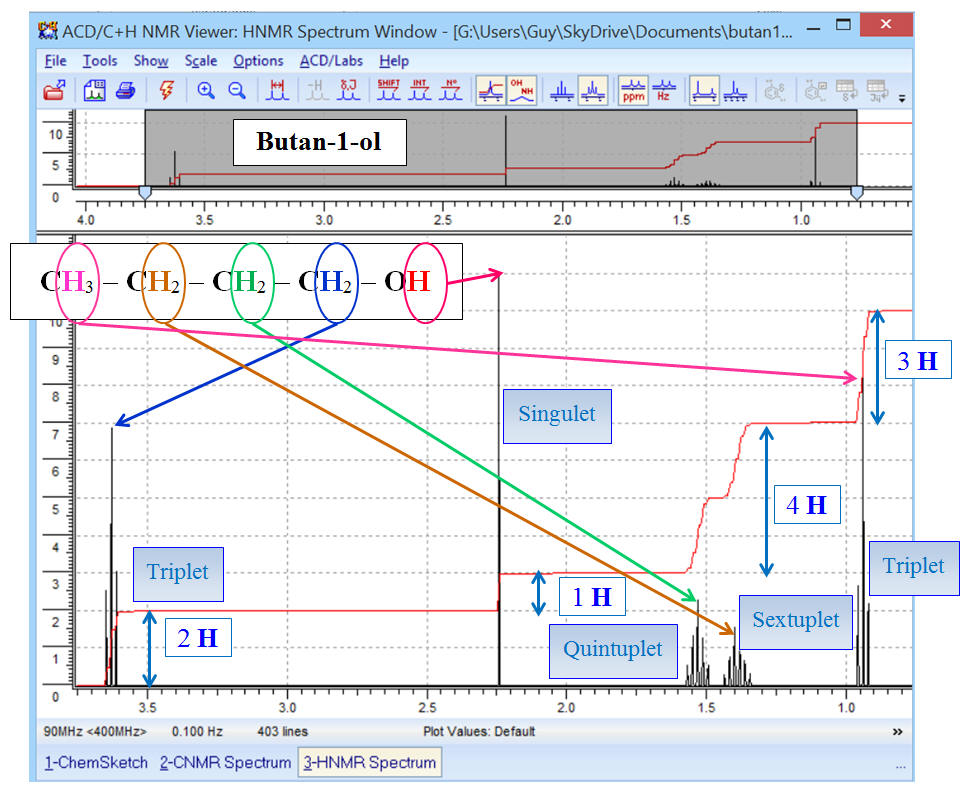
Spectre du butan-1-ol réalisé avec le
logiciel HNMR Spectrum :
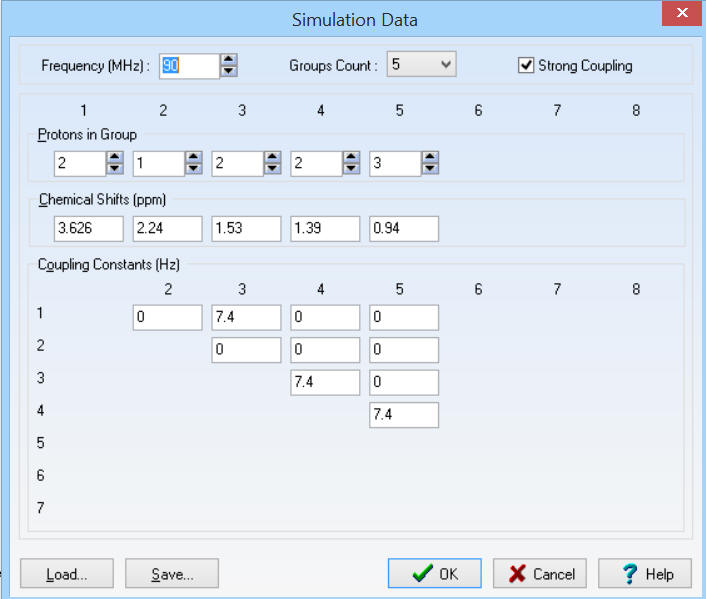
Mode d'emploi du logiciel HNMR Spectrum - Dans un premier temps, la fréquence de
résonance des protons f = 90 MHz. - Les différentes valeurs : -
Les constantes de couplages : - J13 ≈ 7,4 Hz ; J34
≈ 7,4 Hz et J45 ≈ 7,4 Hz - On obtient le spectre suivant :
- En optimisant les échelles : - Les deux signaux des groupes (C) et (D)
se superposent. - Pour éviter ce phénomène, on choisit comme
fréquence f = 400 MHz : - On optimise les échelles et on ajoute la
courbe d’intégration : - - Spectre du butan-1-ol obtenu avec le site site SDBS – 1HNMR. - URL du site : https://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi - Spectres de l'éthanoate de butyle obtenu avec le site site SDBS – 1HNMR. - URL du site : Spectral Database for Organic Compounds -
Fréquence f =
90 MHz : -
Fréquence f =
400 MHz : 4)- Mécanisme réactionnel : a)- Sites donneurs et accepteurs de doublet d’électrons.- Étape (1) :
- Site donneur de doublet d’électrons : l’atome d’oxygène du groupe C = O : - Il
possède deux doublets non liants. - Site accepteur de doublet
d’électrons : ion hydrogène H+. - Étape (2) :
- Site donneur de doublet d’électrons : - L’atome d’oxygène O de la molécule de butan-1-ol : - Il possède deux doublets non liants. - Site accepteur de doublet d’électrons : - L’atome de carbone de la liaison C = O du cation intermédiaire
b)-
Mouvement des doublets d’électrons :
|
VIII- Exercice 23 page 319 : Réduction du benzyle.
|
|
 ;
;



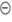 et le chloroéthane
et le chloroéthane 





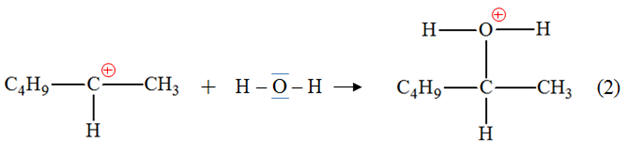

 à un groupe hydroxyle –OH
à un groupe hydroxyle –OH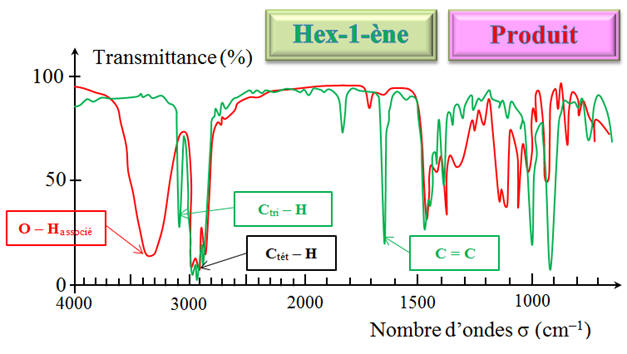



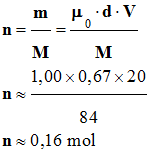

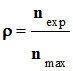










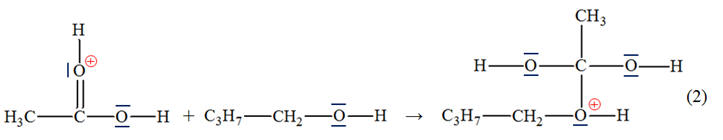
 ou
ou