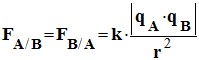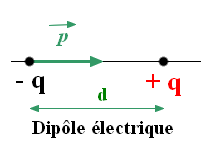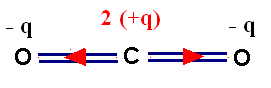|
Phys. N° 06 |
Cohésion de la matière à l'état solide. Cours. |
|
|
Mots clés : Cohésion des solides ioniques, électrisation par frottement, loi de Coulomb, solide ionique, molécule polaire, molécule apolaire, électronégativité, polarité d'une liaison covalente, moment dipolaire, polatité d'une molécule, le chlorure d'hydrogène, cohésion des solides moléculaires, les solides moléculaires, interaction de Van Der Waals, Van Der Waals, la liaison hydrogène, chauffage d'un solide, changement d'état physique, les états de la matière, état solide, état liquide, état gazeux, transferts thermiques, applications, QCM, exercices, correction, structure de la glace, structure de l'eau liquide, structure de la vapeur d'eau, chlorure d'iode solide, ... |
|
|
|
I- Cohésion des
solides ioniques. |
|
2)- Polarité
d’une liaison covalente et moment dipolaire. |
|
III- Cohésion
des solides moléculaires. |
|
V- Applications. |
|
|
|
Exercices : énoncé avec correction a)- Exercice 7 page 164. Identifier la nature des charges électriques. b)- Exercice 9 page 164. Connaître la loi de Coulomb. c)- Exercice 10 page 164. Déterminer la formule de cristaux ioniques. d)- Exercice 13 page 164. Rechercher des molécules polaires. e)- Exercice 15 page 165. Identifier des interactions de Van Der Waals f)- Exercices 16 page 165. Rechercher la présence de liaisons hydrogène. g)- Exercice 17 page 165. Interpréter des effets thermiques. h)- Exercice 21 page 166. Géométrie des molécules et polarité. i)- Exercice 26 page 167. Évolution de température de fusion. |
I- Cohésion des solides ioniques.
1)- Électrisation par frottement.
a)- Observations
- Les phénomènes d’électrisation sont fréquents dans la vie de tous les jours :
- Quand on enlève un pull en matière synthétique, les cheveux s’électrisent.
- Lorsque l’on se coiffe par temps sec, les cheveux s’électrisent.
- Lorsque l’on approche la main d’un écran cathodique, on ressent des picotements.
- L’électrisation des nuages conduit à la formation des éclairs.
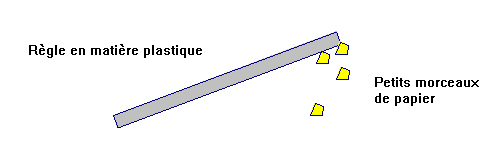
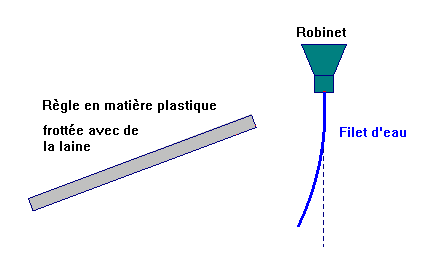
b)- Expérience 1.
 Frotter une règle plastique sur
de la laine. L’approcher de petits morceaux de papier posés sur
la table.
Frotter une règle plastique sur
de la laine. L’approcher de petits morceaux de papier posés sur
la table.
- La règle frottée attire des petits morceaux de papier.
c)- Expérience 2.
 Faire couler un mince filet d’eau
et en approcher doucement la règle frottée.
Faire couler un mince filet d’eau
et en approcher doucement la règle frottée.
- La règle frottée dévie un mince filet d’eau.
d)- Conclusions :
- Au cours de ces expériences, on a mis en évidence un phénomène d’interaction à distance entre deux corps.
- Certains objets peuvent être électrisés par frottement.
- Ils attirent alors à distance certains objets légers.
- Les objets doivent être légers pour que le phénomène soit observable.
- Un corps électrisé est un corps qui porte des charges électriques.
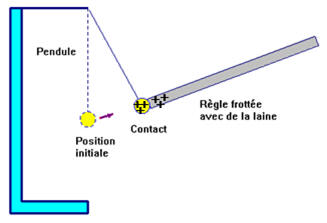
e)- Expérience 3 :
 On frotte une tige de verre avec
de la laine, on l’approche d’un pendule puis on le met en
contact avec celui-ci. Observer.
On frotte une tige de verre avec
de la laine, on l’approche d’un pendule puis on le met en
contact avec celui-ci. Observer.
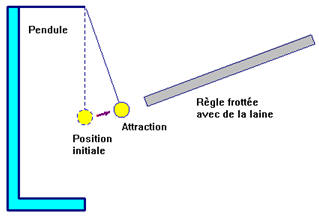
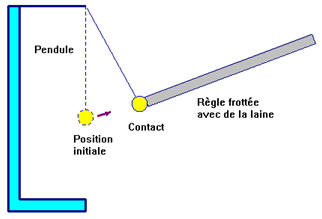
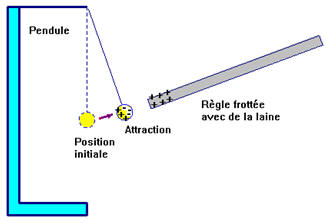
- Quand on approche la règle frottée avec de la laine du pendule, le pendule est attiré par la règle.
- Il y dans un premier temps, attraction, puis contact et enfin répulsion.
► Interprétation :
- Lorsque l’on frotte la règle avec un chiffon de laine, il y a électrisation de la règle par frottement.
- On approche la règle frottée du pendule. Le pendule subit l’influence de la règle, corps électrisé.
- Après contact entre le pendule et la règle, il y a répulsion entre le pendule et la règle.
- Le pendule s’est électrisé par contact. Il porte le même type de charges électriques que la règle.
- Des corps électrisés peuvent s’attirer ou se repousser.
- On peut en déduire qu’il existe deux types d’électricité.
- Aux deux types d’électricité correspondent deux types de charges électriques :
- Les charges positives et les charges négatives.
- Deux corps qui portent des charges électriques de mêmes signes se repoussent.
- Deux corps qui portent des charges électriques de signes contraires s’attirent.
► Interprétation microscopique de l’électrisation :
- La matière est constituée à partir d’atomes. Les atomes sont électriquement neutres.
- L’atome est constitué d’un noyau positif entouré d’un nuage électronique.
- Le nuage électronique est constitué d’électrons chargés négativement.
- Le noyau est constitué de protons chargés positivement et de neutrons électriquement neutres.
- Au niveau du lycée, les particules élémentaires sont : les protons, les neutrons et les électrons.
- Les phénomènes d’électrisation s’expliquent à partir des particules élémentaires.
- Par frottement, ce sont les électrons périphériques qui sont arrachés des atomes.
- L’électrisation par frottement résulte d’un transfert d’électrons d’un corps vers un autre.
- Par frottement, on agit sur la surface de la matière. On n’agit pas au niveau du noyau.
- Le corps qui perd des électrons présente un défaut d’électrons. Globalement, il est chargé positivement.
- Le corps qui gagne des électrons présente un excès d’électrons. Globalement, il est chargé négativement.
- L’électrisation par frottement résulte d’un transfert d’électrons d’un corps vers un autre.
- Un corps chargé positivement possède un défaut d’électrons.
- Un corps chargé négativement possède un excès d’électrons.
► Retour sur le pendule :
- Le pendule est neutre avant contact, mais il est attiré.
- Les électrons des atomes qui constituent le pendule sont attirés.
- Des charges de signes contraires s’attirent.
- Ils sont sous l’influence des charges positives de la règle.
- Il se crée une dissymétrie dans la répartition des électrons permettant une attraction.
- Globalement, le pendule reste neutre.
- La zone en regard de la règle présente un excès d’électrons alors que la zone la plus éloignée de la règle présente un défaut d’électrons.
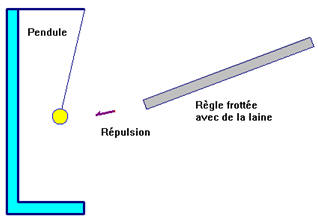
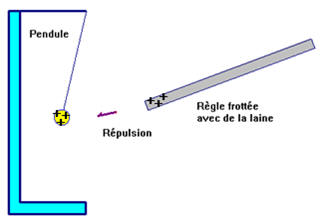
- Lors du contact entre le pendule électriquement neutre et la règle frottée chargée positivement, le pendule s’électrise.
- Le pendule est repoussé, il porte une charge électrique de même signe que la règle frottée.
- Des électrons du pendule passent sur la tige.
- Le pendule se charge alors positivement, il présente un défaut d’électrons.
- Enfin, il y a répulsion entre le pendule et la règle frottée avec la laine car ils portent des charges de mêmes signes.
2)- Loi de Coulomb.
- Charles Augustin Coulomb : 1785.
![]() Énoncé :
Énoncé :
|
Deux corps ponctuels A et B, de chargesqA et qB, séparés par une distance r, exercent l’un sur l’autre des forcesattractives ou répulsives telles que :
|
|
-
Caractéristiques des deux forces : -
La force
- et la force
-
Elles ont la même direction : la droite (AB). -
Elles ont des sens opposés. -
Elles sont attractives si les charges sont de signes
opposés. -
Elles sont répulsives si les charges sont de même signe. -
Elles ont la même valeur : |
|
-
Expression : |
|
-
La constante k = 9,0
× 10 9 N . m
2 . C – 2. -
Au niveau de la première, on écrit : -
k = 9,0
× 10 9 S.I |
|
- Les unités : - FA/B et FB/A s’expriment en newton (N). - qA et qB s’expriment en coulomb (C) - r s’exprime en mètre (m) |
|
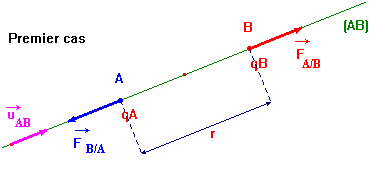
-
Premier cas : on considère que : qA . qB
> 0
|
|
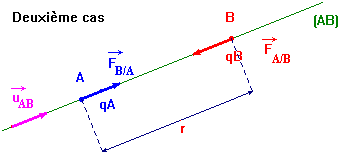
-
Deuxième cas : on considère que : qA . qB
< 0
|
- Considérons deux boules A et B chargées d’électricité positive.
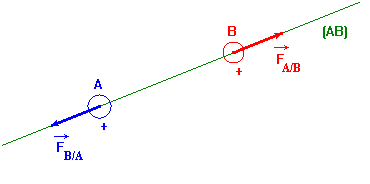
-
La boule A agit sur la
boule B par l’intermédiaire d’une force notée :
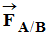
-
Réciproquement la boule B
agit sur la boule
A par l’intermédiaire d’une force notée :
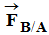
- Caractéristiques de chacune des forces :
-
 Et
Et

- Premier cas : on considère que : qA . qB > 0
- Deuxième cas : on considère que : qA . qB < 0
-
Constante
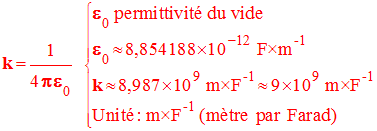
- Au niveau de la première S : k = 9,0 × 10 9 S.I.
► Application : Comparaison avec l’interaction gravitationnelle.
- Dans l’atome d’hydrogène, comparer les valeurs des forces gravitationnelle et électrique s’exerçant entre le noyau et l’électron. Conclure.
- On donne : masse du proton : mP = 1,67 × 10– 27 kg : masse de l’électron : me = 9,11 × 10– 31 kg :
- Charge élémentaire : e = 1,6 × 10– 19 C : Constante de gravitation : G = 6,67 × 10 – 11 S.I
- Constante k : k = 9,0 × 10 9 S.I.
- Distance moyenne entre le noyau et l’électron : d ≈ 53 pm.
- Solution :
-
Expression de la force
gravitationnelle :

- Valeur : Fg ≈ 3,6 × 10 – 47 N
-
Expression de la force
électrique :
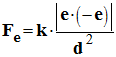
- Valeur : Fe ≈ 8,2 × 10–8 N
- Comparaison : on fait le rapport des deux forces :
-

- Application numérique :
-
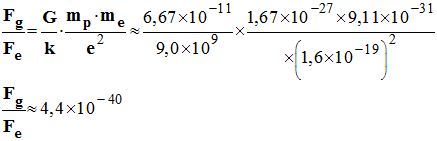
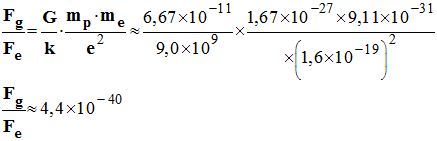
- Conclusion : au niveau atomique, la force de gravitation est négligeable devant la force électrique.
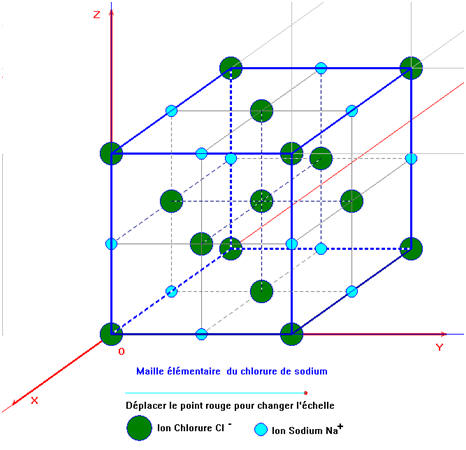
3)- Le solide ionique.
- Un solide ou cristal ionique est un assemblage compact et ordonné d’anions et de cations assimilables à des sphères dures.
- Un solide ionique est électriquement neutre
- Exemple : le chlorure de sodium.
- Le chlorure de sodium est constitué d'un assemblage compact et ordonné d’ions sodium et d’ions chlorure.
- La formule statistique du cristal est : NaCl.
- Le cristal est électriquement neutre.
- Il contient autant d’ions sodium Na + que d’ions chlorure Cl–.
- Cette maille élémentaire se reproduit dans les trois directions de l’espace.
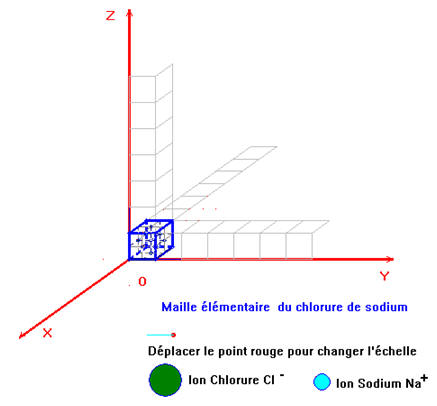
- Chaque ion se trouve en contact avec des ions de signes contraires.
- Il en résulte une structure régulière dans laquelle un motif se répète à des millions d’exemplaires.
- Le motif est appelé maille élémentaire.

- On obtient un cristal à l’échelle macroscopique.
![]() Cohésion du cristal ionique :
Cohésion du cristal ionique :
- La cohésion du cristal ionique est due aux forces d’interactions électriques :
- Les forces d’attraction électriques entre les ions de signes opposés l’emportent sur les forces de répulsion entre les ions de même signe.
► Application : la fluorine est un cristal ionique constitué d’un empilement compact et ordonné d’ions calcium et d’ions fluorure F–.
Les ions calcium proviennent d’un atome de calcium ayant perdu deux électrons.
![]() Écrire la formule de l’ion
calcium et en déduire la formule statistique et le nom de la
fluorine.
Écrire la formule de l’ion
calcium et en déduire la formule statistique et le nom de la
fluorine.
- Réponse :
- L’ion calcium porte une charge électrique positive : Ca2+
- Le cristal est électriquement neutre, il faut un ion calcium pour deux ions fluorure.
- La formule statistique est la suivante : CaF2,
- Le nom : Le fluorure de calcium.
- Dans l’écriture de la formule d’un solide ionique, les charges ne figurent pas.
- Par convention, on choisit les plus petits indices qui assurent l’électroneutralité du cristal.
- La formule statistique indique la nature et la proportion des ions présents dans le cristal sans mentionner les charges.
II- La molécule polaire. (une autre approche)
1)- Électronégativité.
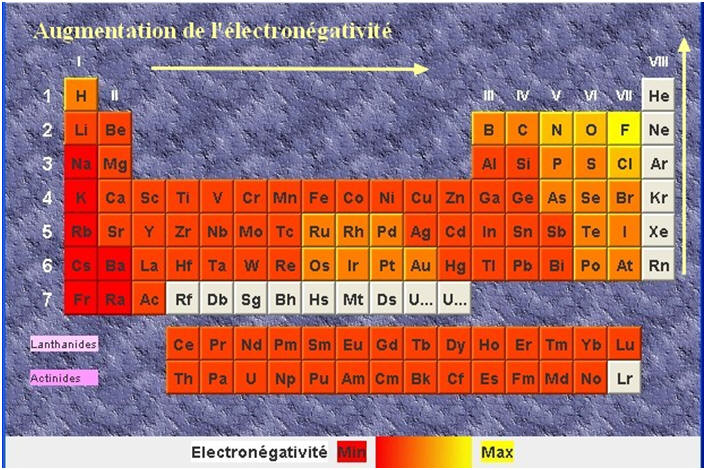
- L’électronégativité d’un élément traduit la tendance d’un atome de cet élément à attirer le doublet d’électrons d’une liaison covalent qu’il forme avec un autre atome.
- Plus un élément est électronégatif, plus il attire à lui le doublet d’électrons de la liaison covalent.
- L’électronégativité varie selon la place de l’élément dans la classification périodique, ceci à l’exception des gaz nobles.
- Cette propriété est liée à la règle du duet et de l’octet.
- Sur une même ligne, l’électronégativité augmente de gauche à droite.
- Dans une même colonne, elle augmente de bas en haut.
- Les alcalins ont tendance à perdre des électrons, alors que les halogènes ont tendance à gagner des électrons.
- Ainsi, ils peuvent acquérir la structure des gaz nobles.
2)- Polarité d’une liaison covalente et moment dipolaire.
► Exemple : La molécule de chlorure d’hydrogène.
- Le chlorure d’hydrogène est constitué de molécules HCl dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore par une liaison covalente.
|
Représentation de Lewis |
Caractéristiques géométriques |
|
|
|
|
dH – Cl ≈
127 pm |
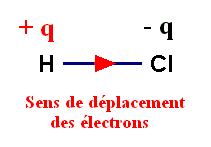
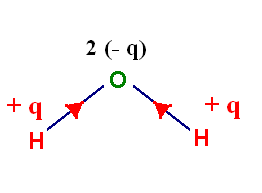
- Le chlore est beaucoup plus électronégatif que l’hydrogène.
- Il attire vers lui le doublet de liaison : on dit que la liaison H – Cl est polarisée.
- Cette polarisation fait apparaître :
- Un excédent de charge négative, noté – q, sur l’atome de chlore (q représente une charge partielle).
- Un excédent de charge positive, noté + q, sur l’atome d’hydrogène.
- La molécule de chlorure d’hydrogène a un caractère dipolaire : elle constitue un dipôle électrique.
- Elle peut être représentée par un dipôle portant les charges – q et + q
|
|
Dipôle électrique
équivalent
|
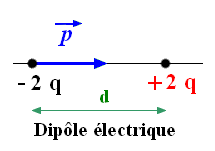
- Un dipôle électrique : ADDITIF
- Un dipôle électrique est l’ensemble constitué par 2 charges électriques opposées – q et + q séparées par la distance d.
- Un dipôle électrique possède un moment dipolaire , colinéaire à la liaison et orienté du pôle – vers le pôle + du dipôle.
- Le moment dipolaire s’exprime en debye symbole D :
- Exemple pour la molécule de chlorure d’hydrogène : p (H – Cl) = 1,1 D.
- Conclusion : Une liaison covalente est polarisée lorsque les deux atomes liés ont des électronégativités différentes.
3)- Polarité d’une molécule.
a)- Molécules diatomiques :
- Une molécule, constituée de deux atomes A et B, est polarisée si ces deux atomes ont des électronégativités différentes.
- Plus la différence d’électronégativité est importante :
- Plus la liaison est polarisée
- Et plus le moment dipolaire p (A – B) est grand.
- Une molécule diatomique constituée de deux atomes identiques est apolaire.
- Une molécule diatomique constituée de deux atomes différents est généralement polaire.
b)- Molécules polyatomiques possédant plus de deux atomes.
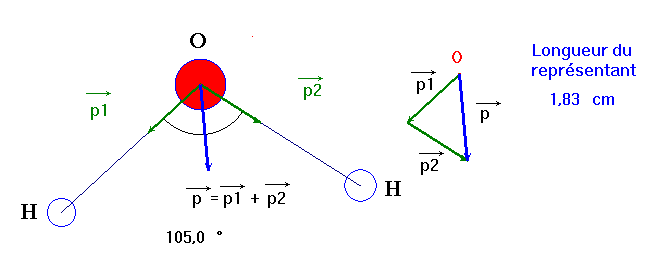
► Cas de la molécule d’eau : H2O (voir l’expérience 2)
|
Représentation de Lewis |
Caractéristiques
géométriques |
|
|
|
|
Molécule coudée
dH –
O ≈
96 pm
α ≈
105 °
|
- L’oxygène est plus électronégatif que l’hydrogène.
- Les deux liaisons covalentes O – H d’une molécule d’eau sont polarisées.
- Le moment dipolaire de la liaison O – H est tel que p (H – O) = 1,5 D
- Le moment dipolaire résultant est égal à la somme vectorielle des moments dipolaires des deux liaisons O – H.
|
|
Moment dipolaire résultant : Échelle : 1 cm ↔ 1 D
|
|
Dipôle électrique équivalent
Comme la molécule d’eau est coudée, le moment dipolaire résultant n’est pas nul.
La molécule d’eau a un moment dipolaire p (H2O) ≈ 1,8 D. La molécule présente un caractère dipolaire. On dit qu’elle est polaire. L’eau constituée de molécules polaires est un solvant polaire. |
|
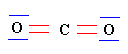
► Cas du dioxyde de carbone :
- La molécule de dioxyde de carbone est-elle polaire ou apolaire ? Justifier.
- On donne une indication :
- L’atome d’oxygène est plus électronégatif que l’atome de carbone.
- Le moment dipolaire de la liaison C = O est tel que p (C = O) = 2,3 D
|
Représentation de Lewis |
Caractéristiques géométriques |
|
|
|
|
Molécule linéaire
dC
= O
≈
116 pm |
- L’oxygène est plus électronégatif que le carbone.
- Les deux liaisons covalentes O = C d’une molécule de dioxyde de carbone sont polarisées.
- Il en résulte l’apparition de charges partielles - q sur chaque atome d’oxygène et d’une charge partielle 2 (+ q) sur l’atome de carbone.
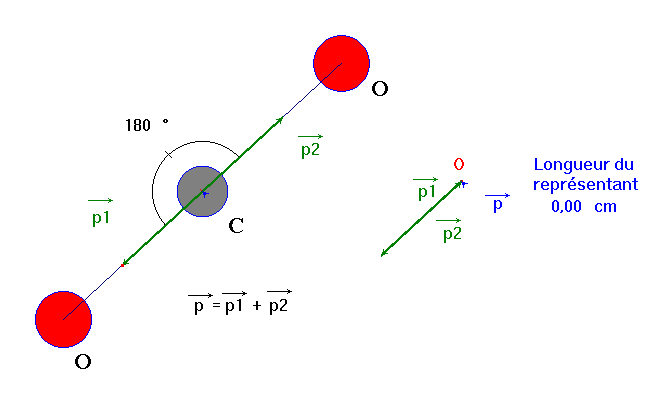
- Mais la molécule de dioxyde de carbone est une molécule linéaire.
|
|
|
Comme la molécule de dioxyde de carbone est linéaire, le moment dipolaire résultant est nul.
La molécule de dioxyde de carbone est une molécule apolaire. |
![]() Conclusion :
Conclusion :
- Pour une molécule polyatomique, le moment dipolaire est la somme géométrique des moments dipolaires associés à chaque liaison.
- Le moment dipolaire résultant est lié à la géométrie de la molécule.
III- Cohésion des solides moléculaires.
1)- Les solides moléculaires.
- Un cristal moléculaire est un assemblage compact et ordonnée de molécules.
- La cohésion des solides moléculaires est assurée par deux types d’interactions moléculaires :
- L’interaction de Van Der Waals,
- Les liaisons hydrogène.
- La cohésion des solides moléculaires est nettement moins forte que la cohésion des solides ioniques.
- L’interaction de Van Der Waals est moins forte que l’interaction électrostatique.
- Il suffit de comparer les températures de fusion de solides ioniques et de solides moléculaires pour mettre en évidence cette différence.
- La température de fusion de l’eau est égale à 0 ° C alors que la température de fusion du chlorure de sodium est égale à 801 ° C.
2)- Les interactions de Van Der Waals.
- L’interaction de Van Der Waals résulte de l’interaction entre dipôles électriques.
► Cas de molécules polaires :
- Dans ces molécules, il y a des interactions électrostatiques entre les dipôles qui sont des dipôles permanents.
- Ce sont ces interactions entre les dipôles permanents qui assurent la cohésion du solide moléculaire.
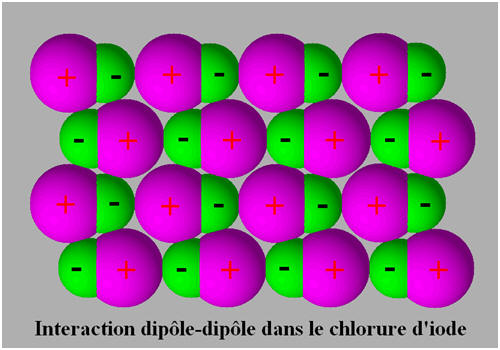
- C’est le cas du chlorure d’iode
- Le chlorure d'iode I – Cl se présente, à température ambiante, sous la forme d'un liquide rouge très foncé.
- Sa température de fusion est 13,9 ° C.
- La liaison I – Cl est polarisée : p (I – Cl) = 1,5 D.
- Le chlore est plus électronégatif que l’iode (le chlore est situé 2 cases au-dessus de l’iode dans la classification périodique).

- Dans le cristal moléculaire, les molécules s’orientent de telle manière que l’atome d’iode (pôle +) soit toujours voisin d’un atome de chlore (pôle –).
- Schéma :
► Cas de molécules apolaires :
- On peut prendre comme exemple de cristal moléculaire, le diiode qui est constitué d’un empilement compact et ordonnée de molécules de diiode I – I.
- La molécule de diiode est apolaire car elle est constituée de deux atomes identiques.
- Mais les électrons n’ont pas de position définie.
- Ils ont une probabilité de présence dans le nuage électronique qui entoure les noyaux.
- Les électrons se déplacent à grande vitesse et ont un mouvement permanent.
- À un instant donné, il se peut que les électrons soient plus proches d’un des noyaux.
- Il apparaît alors un dipôle électrique instantané au sein de la molécule.
- Ce dipôle instantané engendre la création d’autres dipôles instantanés et ceci de proche en proche.
- C’est l’interaction électrique entre ces dipôles instantanés qui assurent la cohésion du cristal moléculaire constitué de molécules apolaires.
► Conclusion :
- La cohésion d’un cristal moléculaire est assurée par les interactions de Van Der Waals qui découlent de l’interaction entre dipôles permanents ou dipôles instantanés.
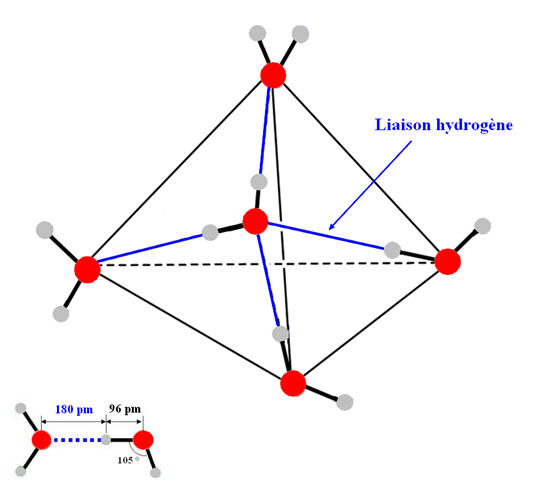
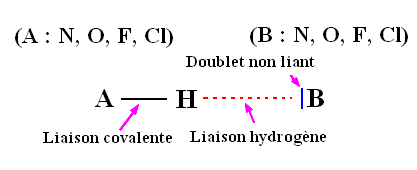
3)- La liaison hydrogène.
- Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un atome B, également très électronégatif et porteur d’un ou plusieurs doublets non liants.
- Les atomes A et B qui interviennent généralement sont : l’azote N, l’oxygène O, le fluor F et le chlore Cl.
- Les trois atomes qui participent à la liaison hydrogène sont généralement alignés.
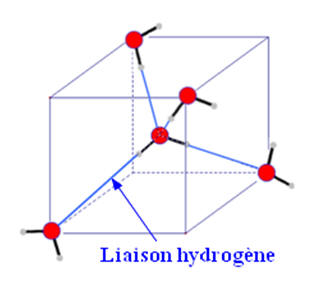
- Les molécules qui possèdent le groupe – O – H forment des liaisons hydrogènes.
- C’est le cas des alcools comme l’éthanol, de l’eau dans la glace.
- Ces liaisons hydrogènes participent à la cohésion du cristal.
- Dans ce cas, la cohésion du cristal est due aux liaisons hydrogène et aux interactions de Van Der Waals.
- Représentation de la liaison hydrogène :
- Structure de la molécule d’eau à l’état solide :
- Représentation dans un cube :
- Représentation dans un tétraèdre :
IV- Chauffage d’un solide et changement d’état physique.
1)- Les états de la matière.
a)- L’état gazeux.
- L’état gazeux est un état dispersé.
- Les molécules ou les atomes sont éloignés les uns des autres et se déplacent dans toutes les directions de façon désordonnée.
- Les interactions entre les entités chimiques sont faibles.
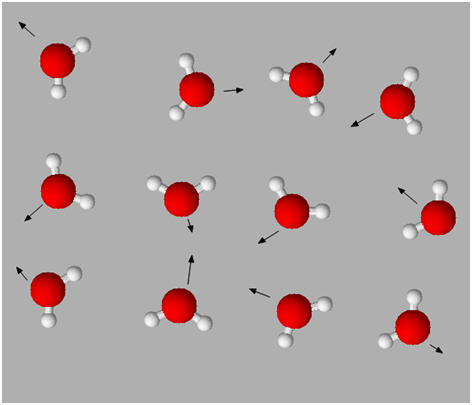
b)- L’état liquide et l’état solide.
- L’état liquide comme l’état solide est un état condensé.
- À l’état liquide, les entités chimiques sont les unes contre les autres et peuvent glisser les unes sur les autres.
-
Les entités chimiques sont en mouvement constant.
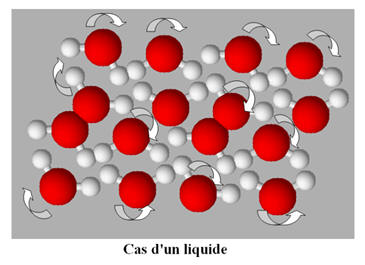
- À l’état solide, les entités chimiques sont en contact les unes avec les autres.
- On est en présence d’un assemblage compact et ordonné.
- Les entités chimiques sont en vibration constante autour d’une position d’équilibre.
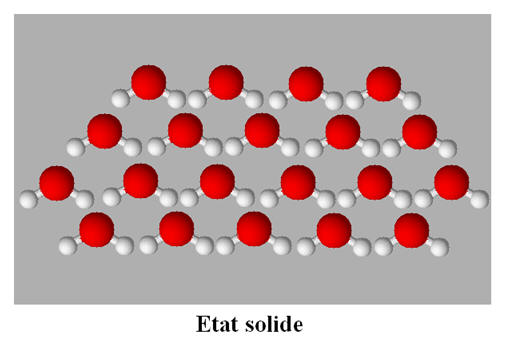
- Les particules dans la matière condensée sont soumises à des interactions attractives qui les maintiennent en contact les unes avec les autres, tandis que les interactions répulsives leur imposent des structures d’empilement.
- Exemples : Chlorure de sodium et glace.
2)- Transferts thermiques.
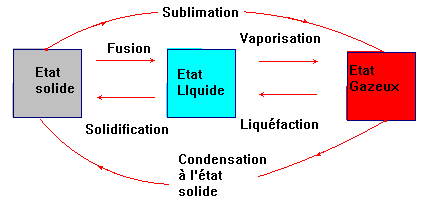
► Changements d’état physique :
► On chauffe un solide moléculaire :
- Lorsque l’on chauffe un solide moléculaire, la chaleur que reçoit le solide est transformée en énergie cinétique Ec.
- L’agitation des molécules qui constituent le solide augmente.
- Quand cette agitation est suffisante, des interactions de Van Der Waals, qui assurent la cohésion du cristal sont rompues et l’édifice cristallin se disloque.
-
Toute l’énergie thermique fournie au cristal est
utilisée pour rompre les interactions intermoléculaires
(Van der Waals et liaisons hydrogène), l’agitation des molécules
n’augmente pas.
- Les molécules restent en contact mais se séparent.
- Il n’y a plus de disposition régulière dans l’espace.
- C’est la fusion : on passe de l’état solide à l’état liquide.
- Au cours de la fusion, l’énergie thermique fournie au cristal est utilisée pour rompre des interactions de Van Der Waals.
- La température reste constante pendant toute la durée de la fusion.
- Une fois toute l’espèce moléculaire à l’état liquide, l’agitation thermique augmente à nouveau et la température aussi.
- Au fur et à mesure que la température augmente, les interactions de Van Der Waals existant entre les molécules sont de moins en moins nombreuses, puis disparaissent totalement :
- C’est la vaporisation : on passe de l’état liquide à l’état gazeux.
- Au cours de la vaporisation, l’énergie thermique fournie au cristal est utilisée pour rompre les interactions de Van Der Waals.
- La température reste constante pendant toute la durée de la vaporisation.
- Une fois toute l’espèce moléculaire à l’état gazeux, l’agitation thermique augmente à nouveau et la température augmente.
- Il règne le chaos moléculaire.
- Ceci est valable pour le diiode I2, pour l’eau H2O, …
- Pour l’eau, en plus des interactions de Van Der Waals, il faut rompre les liaisons hydrogène.
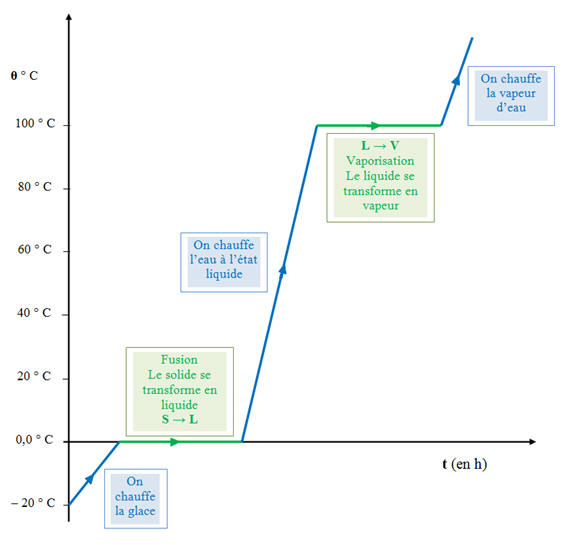
► Cas de l’eau : On chauffe un morceau de glace pris à - 20 °C,
- Dans un premier temps, la quantité de chaleur cédée au système (le bloc de glace) permet augmenter la température de la glace.
- Lorsque la température du bloc de glace est égale à 0 °C (température de fusion de l’eau), la glace fond à température constante.
- La quantité de chaleur cédée au système transforme la glace (eau à l'état solide) en eau à l'état liquide.
- Lorsque toute la glace a disparu, la quantité de chaleur cédée au système permet d'augmenter la température de l'eau à l'état liquide.
- Lorsque la température de l'eau à l'état liquide est égale à 100 °C (température de vaporisation de l’eau sous la pression atmosphérique), elle se transforme en vapeur d'eau à température constante.
- La quantité de chaleur cédée au système transforme l’eau à l'état liquide en de l’eau à l'état gazeux.
- Diagramme :
- un transfert d'énergie sous forme de chaleur modifie l'énergie microscopique du système
3)- Conclusions.
- L’énergie thermique apportée à un corps pur moléculaire peut :
- Provoquer une augmentation de la température avec rupture des interactions intermoléculaires et accroissement de l’agitation des molécules
- Provoquer un changement d’état physique avec seulement rupture d’interactions intermoléculaires, la température restant constante.
V- Applications.
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 7 page 164. Identifier la nature des charges électriques.
b)- Exercice 9 page 164. Connaître la loi de Coulomb.
c)- Exercice 10 page 164. Déterminer la formule de cristaux ioniques.
d)- Exercice 13 page 164. Rechercher des molécules polaires.
e)- Exercice 15 page 165. Identifier des interactions de Van Der Waals
f)- Exercices 16 page 165. Rechercher la présence de liaisons hydrogène.
g)- Exercice 17 page 165. Interpréter des effets thermiques.
h)- Exercice 21 page 166. Géométrie des molécules et polarité.
i)- Exercice 26 page 167. Évolution de température de fusion.
|
|