|
Chim. N° 02 |
Solutions électrolytiques et concentration. Cours. |
|
|
Programme 2011 : Chim. N° 05 Dissolution de composés ioniques et moléculaires. Programme 2011 : Physique et Chimie Programme 2020 : Physique et chimie |
|
QCM :
|
|
énoncé avec correction 1)- Exercices 3 page 56. 2)- Exercice 6 page 56. 3)- Exercice 10 page 57. 4)- Exercice 17 page 57. 5)- Exercice 19 page 58. |
Pour aller plus loin :
|
Mots clés : dissolution ; solide ionique, molécules polaires ; solvatation des ions ; solution électrolytique ; courant électrique dans les solutions ; ... |
|
|
|
- Lorsqu’on dissout une espèce chimique dans un liquide on obtient une solution. - L’espèce chimique dissoute est appelée le soluté. - Le liquide dans lequel on dissout l’espèce chimique est appelé le solvant. - Si le solvant utilisé est l’eau, on obtient une solution aqueuse. |
- Dissolution du sucre (le glucose) dans l’eau : on obtient une solution sucrée qui est une solution aqueuse qui contient des molécules de glucose.
- Dissolution du permanganate de potassium dans l’eau : on obtient une solution aqueuse colorée qui contient des ions permanganate et des ions sodium.
- Dissolution de chlorure de sodium dans l’eau. On obtient une solution aqueuse salée qui contient des ions chlorure et des ions sodium.
|
- Remarque : dans l’eau, on peut dissoudre des solides, des liquides ou des gaz. |
- Exemples : solide : chlorure de sodium, liquide : éthanol et gaz : le dioxygène, le dioxyde de carbone,
- Certaines espèces chimiques sont insolubles dans l’eau comme le sable, l’huile.
- Une espèce chimique est insoluble dans l’eau si on la retrouve tel quelle en présence d’eau.
- Exemple : le diiode est très peu soluble dans l’eau.
- Le soluté n’est pas totalement dissous. La solution obtenue est saturée. Il y a dans ce cas un dépôt de solide au fond du récipient.
|
- Une solution est un liquide homogène contenant plusieurs constituants. - L’espèce chimique mise en solution peut être constituée de : - Molécules (solide moléculaire, liquide ou gaz) - D’ions (solides ioniques). |
- Le soluté est ionique si la solution obtenue est formée d’ions parmi des molécules d’eau.
- C’est le cas de la solution aqueuse de sulfate de cuivre II.
- La solution contient des ions cuivre II et des ions sulfate.
- Lors de la réalisation de la solution avec le cristal ionique, le soluté réagit avec l’eau.
- Le soluté est moléculaire si la solution obtenue contient des molécules de soluté (soluté moléculaire) et des molécules d’eau.
- Lors de la réalisation de la solution, le soluté ne réagit pas avec l’eau.
- C’est le cas de la solution de saccharose (C12H22O11) et de celle du diiode.
- La solution de saccharose contient des molécules de saccharose et celle de diiode contient des molécules de diiode et des molécules de solvant : l’eau.
- Remarque :
- Il se peut que le soluté moléculaire réagisse partiellement avec l’eau pour donner des ions.
- La solution aqueuse contient alors : des ions et des molécules de soluté n’ayant pas réagi.
|
- De manière générale, une solution aqueuse peut contenir - des molécules - des ions - des molécules et des ions. |
- Une solution électrolytique (solution ionique) est une solution qui contient des ions.
- Elle conduit le courant électrique.
- On prépare une solution ionique par dissolution dans un solvant (le plus souvent l’eau)
- de solides ioniques, de liquides ou de gaz constitués de molécules polaires.
- Le soluté est appelé électrolyte et les solutions ioniques sont électriquement neutres.
1)- Structure d’un solide ionique
- Exemple : le chlorure de sodium.
- Le chlorure de sodium est constitué d ‘un assemblage compact et ordonné d’ions sodium et d’ions chlorure.
- La formule statistique du cristal est NaCl.
- Le cristal est électriquement neutre.
- Il contient autant d’ions sodium que d’ions chlorure.
- Cette maille élémentaire se reproduit dans les trois directions de l’espace.

- Chaque ion se trouve en contact avec des ions de signes contraires.
- Il en résulte une structure régulière dans laquelle un motif se répète à des millions d’exemplaires.
- Le motif est appelé maille élémentaire.

- On obtient un cristal à l’échelle macroscopique.
- Application : La fluorine est un cristal ionique constitué d’un empilement compact et ordonné d’ions calcium et d’ions fluorure F–.
Cliquer sur l'image pour l'agrandir
- Les ions calcium proviennent d’un atome de calcium ayant perdu deux électrons.
![]() Écrire la formule de l’ion calcium et en déduire la formule
statistique et le nom de la fluorine.
Écrire la formule de l’ion calcium et en déduire la formule
statistique et le nom de la fluorine.
|
- Réponse : L’ion calcium porte une charge électrique positive : Ca 2+ - Le cristal est électriquement neutre, il faut un ion calcium pour deux ions fluorure. - La formule statistique est la suivante : CaF2 - Le nom : Le fluorure de calcium. - Dans l’écriture de la formule d’un solide ionique, les charges ne figurent pas. - Par convention, on choisit les plus petits indices qui assurent l’électroneutralité du cristal. - La formule statistique indique la nature et la proportion des ions présents dans le cristal sans mentionner les charges. |
2)- Cohésion d’un cristal ionique.
- La cohésion du cristal ionique est due aux forces d’interactions électriques :
- Les forces d’attraction électriques entre les ions de signes opposés l’emportent sur les forces de répulsions entre les ions de même signe.
III-
Caractère dipolaire d’une molécule.![]()
1)- Électronégativité d’un élément chimique.
- L’électronégativité d’un élément traduit la tendance d’un atome de cet élément à attirer le doublet d’électrons d’une liaison covalent qu’il forme avec un autre atome.
- Plus un élément est électronégatif, plus il attire à lui le doublet d’électrons de la liaison covalent.
- L’électronégativité varie selon la place de l’élément dans la classification périodique, ceci à l’exception des gaz nobles.
- Cette propriété est liée à la règle du duet et de l’octet.
- Sur une même ligne, l’électronégativité augmente de gauche à droite.
- Dans une même colonne, elle augmente de bas en haut.
- Les alcalins ont tendance à perdre des électrons, alors que les halogènes ont tendance à gagner des électrons.
- Ainsi, ils peuvent acquérir la structure des gaz nobles.
- Règles du DUET et de l'OCTET
- Ces règles ont été énoncées par Gilbert LEWIS (1875 – 1946) en 1916.
- Chimiste américain, LEWIS a énoncé les règles permettant d’établir la structure électronique des atomes.
- En 1916, il propose le modèle de la liaison de covalence et la règle de l’octet.
- Il est également l’auteur d’une théorie des acides et des bases.
|
► Au cours des transformations chimiques, les atomes tendent à acquérir la structure électronique du gaz rare de numéro atomique le plus proche : - Soit 2 électrons sur la couche électronique externe - lorsque ce gaz rare est Hélium c’est la règle du DUET. - Soit 8 électrons sur la couche électronique externe, - c’est la règle de l’OCTET. - Ils acquièrent de ce fait une stabilité maximale. |
- Remarques :
- Pour satisfaire à ces règles, les atomes disposent de 2 moyens :
- Soit par un transfert d’électrons entre deux atomes différents pour donner des ions,
- Soit par la mise en commun d’électrons entre différents atomes pour donner des molécules.
2)- La molécule de chlorure d’hydrogène.
- Le chlorure d’hydrogène est constitué de molécules HCl dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore par une liaison covalente.
|
Représentation de Lewis |
Caractéristiques géométriques |
|
|
|
|
d H - Cl ≈ 127 pm |
- Le chlore est beaucoup plus électronégatif que l’hydrogène.
- Il attire vers lui le doublet de liaison : on dit que la liaison H − Cl est polarisée.
- Cette polarisation fait apparaître :
- Un excédant de charge négative, noté
δ –,
sur l’atome de chlore (δ
représente une charge
partielle).
- Un excédant de charge positive, noté
δ +,
sur l’atome d’hydrogène.
- La molécule de chlorure d’hydrogène a un caractère dipolaire : elle constitue un dipôle électrique.
|
|
|
- La grandeur δ – représente une charge partielle négative et δ + représente une charge partielle positive.
- Une liaison covalente est polarisée lorsque les deux atomes liés ont des électronégativités différentes.
|
Représentation de Lewis |
Caractéristiques géométriques |
|
|
|
|
Molécule
coudée d H - O ≈ 96 pm α ≈ 105 ° |
- L’oxygène est plus électronégatif que l’hydrogène.
- Les deux liaisons covalentes O − H d’une molécule d’eau sont polarisées.
- Il en résulte l’apparition de charges partielles 2 δ – sur l’atome d’oxygène et d’une charge partielle δ + sur chaque atome d’hydrogène.
|
|
|
|
|
Dipôle électrique équivalent |
- Remarque :
- Du point de vue de la répartition des charges, les deux charges partielles δ + sont équivalentes à une charge unique 2 δ + située au point K.
- Pour des raisons de symétrie, le point K est situé au milieu du segment HH’.
- C’est le barycentre des charges positives.
|
- Barycentre de deux charges électriques : Le barycentre de 2 charges électriques q1 et q2 est un point de l’espace où une charge q = q1 + q2 aurait le même effet que les deux charges q1 et q2 qu’elle remplace. |
- Comme le barycentre des charges positives ne coïncide pas avec le barycentre des charges négatives, la molécule présente un caractère dipolaire.
- On dit qu’elle est polaire.
- L’eau constituée de molécules polaires est un solvant polaire.
- Expérience ;
- On peut voir expérimentalement que la molécule d’eau est polaire en frottant une règle en plastique avec de la laine et en l’approchant d’un mince filet d’eau.
- Le filet d’eau est dévié.
- Lorsqu’on frotte une règle en plastique (PVC) avec un chiffon de laine, celle-ci s’électrise positivement.
- Quand on l’approche du mince filet d’eau, celui-ci est attiré.
- Lorsqu’on frotte une règle en plastique (PVC) avec un chiffon de nylon, celle-ci s’électrise négativement.
- Quand on l’approche du mince filet d’eau, celui-ci est attiré.
4)- Caractère dipolaire d’une molécule.
|
Une liaison covalente entre deux atomes est polarisée si ces deux atomes sont différents. Une molécule dans laquelle le barycentre des charges positives n’est pas confondu avec le barycentre des charges négatives est polaire. La molécule constitue alors un dipôle électrique. |
- Il existe des molécules polaires comme la molécule de chlorure d’hydrogène et la molécule d’eau.
- Certaines molécules ne sont pas polaires : elles sont apolaires.
- Exemples de molécules apolaires : les molécules diatomiques dont les deux atomes sont identiques sont apolaires (I2, O2,…)
- Application : la molécule de dioxyde de carbone est-elle polaire ou apolaire ? Justifier.
- On donne une indication : l’atome d’oxygène est plus électronégatif que l’atome de carbone.
|
Représentation de Lewis |
Caractéristiques
géométriques |
|
|
|
|
molécule linéaire d C - O ≈ 116 pm |
- L’oxygène est plus électronégatif que le carbone. Les deux liaisons covalentes O = C d’une molécule de dioxyde de carbone sont polarisées.
- Il en résulte l’apparition de charges partielles δ – sur chaque atome d’oxygène et d’une charge partielle 2 δ + sur l’atome de carbone.
|
|
|
Le barycentre des charges positives est confondu
avec le barycentre des charges négatives |
1)- Le phénomène de solvatation.
- Ce phénomène concerne tous les ions en solution.
- Prenons comme exemple une solution aqueuse de chlorure de sodium.
- Le soluté est le chlorure de sodium, le solvant est l’eau.
- Les ions sodium sont chargés positivement et les ions chlorure négativement.
- Dans cette solution on n’observe pas d’agrégats d’ions positifs et négatifs.
- Comme l’eau est un solvant polaire, des molécules d’eau vont entourer les ions présents dans la solution.
- Chaque ion est entouré d’un cortège de molécules d’eau qui les éloignent des autres ions et ‘’masque’’ leur charge électrique.
- On dit que les ions ont été solvatés.
- On parle de solvatation des ions.
- Si le solvant est l’eau, on parle d’hydratation des ions : les ions dans ce cas sont hydratés.
- Ce phénomène ne se produit que lorsque le solvant est polaire.
- Chaque molécule de solvant se comporte comme un dipôle électrique.
- Il existe une interaction électrique entre l’ion et les molécules du solvant.
- Dans le cas d’un anion, il y a une interaction électrique attractive entre l’ion et le pôle + du dipôle.
- Dans le cas d’un cation, il y a une interaction électrique attractive entre l’ion et le pôle − du dipôle.
- Notation : En solution aqueuse, on utilise la notation simplifiée suivante pour les ions hydratés :
- Exemple pour l’ion sodium hydraté : Na+ (aq) ; pour l’ion chlorure : Cl – (aq).
- Exemple : L’ion cuivre II solvaté s’entoure de 6 molécules d’eau, on le note Cu (H2 O)62 +
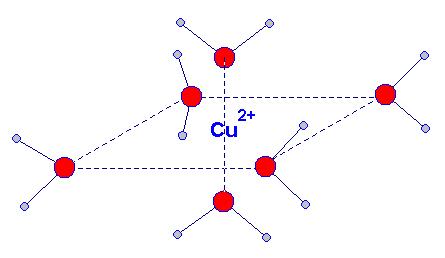
- La notation simplifiée donne : Cu 2+ (aq).
2)- Rôle de l’eau dans la dissolution.
Pour obtenir une solution aqueuse électrolytique, il faut dissoudre :
- Soit un solide ionique.
- Soit un liquide ou un gaz constitués de molécules polaires.
- Cas des solides ioniques :
- Lorsqu’on introduit un cristal ionique dans l’eau, les molécules d’eau grâce à leur caractère dipolaire entre en interaction avec les ions qui constituent le cristal.
- Elles cassent totalement les liaisons ioniques qui assurent la cohésion du réseau cristallin.
- Puis les molécules d’eau hydratent les ions qui se dispersent de manière aléatoire.
- On obtient une solution ionique ou électrolytique.
- Cas d’une molécule polaire :
- Les molécules, d’eau grâce à leur caractère dipolaire, entrent en interaction avec les molécules dipolaires.
- Des liaisons intermoléculaires se créent entre les molécules de soluté et les molécules d’eau.
- Ces liaisons affaiblissent les liaisons covalentes qui se cassent pour donner des ions. Les ions formés s’hydratent et se dispersent dans la solution.
- Exemple :
- Le Chlorure d’hydrogène (gaz) dans l’eau, on obtient des ions chlorure et des ions hydrogène hydratés.
- Conclusion :
- La dissolution d’un soluté dans l’eau est une transformation chimique due à l’interaction des molécules d’eau avec le soluté.
- Cette dissolution se fait en deux étapes :
- Première étape : la dissociation du soluté (rupture des liaisons assurant la cohésion du soluté)
- Deuxième étape : l’hydratation et dispersion des ions.
3)- Un cas particulier : la solvatation du proton.
- L’ion hydrogène correspond à un proton.
- En solution aqueuse, le proton est entouré de molécules d’eau.
- On peut le représenter par la notation simplifiée suivante : H+ (aq).
- Or, l’ion hydrogène est très petit.
- L’interaction entre une molécule d’eau et l’ion hydrogène est suffisamment grande pour donner une liaison assez forte pour former l’ion oxonium H3O+
|
|
|
4)- Équation de dissolution et formule des solutions électrolytiques.
- Exemple :
- Préparation de la solution aqueuse de chlorure de sodium.
- On dissout du chlorure de sodium (solide ionique blanc) dans l’eau.
- C’est une transformation chimique que l’on peut traduire par l’équation simplifiée suivante : NaCl (s)
|
H2O |
||
|
NaCl
(s)
→ |
||
- Formule de la solution aqueuse de chlorure de sodium : (Na+ (aq) + Cl −(aq))
- Préparation de la solution aqueuse de chlorure d’hydrogène appelée acide chlorhydrique :
- On dissout du chlorure d’hydrogène (gaz) dans l’eau.
|
H2O |
||
|
HCl
(g)
→ |
||
- Autre
écriture : HCl
(g) +
H2O
(ℓ)
→
- Formule de la solution aqueuse : (H + (aq) + Cl −(aq)) ou (H3O+ (aq) + Cl −(aq))
- Application : Préparation d’une solution de soude. On dissout des pastilles d’hydroxyde de sodium.
- On obtient une solution aqueuse appelée soude.
- Écrire l’équation de dissolution, la formule de la solution de soude et son nom.
- Équation de dissolution :
|
H2O |
||
|
NaOH
(s)
→ |
||
- Formule de la solution : ( Na + (aq) + HO −(aq))
- Nom : Solution aqueuse d’hydroxyde de sodium.
1)- Concentration molaire en soluté apporté.
- Relation :
|
► C(s) concentration en soluté apporté en mol / L ► n(s) quantité de matière de soluté apporté en mol ► V volume de la solution aqueuse obtenue en L. |
- Application : On prépare une solution aqueuse de sulfate de sodium.
- Pour ce faire, on dissout une masse m = 14,2 g de soluté dans l’eau.
- Le volume de la solution obtenue est V = 0,50 L.
- Déterminer la concentration en soluté apporté de cette solution.
- Concentration de la solution en soluté apporté :
- Relation 1 :
|
C (S) = |
n (S) |
|
|
|
|
V |
- Relation 2 :
|
n (S) = |
m (S) |
|
|
|
|
M (S) |
- En combinant 1 et 2, il vient :
|
C (S) = |
n (S) |
|
|
|
|
V . M (S) |
- Masse molaire du soluté :
- M (s) = 2 M (Na) + M (S) + M (O)
- M (s) = 2 × 23,0 + 32,1 + 4 × 16,0
- M (s) ≈142 g / mol
- Concentration en soluté apporté :
|
C (S) = |
m (S) |
14,2 |
||||
|
|
= |
|
|
|
|
|
|
V . M (S) |
0,50 × 142,1 |
|||||
|
C (S) ≈ 0,20 mol / L |
||||||
2)- Concentration molaire d’une espèce dissoute.
- Soit X l’espèce dissoute. L’espèce X peut être une molécule ou un ion.
- Notation de la concentration de l’espèce chimique en solution : [ X ]
- Relation :
|
► [ X ] concentration de l’espèce X en mol / L ► n (X) quantité de matière de l’espèce X en mol ► V volume de la solution aqueuse en L. |
- Application : Déterminer la concentration en ions sodium et en ions sulfate de la solution précédente.
- Pour pouvoir résoudre cet exercice, il faut utiliser l’équation de dissolution.
|
H2O |
||
|
Na2 S
O4
(s)
→ |
||
|
n (S) 2 n (S) n (S) |
||
- Concentration des ions sulfate.
|
[S O 4 −] = |
n (S) |
|||||
|
|
|
|
|
|
|
|
|
V |
||||||
|
[S O 4 −] = C (S) ≈ 0,20 mol / L |
||||||
- Concentration des ions sodium :
|
[Na +] = |
2 n (S) |
|||||
|
|
|
|
|
|
|
|
|
V |
||||||
|
[Na +] = 2 C (S) ≈ 0,40 mol / L |
||||||
- Remarque 1 :
- La concentration effective d’un ion dans la solution peut-être différente de la concentration en soluté apporté.
- Remarque 2 :
- L’écriture [ Na2SO4] n’a pas de sens car l’espèce Na2SO4 n’existe pas en solution.
- Ceci est une formule statistique.
- On est en présence d'un cristal ionique et non d'une molécule.
- Globalement, le cristal est électriquement neutre.
- On indique dans la formule qu'il y a deux ions sodium pour un ion sulfate.
- On écrit la formule des ions sans faire apparaître les charges.
- On écrit d'abord le cation, puis l'anion.
- Que signifie l’indication portée sur le flacon suivant ? à finir
| QCM :
Dissolution et solvatation (tableau) Solutions électrolytiques (Questy) Quantité de matière et concentration (tableau) Quantité de matière et concentration (Questy) |
énoncé avec correction