|
Chap. N° 10 |
Représentation spatiale des molécules. Cours. |
|
|
|
|
II- Représentation des
molécules organiques. |
|
III- Les différentes relations
de stéréoisomérie.
b)- Stéréoisomères de conformation :
c)- Stéréoisomères de configuration. 2)- Stéréoisomérie de configuration : Cas des composés à un atome de carbone asymétrique.
b)- Énantiomérie et propriétés :
3)- Stéréoisomérie de configuration : Cas des composés à deux atomes de carbone asymétrique. 4)- Stéréoisomérie de
configuration : diastéréoisomères
Z / E. 5)- Stéréoisomérie de
conformation. |
|
Stéréochimie Les molécules ont été réalisées avec Schemsketch  Logiciel Gratuit
Logiciel Gratuit |
|
Exercices : énoncé et correction a)- Exercice 7 page 270 : Reconnaître une molécule chirale. b)- Exercice 8 page 270 : Utiliser la représentation topologique. c)- Exercice 10 page 270 : établir une représentation de Cram. d)- Exercice 15 page 271 : Représenter un couple d’énantiomères. e)- Exercice 17 page 272 : de la formule semi-développée à la formule
topologique. f)-
Exercice 20 page 272 : La vitamine C. g)- Exercice 22 page 273 : Autour des acides α–aminés. h)- Exercice 28 page 275 : Phéromone sexuelle de coléoptère. |

- Un objet est chiral s’il n’est pas superposable à son
image dans un miroir.
- La chiralité est la propriété d'un objet de ne pas être
superposable à son image dans un miroir.
- Donner un exemple d'un objet chiral. (Une
main)
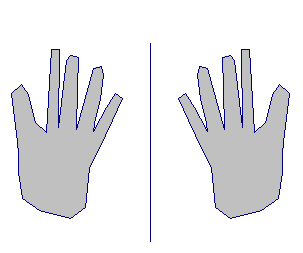
- La chiralité a été étendue aux molécules par PASTEUR en
1848.
2)- La
chiralité au niveau moléculaire.
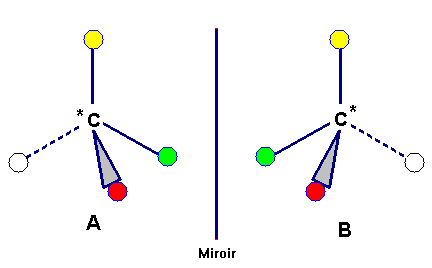
![]() Construire une molécule
A possédant :
Construire une molécule
A possédant :
![]() Un
carbone tétragonal et quatre groupes différents (prendre une
boule rouge, une
verte, une boule
jaune et une boule blanche).
Un
carbone tétragonal et quatre groupes différents (prendre une
boule rouge, une
verte, une boule
jaune et une boule blanche).
![]() Placer la liaison carbone-boule jaune
verticalement.
Placer la liaison carbone-boule jaune
verticalement.
![]() Mettre la molécule A devant un miroir et
construire la molécule B image de A dans le
miroir.
Mettre la molécule A devant un miroir et
construire la molécule B image de A dans le
miroir.
![]() Représenter les deux molécules
A et B
à l'aide de la représentation conventionnelle.
Représenter les deux molécules
A et B
à l'aide de la représentation conventionnelle.
![]() Les
molécules A et B sont-elles superposables ?
Les
molécules A et B sont-elles superposables ?
Animation CabriJava
- Les molécules A et B ne sont pas superposables, elles sont image l'une de l'autre dans un miroir.
- Ce sont des
molécules chirales.
- Une molécule est chirale si elle n’est pas superposable à
son image dans un miroir.
II- Représentation des
molécules organiques.
1)-
Formules planes.
► Une molécule peut être représentée par :
- Sa formule développée,
- Sa formule semi-développée,
- Sa formule topologique.
- Cours de première S. De la structure aux propriétés des alcanes et des alcools
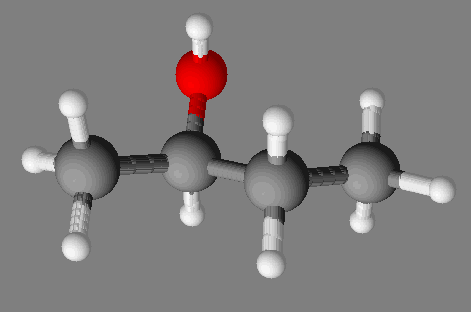
![]() Donner
les représentations de la molécule de butan-2-ol.
Donner
les représentations de la molécule de butan-2-ol.
- Modèle moléculaire :
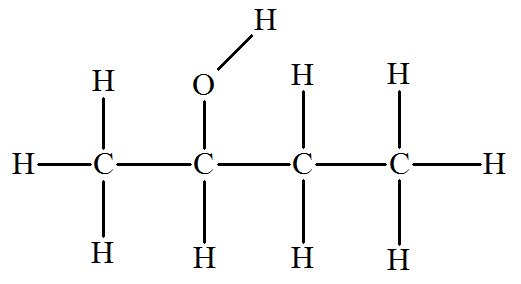
- Formule développée :
- Formule semi-développée :
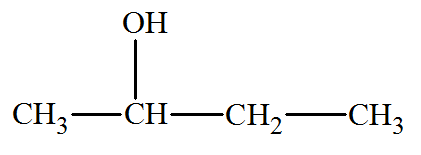
- Formule topologique :
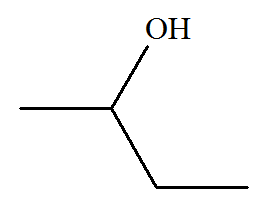
2)-
Formules spatiales des molécules.
- Convention :
- Un trait plein ––
représente une liaison entre deux atomes situés dans le plan de
la figure
- Un triangle allongé plein
![]() représente une liaison
entre un atome situé dans le plan de la figure et un atome situé
en avant de ce plan.
représente une liaison
entre un atome situé dans le plan de la figure et un atome situé
en avant de ce plan.
- Un trait hachuré
![]() ou un triangle hachuré
ou un triangle hachuré
![]() représente une liaison
entre un atome situé dans le plan de la figure et un atome situé
en arrière de ce plan.
représente une liaison
entre un atome situé dans le plan de la figure et un atome situé
en arrière de ce plan.
- Cas du carbone dans la molécule de méthane :
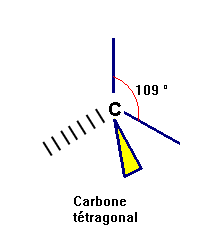 ou
ou
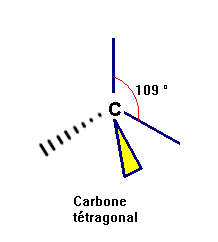
- Exercice :
La molécule de butan-2-ol :
- Représenter cette molécule en utilisant la représentation
de Cram et en considérant les groupes suivants : –
OH,
–H, –CH3 et
– C2H5.
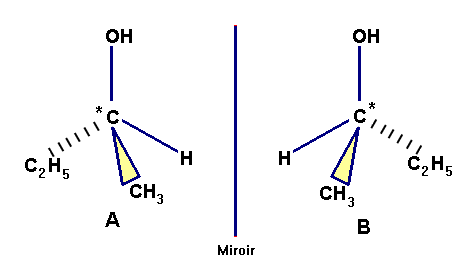
- La représentation de
Cram permet de rendre compte de la
géométrie tétraédrique autour de l’atome de carbone.
III- Les différentes
relations de stéréoisomérie.
|
Stéréoisomères : - Deux corps sont stéréoisomères lorsqu'ils ont :
- Même constitution (même formule plane).
-
Mais des structures spatiales différentes
- Ils différent par l'agencement spatial de leurs atomes.
- On distingue :
- Les stéréoisomères de conformation.
- Les stéréoisomères de configuration.
|
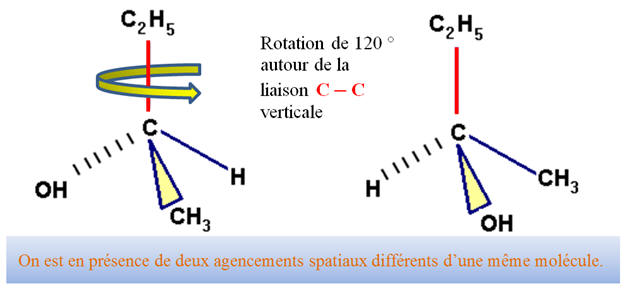
b)-
Stéréoisomères de conformation :
- On passe d’un stéréoisomère de conformation à un autre
par libre rotation autour d’une liaison simple.
- Exemple : libre rotation de 120 ° autour de la simple
liaison verticale
- On passe d’un stéréoisomère de conformation à un autre
par rotation autour de la simple liaison verticale
C – C.
- On est en présence de deux agencements spatiaux
différents d’une même molécule.
c)-
Stéréoisomères de configuration.
- Pour passer d’un stéréoisomère de configuration à un
autre, il faut briser des liaisons chimiques.
- Exemple :
- Stéréoisomères obtenus après avoir cassé puis reformé
deux liaisons chimiques.
- Deux stéréoisomères de configuration sont deux
molécules différentes.
- Deux stéréoisomères de conformation sont deux
agencements spatiaux d’une même molécule.
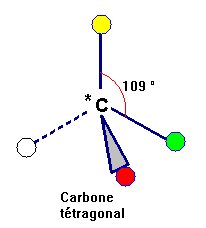
2)-
Stéréoisomérie de configuration : Cas des composés à un atome de
carbone asymétrique.
- C'est un atome de carbone tétragonal lié à quatre atomes
ou groupes différents.
- On le repère par un astérisque.
![]() Exercice
:
Exercice
:
- la molécule de butan-2-ol possède-t-elle un
carbone asymétrique ? Si oui représenter les deux énantiomères.
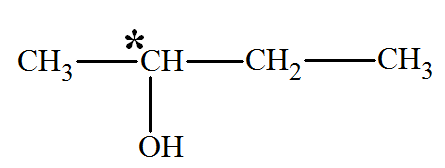

- La molécule
A n’est pas superposable à son image
(la molécule B) dans un miroir.
- Une molécule possédant un seul atome de carbone
asymétrique est toujours chirale.
b)-
Énantiomérie et propriétés :
- Toute molécule possédant un atome de carbone asymétrique
peut exister sous deux configurations différentes, images l’une
de l’autre dans un miroir.
- Les stéréoisomères correspondant sont appelés
énantiomères.
- Énantiomères :
stéréoisomères de configuration qui sont image l'un de l'autre
dans un miroir.
- Énantiomérie :
relation existant entre deux stéréoisomères de configuration
images l’un de l’autre dans un miroir.
- Mélange racémique :
- On appelle mélange racémique un mélange de quantités
égales de deux énantiomères.
- Les énantiomères présentent très souvent des propriétés
physiques et chimiques identiques.
- Par contre les propriétés biologiques et pharmacologiques
de deux énantiomères sont presque toujours différentes.
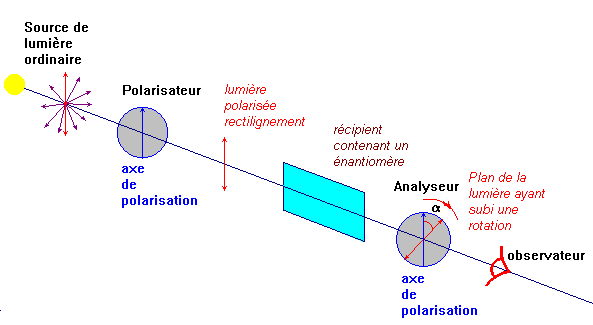
-
Deux énantiomères n'ont pas le même effet sur la lumière
polarisé rectilignement.
- La solution d'une substance chirale peut faire tourner le plan de polarisation de la lumière, on dit que cette substance est optiquement active.
- Elle possède un pouvoir rotatoire.
- Une substance qui fait tourner le plan de polarisation de
la lumière dans le sens des aiguilles d'une montre est dite
dextrogyre notée (+).
- Une substance qui fait tourner le plan de polarisation de
la lumière dans le sens trigonométrique est dite lévogyre notée
(–).
- L'angle de rotation du plan de polarisation est appelé
pouvoir rotatoire.
- Deux énantiomères ont des pouvoirs rotatoires opposés.
- Un mélange racémique ne possède pas de pouvoir rotatoire.
3)-
Stéréoisomérie de configuration : Cas des composés à deux atomes
de carbone asymétrique.
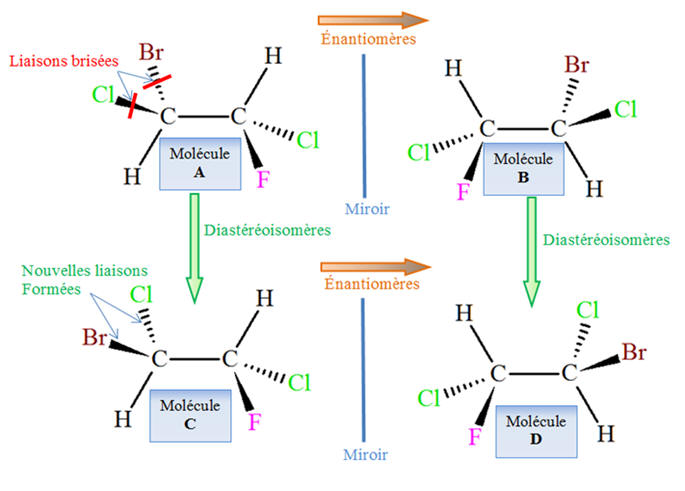
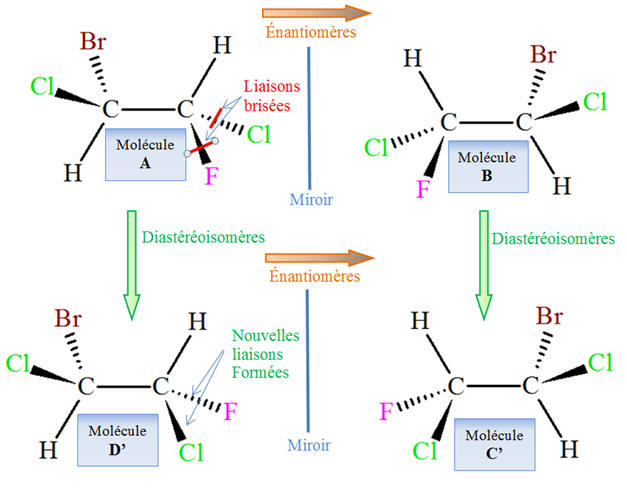
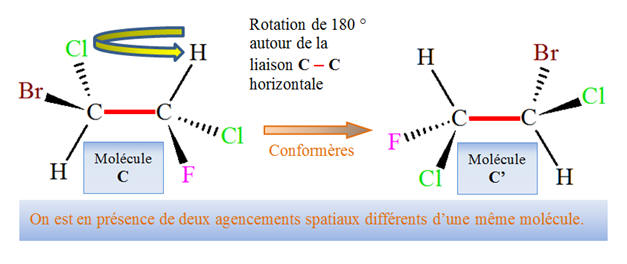
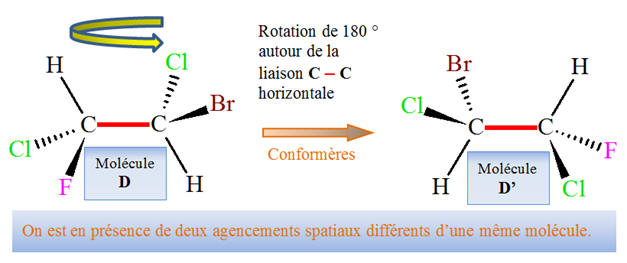
![]() La molécule de 1-bromo-1,2-dichloro-2-fluoroéthane
possède 2 atomes de carbone asymétrique.
La molécule de 1-bromo-1,2-dichloro-2-fluoroéthane
possède 2 atomes de carbone asymétrique.
![]() Chacun de ces
atomes de carbone asymétrique peut se trouver, indépendamment
de l’autre dans l’une des deux configurations possibles.
Chacun de ces
atomes de carbone asymétrique peut se trouver, indépendamment
de l’autre dans l’une des deux configurations possibles.
![]() Représenter
les deux configurations possibles et leurs énantiomères.
Représenter
les deux configurations possibles et leurs énantiomères.
- Formule développée de la molécule :
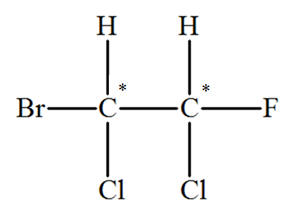
- Configurations possibles et énantiomères :
- Premier cas :
- Deuxième cas :
- Remarque 1 :
- Remarque 2 :
- Les molécules
A et B sont images l’une de
l’autre dans un miroir : ce sont des énantiomères.
- Les molécules
D et C sont images l’une de
l’autre dans un miroir : ce sont des énantiomères.
- Les molécules
A et C sont des isomères de
configuration non images l’un de l’autre dans un miroir : ce
sont des diastéréoisomères.
- Les molécules
B et D sont des isomères de
configuration non images l’un de l’autre dans un miroir : ce
sont des diastéréoisomères.
- Les molécules
C et C’ sont des
stéréoisomères de conformation : ce sont des conformères (deux
agencements spatiaux d’une même molécule).
- Les molécules
D et D’ sont des
stéréoisomères de conformation : ce sont des conformères (deux
agencements spatiaux d’une même molécule).
- Les diastéréoisomères sont des stéréoisomères
de configuration qui ne sont pas énantiomères.
- Les stéréoisomères présentent des propriétés
physiques et chimiques différentes.
4)-
Stéréoisomérie de configuration : diastéréoisomères Z / E.
►
Isomérie
Z et
E :
|
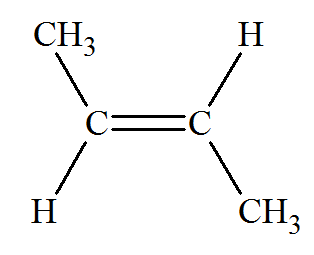
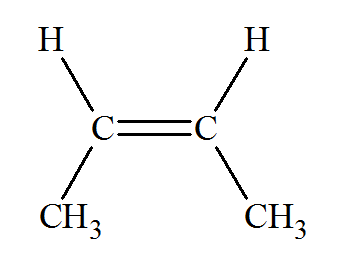
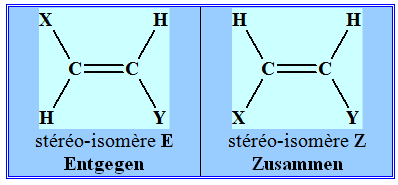
Isomérie Z et E : - Si, dans un alcène de formule générale CHX = CHY, les deuxatomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C = C, le stéréo-isomère est Z, dans le cas contraire, il est E. |
- Construire la molécule de but-2-ène.
- Donner la formule semi-développée et la formule
topologique des isomères Z et E.
- Comment passe-t-on d'un isomère à l'autre ?
- Réponses :
|
|
|
|
(E) but-2-ène Entgegen (en face, opposé), les hydrogènes sont situés de part et d'autre
de la double liaison |
(Z) but-2-ène Zusammen (ensemble), les hydrogènes sont situés du même côté de la double
liaison. |
- Le (Z) but-2-ène et le (E) but-2-ène sont
des stéréoisomères de configuration.
- Ce sont des corps purs distincts.
- Il n'y a pas libre rotation autour de la double liaison à
température ambiante.
- Pour passer d'un stéréoisomère à l'autre, il faut briser
et reformer une liaison chimique.
- Deux isomères
Z et E sont des
diastéréoisomères.
-
Les isomères Z et
E sont des corps purs
distincts que l'on peut isoler.
- Ils ont des propriétés physiques, chimiques, biologiques
différentes.
- La température d'ébullition normale du (Z)-but-2-ène
est de
5)-
Stéréoisomérie de conformation.
a)-
Conformations de l'éthane.
-
On appelle conformation d'une molécule les différentes
structures spatiales qu'elle peut prendre par suite de la
rotation autour de ses liaisons simples.
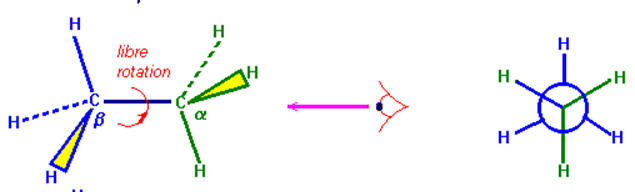
► Projection de
NEWMAN :
![]() Construire la molécule d'éthane. Noter α et
β chaque atome de carbone.
Construire la molécule d'éthane. Noter α et
β chaque atome de carbone.
![]() Regarder la molécule suivant
l'axe de la liaison carbone-carbone.
Regarder la molécule suivant
l'axe de la liaison carbone-carbone.
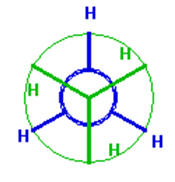
![]() Représenter les deux conformations remarquables (conformation
décalée et conformation éclipsée).
Représenter les deux conformations remarquables (conformation
décalée et conformation éclipsée).
- Réponses :
- Formule semi-développée de la molécule d'éthane :
- Le conformère
E et le conformère D sont des
stéréoisomères de conformation.
- À température ambiante, il y a libre rotation autour de
la simple liaison.
- Le passage de l'un à l'autre se fait sans rupture de
liaison.
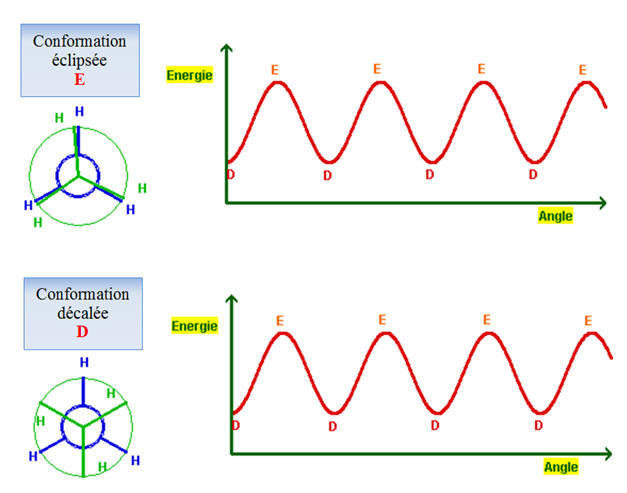
► Aspect énergétique.
-
Laquelle des deux conformations est la plus stable ?
- Les conformations décalées sont plus stables que les
conformations éclipsées car les liaisons C ‑‑ H
sont les plus éloignées possibles dans les conformations
décalées.
- La conformation la plus stable d’une molécule est celle
pour laquelle les interactions répulsives entre les doublets de
liaisons et les interactions stériques dues à l’encombrement des
gros substituants sont les plus faibles.
|
Les molécules A et B ont la même formule brute, mais ne sont pas superposables |
||||
|
|
||||
|
A et B sont isomères
de constitution |
NON
|
A et B ont-elles la même formule
développée plane ? |
OUI
|
A et B sont
stéréoisomères |
|
|
|
|||
|
A et B présentent-elles
la même fonction chimique ? |
A et B peuvent-ils être interconvertis par des rotations autour
de liaisons simples ? |
||||||
|
|
|
|
|
||||
|
A et B sont isomères
de fonction |
A et B sont isomères de position
ou de chaîne
|
A et B sont isomères
de configuration |
A et B sont isomères
de conformation |
||||
|
|
|
||||||
|
A et B présentent-ils
le même squelette carboné ? |
A et B sont-ils image
l'un de l'autre dans un miroir ? |
||||||
|
|
|
|
|
||||
|
A et
B sont isomères
de chaîne |
A et B sont isomères
de position |
A et B sont
diastéréoisomères.
Exemple :
l'isomérie Z et E |
A et B sont
énantiomères
Exemple : présence d'un carbone asymétrique,
molécule chirale. |
||||
2)-
Exercices :
a)- Exercice 7 page 270 : Reconnaître une molécule chirale.
b)- Exercice 8 page 270 : Utiliser la représentation
topologique.
c)- Exercice 10 page 270 : établir une représentation de
Cram.
d)- Exercice 15 page 271 : Représenter un couple
d’énantiomères.
e)- Exercice 17 page 272 : de la formule semi-développée à la
formule topologique.
f)- Exercice 20 page 272 : La vitamine
C.
g)- Exercice 22 page 273 : Autour des acides
α–aminés.
h)- Exercice 28 page 275 : Phéromone sexuelle de coléoptère.
|
|