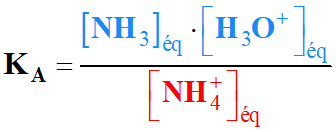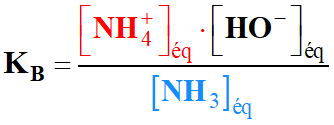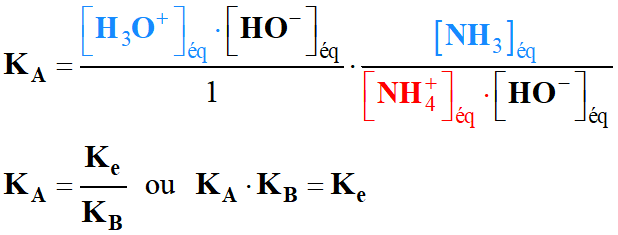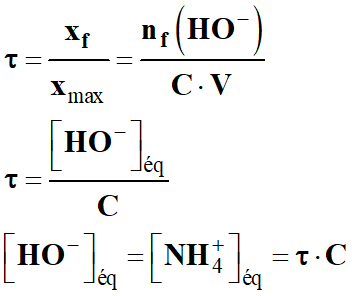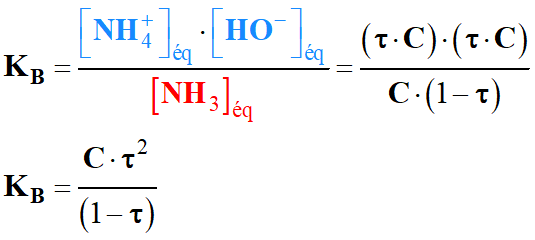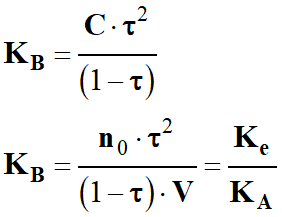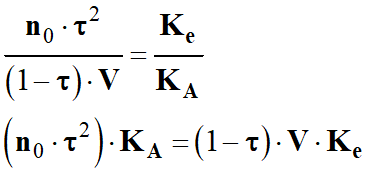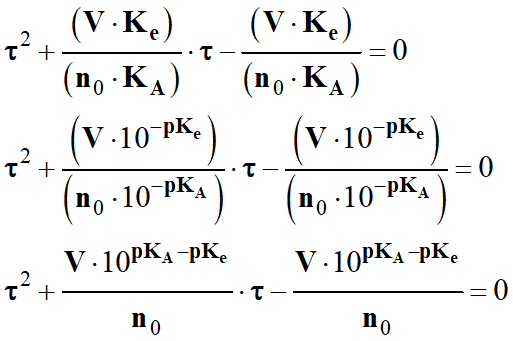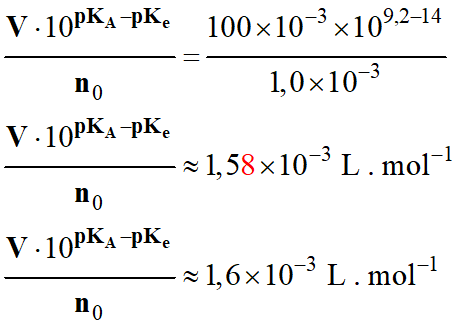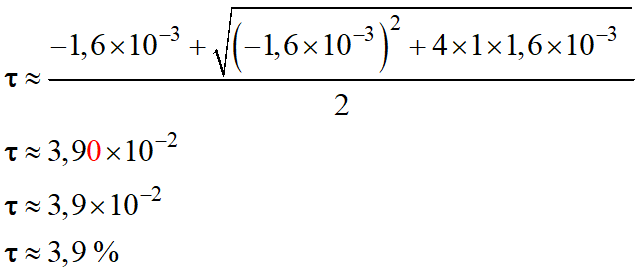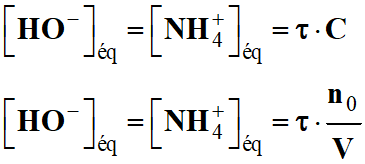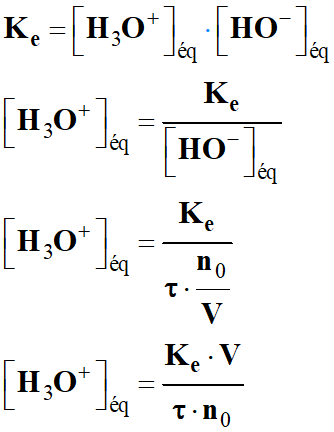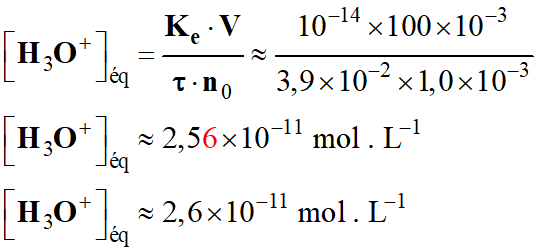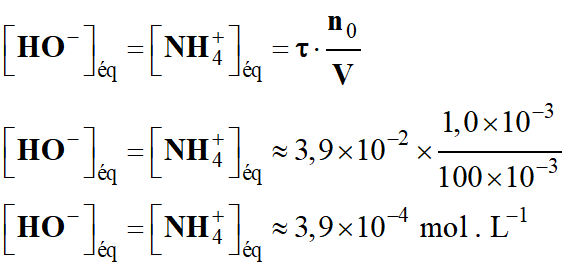II-
Exercice 2 : Contrôle de qualité d’un
vinaigre.
1)-
Énoncé.
Le vinaigre est une solution aqueuse d'acide éthanoïque de
formules CH3COOH.
Le degré d'acidité d’un vinaigre est vérifié en
réalisant son titrage par une solution de soude.
l'équivalence peut être repérée par virage d'un
indicateur coloré, les solutions titrante et titrée étant toutes les 2
incolores.
►
Quel indicateur coloré de pH choisir pour
réaliser le titrage du vinaigre ?
DOC. 1
Le vinaigre blanc

-
Le vinaigre blanc de degré
d'acidité 8° est une solution aqueuse d'acide éthanoïque contenant 8,00 g
d'acide éthanoïque pour 100 mL de solution.
-
M
(CH3COOH) = 60,0 g . L–1
DOC. 2
Simulation d’un titrage.
Les courbes de titrage pH-métrique et conductimétrique d'un
échantillon de volume VA = 25,0 mL une solution diluée d'un
facteur cent de vinaigre blanc à 8°,
par une solution de soude à la concentration en quantité d'ions hydroxyde
CB = 20 ,0 mmol . L–1 sont fournies ci-dessous.
Courbe 01

Courbe 02 : Réalisé avec Dozzaqueux


Espèces présentes : certaines notations sont fausses (à décocher)
Réactions et constantes


Courbe 03 : Réalisée avec le tableur Excel

Tableau de valeurs :
retour
|
VB
(mL)
|
pH
|
[H3O+]
(mol . L–1)
|
[CH3COO–]
(mol . L–1)
|
[Na+]
(mol . L–1)
|
[HO–]
(mol . L–1)
|
σ
(mS . m–1)
|
|
0,0
|
4,03
|
9,33E-05
|
9,33E-05
|
0,00E+00
|
1,07E-10
|
0,29
|
|
1,0
|
4,13
|
7,41E-05
|
1,12E-04
|
3,80E-05
|
1,35E-10
|
0,26
|
|
2,0
|
4,23
|
5,89E-05
|
1,35E-04
|
7,59E-05
|
1,70E-10
|
0,24
|
|
3,0
|
4,33
|
4,68E-05
|
1,60E-04
|
1,14E-04
|
2,14E-10
|
0,23
|
|
4,0
|
4,43
|
3,72E-05
|
1,88E-04
|
1,51E-04
|
2,69E-10
|
0,23
|
|
5,0
|
4,53
|
2,95E-05
|
2,18E-04
|
1,89E-04
|
3,39E-10
|
0,23
|
|
6,0
|
4,62
|
2,40E-05
|
2,50E-04
|
2,26E-04
|
4,17E-10
|
0,24
|
|
7,0
|
4,72
|
1,91E-05
|
2,82E-04
|
2,63E-04
|
5,25E-10
|
0,25
|
|
8,0
|
4,81
|
1,55E-05
|
3,16E-04
|
3,00E-04
|
6,46E-10
|
0,27
|
|
9,0
|
4,91
|
1,23E-05
|
3,49E-04
|
3,37E-04
|
8,13E-10
|
0,28
|
|
10,0
|
5,01
|
9,77E-06
|
3,84E-04
|
3,74E-04
|
1,02E-09
|
0,30
|
|
11,0
|
5,11
|
7,76E-06
|
4,18E-04
|
4,10E-04
|
1,29E-09
|
0,32
|
|
12,0
|
5,23
|
5,89E-06
|
4,53E-04
|
4,47E-04
|
1,70E-09
|
0,34
|
|
13,0
|
5,37
|
4,27E-06
|
4,88E-04
|
4,83E-04
|
2,34E-09
|
0,37
|
|
14,0
|
5,54
|
2,88E-06
|
5,22E-04
|
5,19E-04
|
3,47E-09
|
0,39
|
|
15,0
|
5,77
|
1,70E-06
|
5,57E-04
|
5,56E-04
|
5,89E-09
|
0,41
|
|
16,0
|
6,21
|
6,17E-07
|
5,92E-04
|
5,91E-04
|
1,62E-08
|
0,43
|
|
16,4
|
6,76
|
1,74E-07
|
6,06E-04
|
6,06E-04
|
5,75E-08
|
0,44
|
|
16,6
|
7,80
|
1,58E-08
|
6,13E-04
|
6,13E-04
|
6,31E-07
|
0,45
|
|
16,8
|
8,87
|
1,35E-09
|
6,20E-04
|
6,20E-04
|
7,38E-06
|
0,46
|
|
16,9
|
9,04
|
9,03E-10
|
6,24E-04
|
6,24E-04
|
1,11E-05
|
0,47
|
|
17,0
|
9,17
|
6,77E-10
|
6,27E-04
|
6,27E-04
|
1,48E-05
|
0,48
|
|
18,0
|
9,71
|
1,94E-10
|
6,63E-04
|
6,63E-04
|
5,16E-05
|
0,57
|
|
19,0
|
9,95
|
1,13E-10
|
6,99E-04
|
6,99E-04
|
8,82E-05
|
0,65
|
|
20,0
|
10,10
|
8,01E-11
|
7,34E-04
|
7,34E-04
|
1,25E-04
|
0,73
|
|
21,0
|
10,21
|
6,20E-11
|
7,69E-04
|
7,69E-04
|
1,61E-04
|
0,82
|
|
22,0
|
10,30
|
5,06E-11
|
8,04E-04
|
8,04E-04
|
1,97E-04
|
0,90
|
|
23,0
|
10,37
|
4,28E-11
|
8,39E-04
|
8,39E-04
|
2,34E-04
|
0,98
|
|
24,0
|
10,43
|
3,71E-11
|
8,74E-04
|
8,74E-04
|
2,70E-04
|
1,07
|
|
25,0
|
10,48
|
3,27E-11
|
9,09E-04
|
9,09E-04
|
3,05E-04
|
1,15
|
DOC. 3
Quelques indicateurs colorés couramment utilisés.
|
Indicateur coloré
|
Couleur d’une
solution
de l’espèce acide
|
Couleur d’une
solution
de l’espèce
basique
|
pKA
|
|
Hélianthine
|
Rouge
|
Jaune
|
3,4
|
|
Vert de
bromocrésol
|
Jaune
|
Bleu
|
4,8
|
|
Rouge de phénol
|
Jaune
|
Rouge
|
8,0
|
|
Jaune d’alizarine
|
Jaune
|
Rouge
|
11,0
|
-
Hélianthine :
|
Hélianthine
|
|
Forme acide
Rouge
|
Zone de virage
pH
de 3,1 et 4,4
Orange
|
Forme basique
bleue
|
-
Formule topologique de
l’hélianthine :
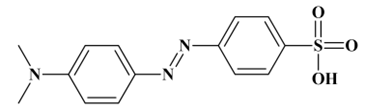
-
Formule brute :
C14H15N3O3S
-
Masse molaire : M =
305,3522 g . mol–1
-
Vert de bromocrésol :
|
Vert de
bromocrésol
|
|
Forme acide
Jaune
|
Zone de virage
pH
de 3,8 et 5,4
Vert
|
Forme basique
bleue
|
Vert de bromocrésol
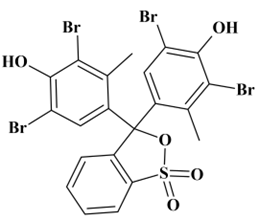
-
Formule brute :
C21H14Br4O5S
-
Masse molaire : M =
698,01386 g . mol–1
-
Rouge de phénol :
|
Rouge de phénol
|
|
Forme acide
Jaune
|
Zone de virage
pH
de 6,6 et 8,4
Orange
|
Forme basique
bleue
|
-
Formule brute :
C19H14O5S
-
Masse molaire : M =
354,37646 g . mol–1
-
Jaune d’alizarine :
|
Jaune d’alizarine
|
|
Forme acide
Jaune
|
Zone de virage
pH
de 10,1 et 12,0
Orange
|
Forme basique
bleue
|
-
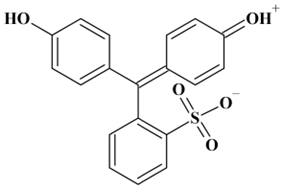
Forme basique du jaune d’alizarine
-
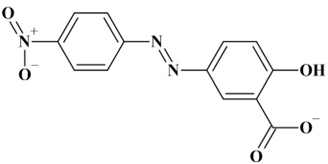
Formule brute :
C13H8N3O5–
-
Masse molaire : M = 286,22
g . mol–1
-
Ion 2-hydroxy-5-[(E)-(4-nitrophenyl)diazényl]benzoate
-
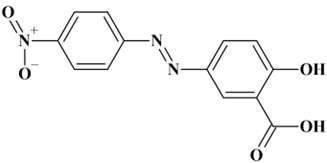
Forme acide du jaune d’alizarine :
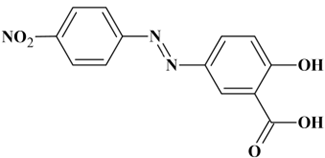
Autre formulation :
-
Formule brute :
C13H9N3O5
-
Masse molaire : M = 287,23
g . mol–1
-
Acide 2-hydroxy-5-[(E)-(4-nitrophenyl)diazényl]benzoïque
-
Le jaune d’alizarine ou acide
p-nitrobenzène-azosalicylique) est un composé chimique utilisé à la fois comme
indicateur de pH, comme colorant organique dans l’industrie, ou comme
colorant cytoplasmique.
1.
Proposer un protocole expérimental permettant de répondre à la
question posée en introduction.
2.
Mettre en œuvre le protocole proposé.
3.
Déterminer le degré d'acidité du vinaigre fourni.
4.
Préparer un exposé permettant de justifier le choix d'un indicateur
coloré pour repérer le volume à l'équivalence d'un titrage.

2)-
Correction.
1. Protocole pour le choix de l’indicateur de
titrage. Approche théorique.
a)-
Les indicateurs colorés :
- Les indicateurs colorés sont constitués
par des couples acide faible / base faible dont les espèces conjuguées ont des
teintes différentes.
- Écriture symbolique :
|
Hind
(aq)
|
+
|
H2O
(ℓ)
|

|
Ind–
(aq)
|
+
|
H3O+
(aq)
|
|
Teinte (1)
|
|
|
|
Teinte (2)
|
|
|
-
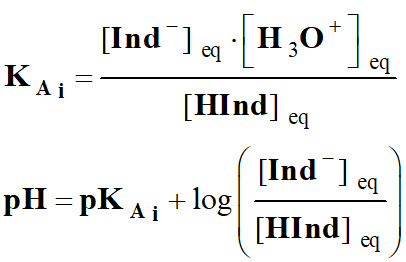
- On admet, de façon générale, que
l'indicateur coloré prend sa teinte acide
si :
-
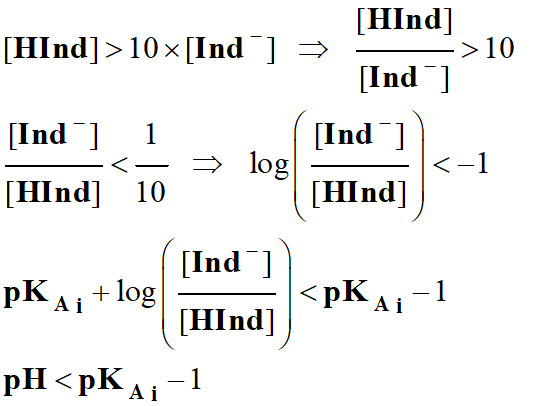
- On admet, de façon générale, que
l'indicateur prend sa teinte basique
si :
-
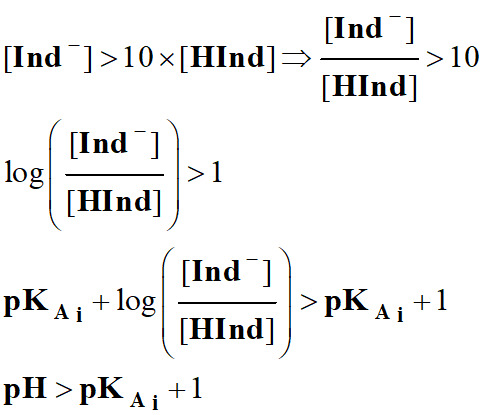
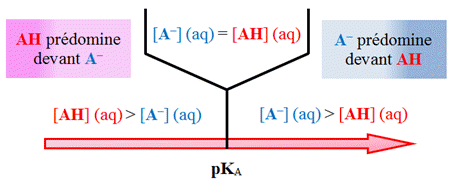
- Dans la zone de
pH, comprise
entre :
- pKAi
–1 ≥ pH
≥ pKAi
+1, l’indicateur coloré prend sa teinte
sensible.
- Les couleurs des teintes acide et
basique se superposent.
- Cette zone est appelée zone de virage
de l’indicateur coloré.
|
pKAi
– 1 pKAi
pKAi
+ 1 |
|
Couleur de InH
|
Zone de Virage
|
Couleur de In–
|
|
Teinte acide
|
Teinte sensible
|
Teinte basique
|
|
|
|
|
|
|
|
|
- Il se peut que la zone de virage soit
supérieure à 2 unités pH
si l’œil a du mal à distinguer les deux couleurs.
b)-
Indicateur coloré adapté au titrage :
- Un indicateur coloré acido-basique est
adapté à un titrage si la zone de virage de l’indicateur coloré contient le
pH à
l’équivalence pHE
du titrage.
- L’utilisation d’un indicateur coloré
permet de repérer visuellement l’équivalence d’un titrage acido-basique grâce au
changement de teinte du mélange réactionnel.
- Réaction de dosage :
- Espèce titrée est l’acide éthanoïque :
CH3COOH
- Espèce titrante est la solution aqueuse
hydroxyde de sodium (soude) : Na+
(aq) + HO–
(aq)
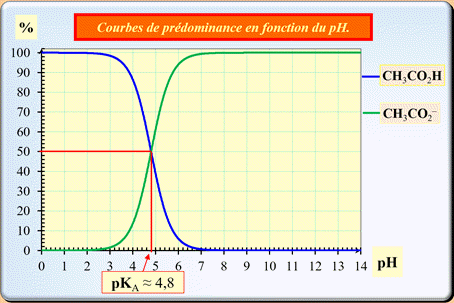
- L’acide éthanoïque est un acide faible
caractérisé par son pKA
= 4,8.
-
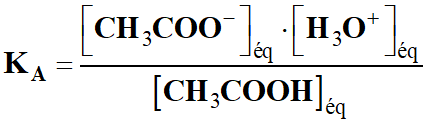
- 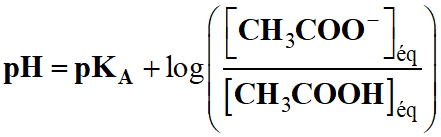
- Réaction chimique de l’acide éthanoïque
sur l’eau :
|
CH3COOH
(aq) + H2O
(ℓ)
|

|
H3O+
(aq) + CH3COO– (aq)
|
- Les espèces présentes lors du dosage :
- CH3COOH
(aq), CH3COO–
(aq)
- Na+
(aq) (ion spectateur du point de vue acido-basique et non conductimétrique)
- H3O+
(aq) , HO–
(aq) et H2O
(ℓ)
- La réaction de titrage :
- Équation de la réaction :
CH3COOH
(aq) +
HO–
(aq)
 CH3COO–
(aq) +
H2O
(ℓ)
CH3COO–
(aq) +
H2O
(ℓ)
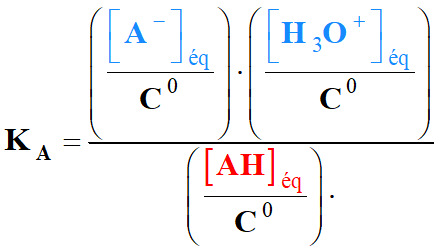
- Expression de la constante
K et la réaction :
- 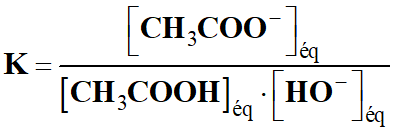
- Multiplions le numérateur et le
dénominateur par [H3O+]éq.
- 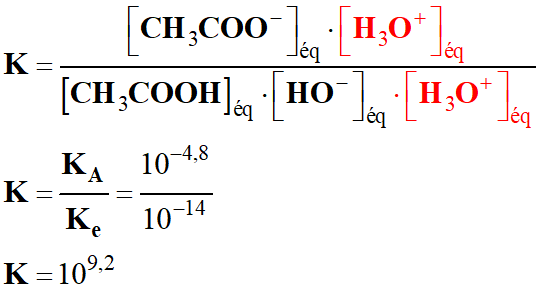
- K
> 104, la réaction est
totale.
CH3COOH
(aq) +
HO–
(aq) → CH3COO–
(aq) +
H2O
(ℓ)
c)-
Caractéristiques d’une réaction de dosage :
- Un dosage par titrage direct met en jeu
une réaction chimique.
- La réaction de support de dosage est
une réaction : totale, rapide, unique.
- C’est une réaction quantitative.
- Ceci est bien le cas de la réaction
chimique entre l’acide éthanoïque et la soude.
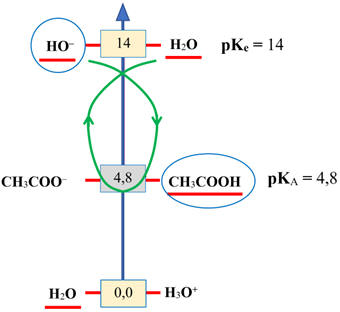
► L’équivalence d’un titrage :
ts03ch20.htm
- À l’équivalence, les réactifs sont dans
les proportions stœchiométriques définies par les coefficients de la réaction.
- À l’équivalence, il n’y a pas de
réactif limitant.
► Au cours du dosage :
- On étudie le système
avant
l’équivalence, à
l’équivalence et après
l’équivalence.
|
Avant l’équivalence
|
|
Le
réactif titrant
est totalement consommé,
c’est le
réactif limitant
Il reste encore
du réactif titré :
il est en excès.
|
|
À l’équivalence :
|
|
Le
réactif titrant
et le
réactif titré
sont totalement consommés.
Ils sont
tous les deux limitants
(mélange stœchiométrique).
|
|
Après l’équivalence
|
|
Le
réactif titré
est totalement consommé :
c’est le
réactif limitant.
Maintenant,
c’est le réactif titrant
qui est en
excès.
|
|
En conclusion
|
|
À l’équivalence
du titrage,
il y a
changement de réactif limitant
|
► Tableau d’avancement :
- On note
xE
l’avancement de la réaction à l’équivalence.
- À l’équivalence, le
réactif titrant et le
réactif titré
sont totalement consommés.
|
Équation
|
Équation de la
réaction de titrage
|
|
CH3COOH
(aq)
|
+
HO–
(aq)
|
→
|
CH3COO–
(aq)
|
+ H2O (ℓ)
|
|
État du
système
|
Avanc.
|
n
(CH3COOH)
|
n
(HO–)
|
|
n (CH3COO–
)
|
Solvant
|
|
État initial
(mol)
|
x =
0
|
n0
= CA . VA
|
n
(HO–)
= CB . VB
|
0
|
‘’
|
|
Au cours
de la
transformation
|
x
|
CA
. VA
– x
|
CB
. VB – x
|
x
|
‘’
|
|
État pour
VB
< VE
|
CB
. VB < xE
|
CA
. VA
– CB
. VB > 0
|
0
Réactif
limitant
|
x
|
‘’
|
|
Équivalence
VB
= VBE
|
xE
|
0
|
0
|
xE
|
‘’
|
|
Mélange stœchiométrique
CA
. VA
= CB
. VBE
|
|
‘’
|
|
État pour
VB
> VE
|
CB
. VB > xE
|
0
|
CB
. VB– CA . VA
> 0
|
|
‘’
|
|
Réactif
limitant
|
Réactif
en excès
|
- À l’équivalence, on est en présence
d’une solution aqueuse d’éthanoate de sodium (il ne faut pas oublier la présence
des ions sodium).
- Il faut déterminer la valeur du
pH de cette
solution :
- On peut réaliser le calcul théorique.
- On peut le faire à partir des
concentrations initiales des différentes espèces :
- Le vinaigre blanc de degré d'acidité 8°
est une solution aqueuse d'acide éthanoïque contenant 8,00 g d'acide éthanoïque
pour 100 mL de solution.
- Cette solution est diluée 100 fois.
- M (CH3COOH)
= 60,0 g . L–1
- CA
= C /
100
- Avec
- 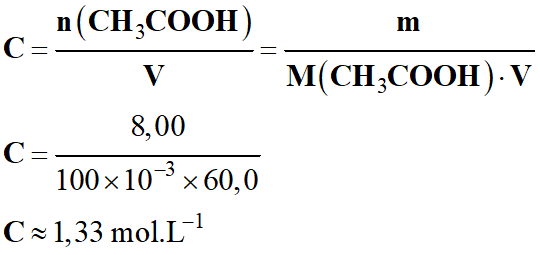
- CA
≈ 1,33 × 10–2 mol . L–1
- VA
= 25 mL
- Le réactif titré : La soude
- CB
= 20 mmol . L–1
- À l’équivalence :
- CA
. VA =
CB
. VBE
- Volume versé à l’équivalence :
- 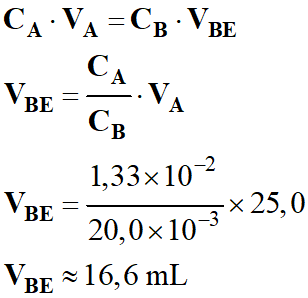
- Concentration de la solution
d’éthanoate de sodium :
- À l’équivalence :
- n (CH3COO–
)éq
= xE
= CA
. VA
= CB
. VBE
-
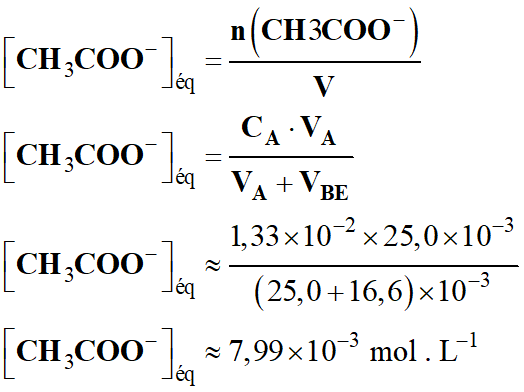
- Maintenant, il faut répondre à la
question :
- Quel est le
pH
d’une solution aqueuse d’éthanoate de sodium de concentration
C ≈ 7,99 × 10–3
mol . L–1
- L’ion éthanoate en solution aqueuse :
CH3COO–
(aq) +
H2O
(ℓ)  CH3COOH
(aq) +
HO–
(aq)
CH3COOH
(aq) +
HO–
(aq)
- Constante d’équilibre de la réaction :
-
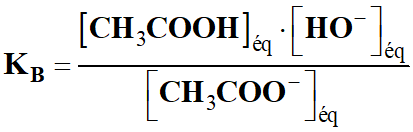
- Multiplions le numérateur et le
dénominateur par [H3O+]éq.
-
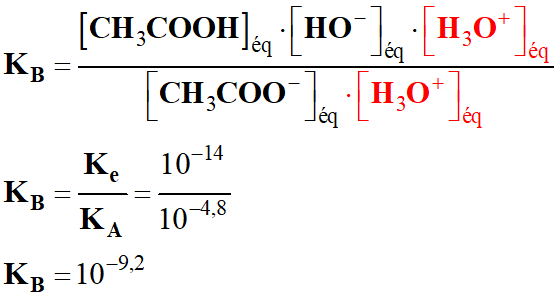
- KB
<< 1, la réaction est très limitée.
- L’ion éthanoate est une base faible.
- Pour déterminer la valeur du
pH de la solution,
on peut utiliser la relation suivante :
- 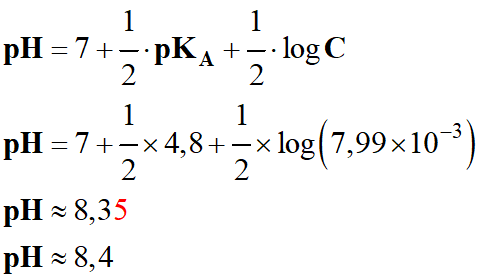
d)-
Choix de l’indicateur coloré
- Vert de bromocrésol :
|
Vert de bromocrésol
|
|
Forme acide
Jaune
|
Zone de virage
pH
de 3,8 et 5,4
Vert
|
Forme basique
bleue
|
- Il vire avant l’équivalence.
- Jaune d’alizarine :
|
Jaune d’alizarine
|
|
Forme acide
Jaune
|
Zone de virage
pH
de 10,1 et 12,0
Orange
|
Forme basique
bleue
|
- Il vire après l’équivalence.
- Rouge de phénol :
|
Rouge de phénol
|
|
Forme acide
Jaune
|
Zone de virage
pH
de 6,6 et 8,4
Orange
|
Forme basique
bleue
|
- Il vire à l’équivalence. Cet indicateur
coloré convient pour le dosage.
► Remarque :
- La phénolphtaléine :
|
Phénolphtaléine
|
|
Forme acide
incolore
|
Zone de virage
pH
de 8,2 et 10
rose pâle
|
Forme basique
rose
|
Pigments et
Colorants
- La phénolphtaléine convient aussi pour
le dosage du vinaigre par la soude.
e)-
Protocole expérimental :
- Schéma du montage :
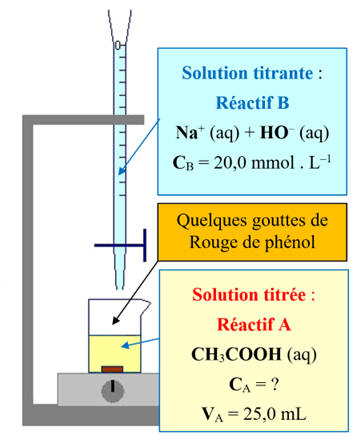
► Titrage rapide.
- Rincer
la burette avec la solution de soude concentration
CB
= 20 mmol / L.
- Remplir la burette
avec la solution de soude et ajuster le niveau au zéro de la graduation.
- À
l’aide d’une pipette munie de sa propipette, prélever un volume
VA
= 25,0 mL de la solution diluée de vinaigre.
- Faire s’écouler le
liquide le long de la paroi du bécher.
- Ajouter un barreau
aimanté.
- On peut ajouter un peu
d’eau distillée.
- Ajouter quelques
gouttes de rouge de phénol
- Placer le bécher
au-dessous de la burette de Mohr et sur un agitateur magnétique.
- Maintenir une
agitation douce.
- Verser mL par mL la
solution de soude jusqu’à l’obtention du changement de couleur (coloration
orange, puis rouge).
- Noter le volume,
V1
de solution de soude versée.
► Dosage précis :
- Recommencer le
titrage, mais en versant d’un seul coup un volume (V1
– 2 mL) de réactif titrant.
- Continuer ensuite
goutte à goutte jusqu’au changement de couleur.
- Noter
VBE
le volume versé.
1. Détermination du degré
d'acidité du vinaigre fourni.
a)-
Le suivi pH-étrique :
► Le montage :
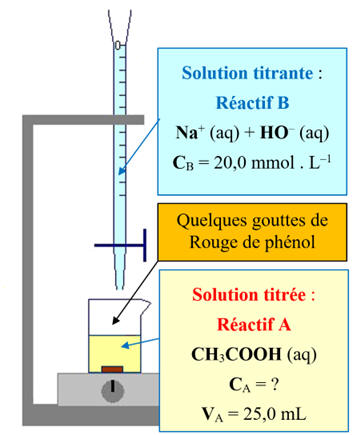
- À un volume
VA
= 25,0 mL de solution diluée de vinaigre de concentration
CA,
- On ajoute
progressivement de la soude (solution aqueuse d’hydroxyde de sodium) de
concentration CB
= 20,0 mmol . L–1.
- On mesure le
pH de la solution
initiale et le pH
de la solution obtenue après chaque ajout de soude.
- Au voisinage de
l’équivalence (lorsque la valeur du pH
varie fortement), on ajoute la soude goutte à goutte.
- On attend que la
valeur du pH
se stabilise et on note sa valeur.
► Exploitation de la
courbe obtenue pH
= f (VB) :

Mesures effectuées avec Word
- Autre courbe
pH =
f (VB) :

- Le
pH augmente lors de
l’addition d’un volume VB
de soude.
|
Partie AB de
la courbe :
|
|
Au départ, le
pH est faible (la solution est acide)
Il augmente
d’abord lentement car l’acide éthanoïque CH3COOH
est en excès par rapport à l’ion HO–.
L’ion HO–
est le réactif limitant.
|
|
Partie BC de
la courbe :
|
|
Le pH
augmente d’autant plus que l’excès d’acide se réduit.
On observe un
saut de pH de plusieurs unités.
Ce saut de
pH provient du changement de réactif limitant.
On est aux
alentours de l’équivalence.
Dans la partie
BC, la courbe change de concavité,
Elle possède
un point d’inflexion E.
Ce point
particulier est appelé point équivalent, noté E.
En ce point,
on change de réactif limitant.
On passe d’un
excès d’ion H3O+ à un excès
d’ion HO–.
|
|
Partie CD de
la courbe :
|
|
Dans cette
zone, l’acide éthanoïque CH3COOH
est le réactif limitant et l’ion HO– est le
réactif en excès.
Cet excès
impose un pH dont la valeur est élevée
Le pH
augmente à nouveau lentement puis se stabilise.
|
- Exploitation de la
courbe obtenue avec Dozzzaqueux : Courbe 02

► Exploitation des
coordonnées du point équivalent E : Retour
- À l’équivalence, les
réactifs sont dans les proportions stœchiométriques : il n’y a pas de réactif
limitant.
- Tous les réactifs ont
été consommés.
- À l’équivalence :
-
CA
. VA
= CB
. VBE
- Concentration de la
solution diluée de vinaigre :
- 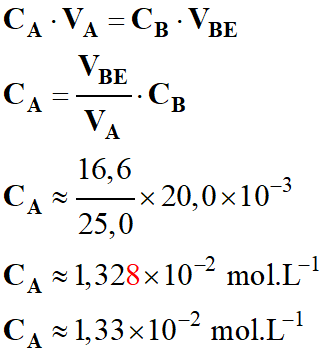
- Concentration en acide
éthanoïque du vinaigre :
- C
= 100 CA
- C
≈ 100 × 1,33 × 10–2 mol .
L–1
- C
≈ 1,33 mol . L–1
- Degré d’acidité du
vinaigre utilisé :
- Masse d’acide
éthanoïque dans 100 mL de solution de vinaigre :
- n
= C .
V
- m
= n .
M (CH3COOH)
- m
= C .
V .
M (CH3COOH)
- m
≈ 1,33 × 100 × 10–3 ×
60,0
- m
≈ 7,98
g
- m
≈ 8,0 g
- Le degré d’acidité du
vinaigre est voisin de 8 °.
- Ce résultat est en
accord avec l’indication donnée.
b)-
Le suivi conductimétrique :
► Le montage :
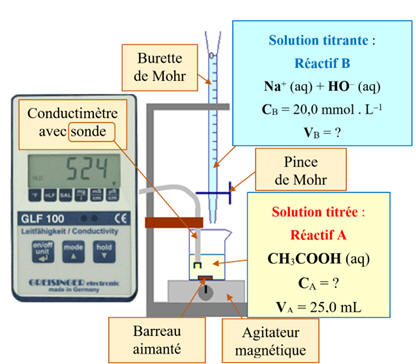
- On dose, par titrage
conductimétrique,
- une solution
SA
d’une solution diluée de vinaigre (acide éthanoïque CH3COOH (aq) ),
- par une solution
SB
de soude : hydroxyde de sodium, {Na+
(aq) + HO–
(aq)}.
- L’équation de la
réaction de titrage est :
CH3COOH
(aq) +
HO–
(aq) →
CH3COO–
(aq) +
H2O
(ℓ)
- Le suivi du titrage
par conductimétrie permet de tracer le graphe
σ = f
(VB)
ci-dessous.
- Dans le bécher, on
verse VA
= 25,0 mL d’une solution diluée d’acide éthanoïque et pour que l’effet de
dilution soit négligeable, lors de la manipulation, on ajoute environ
V = 500 mL
d’eau distillée.
- Conductivité molaire
ionique des différents ions.
|
Ions
|
λ
(mS . m2
. mol– 1)
|
|
Na+
|
5,01
|
|
H3O+
|
34,98
|
|
CH3COO–
|
4,09
|
|
HO–
|
19,86
|
► La courbe

|
Partie AE de la courbe :
|
|
La conductivité
σ de la solution diminue légèrement puis augmente.
- Les ions
présents dans le mélange réactionnel sont :
- Les ions oxonium H3O+,
les ions éthanoate CH3COO–,
et les ions sodium Na+.
- Les ions hydroxyde HO– ne sont pas présents car
ils sont totalement consommés. Ils sont ultra-minoritaires.
- Au cours de
la réaction, il se forme des ions éthanoate CH3COO–
et on ajoute des ions sodium Na+.
- La
concentration en ions oxonium H3O+
diminue
faiblement, la concentration en ion sodium Na+
augmente et la concentration en ions éthanoate CH3COO–
augmente aussi.
- Au départ
c’est la diminution qui l’emporte sur l’augmentation, puis c’est
l’inverse.
► Remarque : les ions oxonium
H3O+
proviennent principalement de la réaction de
l’acide éthanoïque avec l’eau.
- L’ion
HO– est le
réactif limitant.
|
|
Le point E de la courbe :
|
|
- C’est le
point de rupture de pente de la courbe.
- Ce point
particulier est appelé point équivalent, noté E.
- En ce
point, on change de réactif limitant.
- On passe
d’un excès de molécule d’acide éthanoïque à un excès d’ion HO–.
|
|
Partie EB de la courbe :
|
|
La
conductivité σ de la solution augmente fortement
- Après
l’équivalence :
- Les ions
présents dans le mélange réactionnel sont :
- Les ions hydroxyde HO–, les ions
éthanoate CH3COO–,
et les ions sodium Na+.
- Le
réactif limitant est l’acide éthanoïque, il est totalement consommé.
-
Les ions
oxonium H3O+
sont ultra-minoritaires.
- En
conséquence la concentration en ions éthanoate est pratiquement
constante (si le phénomène de dilution est négligeable).
- La
conductivité globale σ de la solution augmente après
l’équivalence car on ajoute des ions hydroxyde HO–
et des ions sodium Na+ dans le mélange
réactionnel.
|
► Exploitation des
coordonnées du point équivalent E :
- Idem
que pour le suivi pH-métrique.
► Titrage
conductimétrique et pH-métrique
de la solution diluée de vinaigre :
- Tableau des
conductivités molaires ioniques :
|
λ (H3O+)
|
3,50E-02
|
S.m2.mol-1
|
|
λ (CH3COO-)
|
4,10E-03
|
S.m2.mol-1
|
|
λ (Na+)
|
5,01E-03
|
S.m2.mol-1
|
|
λ (HO-)
|
1,99E-02
|
S.m2.mol-1
|
- Tableau des
différentes valeurs :
|
CB
|
2,00E-02
|
mol/L
|
|
VBE
|
16,6
|
mL
|
|
CA
|
1,33E-02
|
mol/L
|
|
VA
|
25
|
mL
|
|
Veau
|
500
|
mL
|
|
Veau + Vacide
|
525
|
mL
|
- Tableau de valeurs :
- Graphe
pH
= f
(VB)
et σ
= g
(VB) :
Exploité (Courbe 03)

-
Valeurs idem :
Exploitation des coordonnées du point équivalent
E
- On
remarque que le pH à l’équivalence
pHE
≈ 7,8, alors que précédemment il était de 8,4 sur les courbes
pH
= f (VB)
précédentes.
- Ceci
est lié au fait que dans ce dernier dosage on a rajouté un volume d’eau
distillée Veau
= 500 mL.
- L’ajout de ce volume
d’eau
- permet de négliger le
phénomène de dilution au cours du dosage,
- ne change pas le
volume de soude versé à l’équivalence
- mais
réduit le saut de pH.
- Concentration de la
solution d’éthanoate de sodium :
- À l’équivalence :
- n (CH3COO–
)éq
= xE
= CA
. VA
= CB
. VBE
- 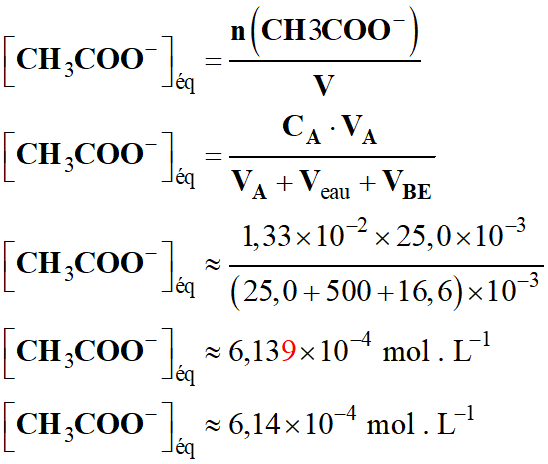
- Il
ne faut pas oublier que l’ion éthanoate est
une base faible dans l’eau.
- Il réagit avec l'eau et on est en présence d'un équilibre
chimique.
- Pour déterminer la
valeur du pH
de la solution, on peut utiliser la relation suivante :
- 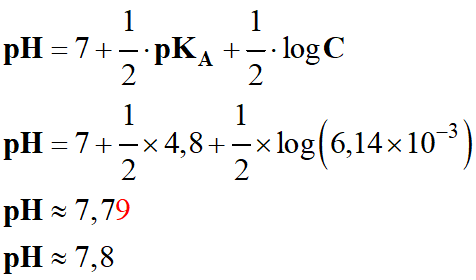
Devoir :
Le vinaigre
Une astuce culinaire
Le vinaigre (Bacblanc
2005)

III-
Exercice : étudier un acide α-aminé.
1)-
Énoncé.
La valine est un acide α-aminé essentiel dont l'une des
espèces acides-bases est représentée ci-dessous :
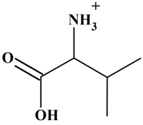 ou
ou
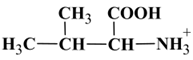
1-carboxy-2-methylpropan-1-aminium:
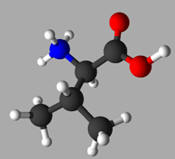
|
Valine
|
Acide
2-amino-
3-méthylbutanoïque
|
Val
V
|
C5H11NO2
|

|
Deux couples acide-base sont associés à la valine.
Le premier est caractérisé par une constante
d'acidité KA1
= 5,0 × 10–3
et le second par une constante d'acidité KA2 =
2,0 × 10–10.
a)-
Recopier la formule de la
valine et entourer les groupes caractéristiques qui possèdent des propriétés
acide-base.
b)-
Associer chaque constante
d'acidité au groupe caractéristique correspondant.
c)-
Représenter le diagramme de
prédominance des espèces associées à la valine.
d)-
La valine est
assimilée par l'être humain par l'action des sucs pancréatiques dans l'intestin,
où le pH
vaut 8,3. Préciser la forme sous laquelle la valine se trouve dans ces
conditions.

2)-
Correction.
►
Acide
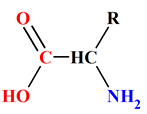
α-aminés en solution aqueuse.
-
En solution aqueuse,
un acide α-aminé existe essentiellement sous forme d’ions dipolaires appelés
amphions ou
zwitterions.
-
Un amphion résulte du
transfert interne d’un proton H+
du groupe carboxyle vers le groupe amine de l’acide α-aminé.
-
On est en présence
d’une réaction acido-basique intramoléculaire.
|
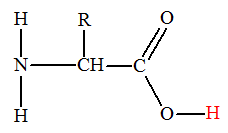
|

|
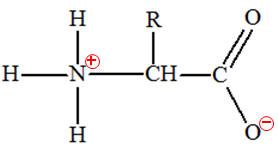
|
|
Acide α-aminé
|
|
Amphion ou
zwitterion
|
-
Remarque :
-
L’amphion est un
ampholyte
comme la molécule d’eau.
-
C’est une espèce
amphotère.
-
C’est l’acide du
couple amphion / anion :
|
H3N+
– CHR – COO–
(aq)
|

|
H2N – CHR – COO– (aq)
|
+
|
H+
|
|
Amphion
|
|
Anion
|
|
|
-
C’est la base du
couple cation / amphion :
|
H3N+ – CHR – COOH
(aq)
|

|
H3N+ – CHR – COO–
(aq)
|
+
|
H+
|
|
Cation
|
|
Amphion
|
|
|
►
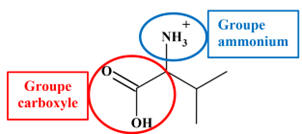
Groupes présents
dans un acide α-aminé : la valine
-
Le groupe carboxyle :
– COOH
ou
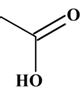
-
Le
groupe ammonium :
– NH3+
a)-
Constante d'acidité
et groupe caractéristique correspondant.
-
Le groupe carboxyle
possède une acidité plus forte que le groupe ammonium.
-
Couple
1 : Couple relatif au groupe carboxyle.
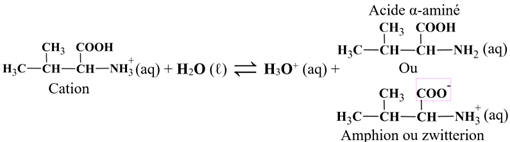
-
En
solution aqueuse :

-
KA1
= 5,0 × 10–3
-
pKA1
=
–
log (KA1) =
–
log (5,0 × 10–3)
-
pKA1
≈ 2,3
-
Couple
2 : Couple relatif au groupe ammonium.

-
En
solution aqueuse :

-
KA2
= 2,0 × 10–10
-
pKA2
=
–
log (KA1) =
–
log (2,0 × 10–10)
-
pKA2
≈ 9,7
b)-
Diagramme de
prédominance des espèces associées à la valine.

c)-
Forme sous laquelle
la valine se trouve à pH = 8,3.
-
La valine est
assimilée par l'être humain par l'action des sucs pancréatiques dans l'intestin,
où le pH vaut 8,3.
-
À
pH = 8,3, c’est l’amphion (ou le
zwitterion) qui prédomine.


IV-
Exercice : Propriétés d’une solution
tampon.
1)-
Énoncé.
Les solutions tampons sont fréquemment exploitées, aussi bien par les
chimistes (étalonnage d'un pH-mètre, par exemple) que par le corps humain
(stabilité du pH sanguin).
Cet exercice a pour but de déterminer la constitution de ce type de
solutions, ainsi que d'en étudier leurs propriétés.
DOC. I : Les solutions
tampons
Les solutions tampons sont des solutions aqueuses ils contiennent aussi bien
l'acide d'un couple acide-base que la base du même couple dans des proportions
voisines.
Elles sont caractérisées par un pH qui varie très peu lors de
l'introduction d'un acide ou d'une base en quantité modérée ou encore lors d'une
dilution raisonnable.
DOC. 2 : Constantes
d’équilibre.
La réaction entre l'acide d'un premier couple noté acide1 / base 1 et la base
d'un second couple noté acide 2 / base 2 a pour équation :
Acide1
+ Base2
 Base1
+ Acide2
Base1
+ Acide2
A1H
+ A2–  A1–
+ A2H
A1–
+ A2H
et possède une constante d'équilibre K (T).
Dans le cadre restreint des solutions aqueuses, lorsque cette constante
d’équilibre dépasse une valeur limite de 103, la transformation
modélisée par le transfert d’un ion hydrogène entre les deux couples est
considérée comme quasi-totale.
Une solution aqueuse S contient l'ammoniac NH3 et
l’ion ammonium NH4+ à la même concentration en
quantité de matière notée C.
DONNÉE :
Constante d’acidité du couple NH4+ (aq) / NH3
(aq) : KA = 6,3 × 10–10
a)-
Exprimer le
pH de la solution
S et vérifier qu’il ne dépend pas de
la valeur de C donc de la dilution.
Calculer alors la valeur du pH de la
solution S.
b)-
Une solution d'acide chlorhydrique
contenant l’ion oxonium en quantité de matière
n est introduit sans variation de
volume dans une solution S de volume
V.
La solution obtenue est notée S’
et la quantité d'acide introduit est telle que
n <
C . V.
-
Écrire l'équation de la réaction (R)
qui modélise le transfert d’ion l'hydrogène de l’ion oxonium à l'ammoniac.
c)-
En appliquant la loi de
l'équilibre, exprimer la constante d’équilibre
K (T)
associée à la réaction (R) en
fonction de la constante d'acidité KA.
d)-
Calculer numériquement
K (T)
et conclure.
e)-
Construire le tableau d'avancement
associé à la transformation modélisée par la réaction (R).
En déduire que de la variation de pH
résultant de l'introduction de l'acide chlorhydrique vaut :
-
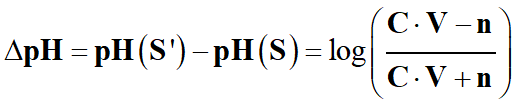
f)-
Calculer
ΔpH dans le cas où :
C = 100 mmol . L–1,
V = 500 mL et
n = 0,10 mmol.
g)-
Réaliser le même calcul dans le
cas où : C = 10 mmol . L–1,
V = 500 mL et
n = 0,10 mmol.
h)-
Justifier que dans les deux cas
précédents, S peut être qualifiée de
solution tampon.
i)-
Conclure sur le lien entre la
concentration d'une solution tampon et son efficacité.

2)-
Correction.
a)-
Expression du
pH de la solution
S.
-
Une solution aqueuse
S contient l'ammoniac NH3
et l’ion ammonium NH4+
à la même concentration en quantité de matière notée
C.
-
Constante d’équilibre de la
réaction :
NH4+ (aq) + H2O
(ℓ)
 NH3
(aq) + H3O+ (aq)
NH3
(aq) + H3O+ (aq)
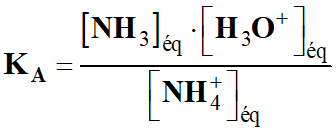
-
Expression du
pH de la solution aqueuse d’ammoniac :
-
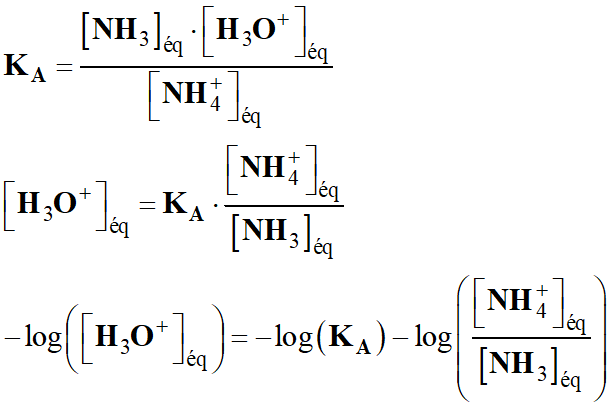
-
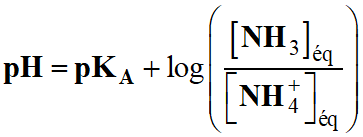
-
Or [NH3]éq
= [NH4+]éq
= C
-
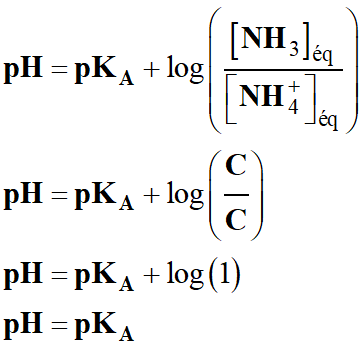
-
Le
pH de cette solution ne dépend pas de
la valeur de C donc de la dilution.
-
Valeur du pH de la solution
S :
-
pH =
pKA =
– log (6,3 × 10–10)
-
pH =
pKA = 9,2
b)-
Équation de la réaction (R)
qui modélise le transfert d’ion l'hydrogène de l’ion oxonium à l'ammoniac.
-
Une solution d'acide chlorhydrique
contenant l’ion oxonium en quantité de matière
n est introduit sans variation de
volume dans une solution S de volume V.
-
La solution obtenue est notée
S’ et la quantité d'acide introduit
est telle que n <
C ×
V
-
Réaction (R) :
NH3 (aq) + H3O+
(aq)
 NH4+
(aq) + H2O (ℓ)
NH4+
(aq) + H2O (ℓ)
c)-
Expression de la constante d’équilibre
K (T)
associée à la réaction (R) en
fonction de la constante d'acidité KA.
-
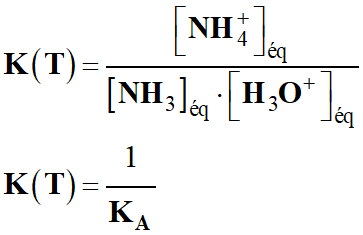
d)-
Calcul numérique
K (T) et conclusion.
-
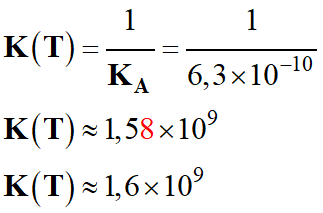
-
Comme
K (T)
> 103, la réaction est quasi-totale :
NH3 (aq) + H3O+
(aq) → NH4+
(aq) + H2O (ℓ)
e)-
Tableau d'avancement associé à la transformation
modélisée par la réaction (R) :
|
Équation
|
NH3
(aq)
|
+ H3O+
(aq)
|
→
|
NH4+
(aq)
|
+ H2O (ℓ)
|
|
état
|
Avancement
x
(mol)
|
n
(NH3)
|
n (H3O+)
|
|
n
(NH4+)
|
|
|
État initial
(mol)
|
0
|
C . V
|
n
|
C . V
|
solvant
|
|
Au cours de la
transformation
|
x
|
C . V
– x
|
n
– x
|
C . V
+ x
|
solvant
|
|
Avancement
final
|
xf
|
C . V
– xf
|
n
– xf
|
C . V
+ xf
|
solvant
|
|
Avancement
maximal
|
xmax
|
C . V
– xmax
|
n
– xmax
|
C . V
+ xmax
|
solvant
|
-
Comme la réaction est
quasi-totale : xf = xmax
-
De plus :
n < C ×
V
-
L’ion oxonium est le réactif
limitant : xf = xmax =
n
-
Le volume
V de la solution ne varie pas :
-
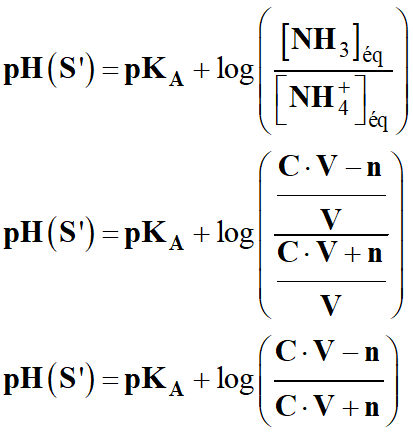
-
La variation de
pH résultant de l'introduction de l'acide chlorhydrique vaut
-
Or
pH (S)
= pKA
-
En conséquence :
-
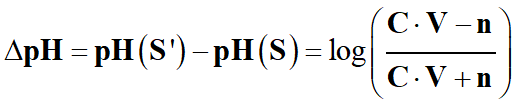
f)-
Calcul de
ΔpH dans le cas où :
-
C = 100 mmol . L–1,
V = 500 mL et n = 0,10
mmol
-
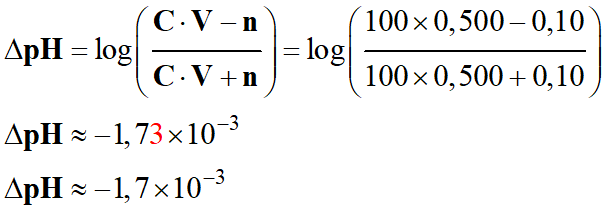
-
Le
pH de la solution diminue faiblement
lors de l’ajout de la solution d’un acide fort
(acide chlorhydrique) dans la solution.
-
Ne pas oublier que : [NH3]éq < [NH4+]éq
-
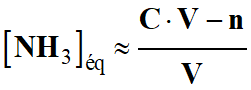 et
et
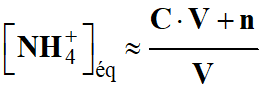
NH4+ (aq) + H2O
(ℓ)
 NH3
(aq) + H3O+
(aq)
NH3
(aq) + H3O+
(aq)
g)-
Calcul de
ΔpH dans le cas où :
-
C = 10 mmol . L–1,
V = 500 mL et n = 0,10
mmol
-
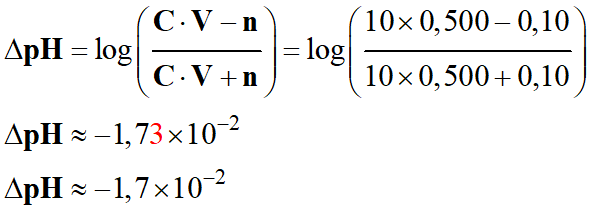
-
Le
pH de la solution diminue faiblement
lors de l’ajout de la solution d’un acide fort (acide chlorhydrique) dans la solution.
h)-
Justification de la qualification de solution
tampon pour la solution S.
-
Une solution aqueuse
S contenant l'ammoniac NH3
et l’ion ammonium NH4+
à la même concentration en quantité de matière constitue une solution tampon.
-
Son
pH varie peut lors de l’ajout d’une
quantité modérée d’un acide fort comme l’acide chlorhydrique.
i)-
Conclusion sur le lien entre la concentration
d'une solution tampon et son efficacité.
-
Une solution tampon est d’autant
plus efficace que sa concentration est élevée.
-
Pour
C = 100 mmol . L–1, la variation de pH est : ΔpH ≈
–
1,7 × 10–3
-
Pour
C’ = 10 mmol . L–1, la variation de pH est : ΔpH’ ≈
–
1,7 × 10–2

V-
Exercice : Séparer des acides α-aminés.
1)-
Énoncé.
L'électrophorèse est une technique de séparation et d'identification
d'espèces chimiques.
Elle est particulièrement utilisée en biochimie pour la séparation de
protéines ou d'acides nucléiques, mais peut aussi être exploitée pour séparer et
identifier les acides α-aminés d’un mélange.
DOC. 1 : Électrophorèse
L électrophorèse est une technique d'analyse fondée sur la migration des
ions, déposés sur un support soumis à une tension électrique.
Sur une bandelette de papier imprégné d'une solution tampon, une goutte d'un
échantillon contenant un mélange d'acide α-aminés est déposée.
La bandelette de papier est connectée à un générateur de tension électrique
constante.
Les acides α-aminés dont la charge globale est positive se déplacent alors
vers le pôle (–) du générateur, ceux
dont la charge globale est négative vers le pôle (+) et ceux qui ne sont
pas chargés ne migrent pas.
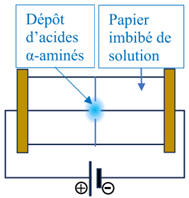
DOC. 2 : Résultat d’une analyse par électrophorèse.

La bande 2 ci-dessus représente le résultat de la séparation par
électrophorèse d'acides α-aminés (arginine, acide aspartique et alanine)
initialement contenus dans un mélange.
Conditions expérimentales :
-
Support : acétate de cellulose,
tampon citrate / NaOH à
pH = 6,0
-
Dépôt : 3μL.
-
Migration : tension de 180 V, 25
min.
-
Coloration : ninhydrine dans
l’éthanol et en présence d’acide éthanoïque.
DONNÉES : Propriétés acide et basique de deux acides α-aminés
Alanine
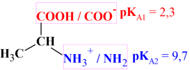
Acide 2-aminopropanoïque (C6H14N2O2)
Lysine
Acide 2,6-diaminohexanoïque (C6H14N2O2)
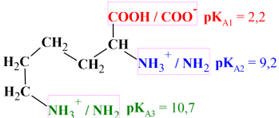
Arginine
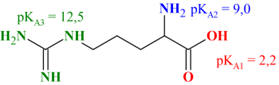
Acide 2-amino-5-carbamimidamidopentanoïque (C6H14N4O2)
-
L'arginine possède
trois
pKA:
-
pKA
du groupe carboxyle (COOH):
pKA1
= 2,17
-
pKA
du groupe amine alpha (NH3+):
pKA2
= 9,04
-
pKA
du groupe guanidinium ( ):
pKA3
=12,48
):
pKA3
=12,48
amino[(4-amino-4-carboxybutyl)amino]methaniminium
Acide aspartique
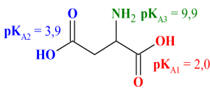
Acide 2-aminobutandioïque (C4H7NO4)
Questions :
1.
Question préliminaire
-
Établir le diagramme de
prédominance des espèces faisant intervenir l'alanine, en fonction du
pH.
2.
Problème.
-
Déterminer le
pH d'une solution tampon qui pourrait imbiber le papier utilisé pour
réaliser la séparation par électrophorèse de l'alanine et de la lysine dissoutes
dans une même solution.

2)-
Correction.
1.
Question préliminaire :
-
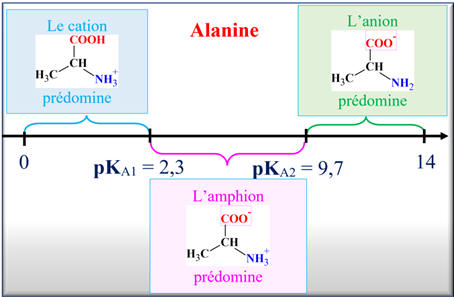
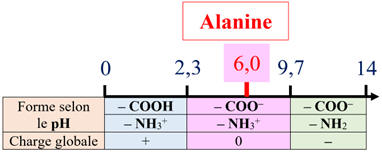
Diagramme de prédominance de l’alanine :
-
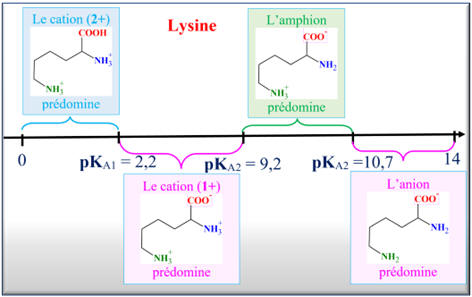
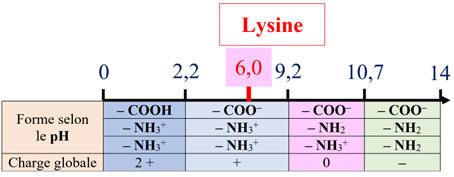
Diagramme de prédominance de la lysine :
2.
Problème :
a)-
Exploitation du DOC. 1 :
-
Les acides α-aminés dont la charge globale est positive se déplacent alors vers
le pôle (–) du
générateur, ceux dont la charge globale est négative vers le pôle (+)
et ceux qui ne sont pas chargés ne migrent pas.
-
La charge globale d’un acide α-aminé dépend de la présence des groupes
caractéristiques carboxyle (– COOH) et amino (–
NH2).
-
Ces groupes possèdent des propriétés acido-basiques.
-
La forme prédominante dépend du pH
de la solution.
-
Le diagramme de prédominance permet de connaitre la forme prédominante en
fonction de la valeur du pH de la
solution.
-
Ainsi pour l’alanine c’est le cation
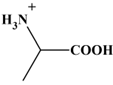 qui prédomine pour
pH < 2,0.
qui prédomine pour
pH < 2,0.
-
C’est l’anion
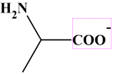 qui prédomine pour
pH >
9,7.
qui prédomine pour
pH >
9,7.
-
Le cation se déplace vers le pôle (–)
du générateur et l’anion vers le pôle (+).
-
L’amphion
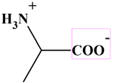 globalement neutre ne migre
pas.
globalement neutre ne migre
pas.
-
En conclusion :
-
pH < 2,0, le groupe carboxyle se
trouve sous la forme (– COOH) et le groupe amino sous la forme (– NH3+).
-
pH > 9,7, le groupe carboxyle se
trouve sous la forme (– COO–)
et le groupe amino sous la forme ((–
NH2).
-
Autre présentation du diagramme de prédominance :
-
Ainsi on peut connaître la charge globale portée par espèce chimique suivant le
pH de la solution tampon.
- Cas de l'alanine :
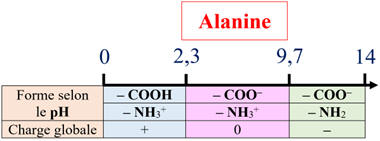
-
Cas de la lysine :
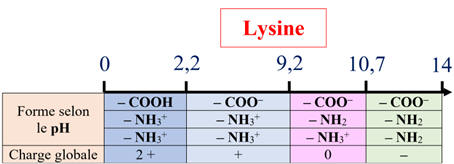
-
Cas de l’arginine :

-
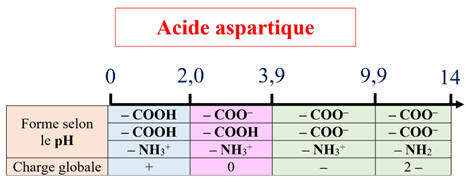
Cas de l’acide aspartique :
b)-
Exploitation du DOC. 2 :
-
Le pH de la solution tampon :
pH = 6,0

►
Bandelette 1 :


-
C’est l’espèce qui porte une charge globale positive qui prédomine et migre vers
la borne négative du générateur.
►
Bandelette 2 :


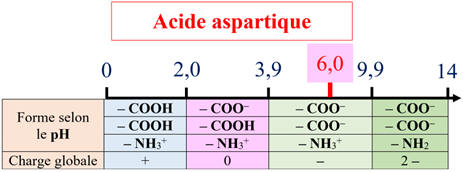

-
L’arginine (espèce +) migre vers la borne négative du générateur.
-
L’acide aspartique (espèce –)
migre vers la borne positive du générateur.
-
L’alanine espèce globalement neutre (amphion) ne migre pas.
-
Dans ce cas, on peut séparer les différents acides α-aminés.
►
Bandelette 3 :


-
L’acide aspartique (espèce –)
migre vers la borne positive du générateur.
c)-
pH de la solution tampon :
-
Le but est de séparer l’alanine et la lysine.
-
Il faut déterminer la valeur du pH de
la solution tampon tel les deux acides α-aminés migrent différemment.
-
Soit ils portent des charges différentes.
-
Soit
l’un est chargé et l’autre porte une charge globale neutre.

-
Si on choisit la valeur du pH de la solution tampon pH
= 6,0,
-
L’alanine globalement neutre ne migre pas (espèce majoritaire : amphion)
-
Alors que la lysine (charge globale +1) migre vers la borne (–)
du générateur.
L'acide phosphorique
Solution tampon
Effet tampon : l’aspirine tamponnée

VI-
Exercice : Mesurer une constante
d’acidité.
1)-
Énoncé.
2)-
Correction.

VII-
Exercice : Prévoir le pH de l’eau d’un
aquarium.
1)-
Énoncé.
L’aquaponie est une méthode permettant simultanément d'élever des poissons et
de cultiver les plantes :
Les déjections des poissons, riches en ammoniac, sont transformées en engrais
azotés par des bactéries.
L’eau ainsi enrichie, circule dans les cultures, est purifiée grâce à elles
puis retourne ensuite dans l'aquarium.
Avant transformation par les bactéries l'eau de l'aquarium est légèrement
basique.
►
Comment prévoir le pH de
l'eau d'un aquarium avant qu'elle n'entre dans le milieu contenant les
bactéries ?
DOC1. : Constante
de basicité KB.
La constante de basicité d'un couple acide-base faible (noté Acide / Base)
est la constante d'équilibre associée à la réaction de la base du couple avec
l'eau.
Elle est notée KB (acide / base) et est associée à la
constante : pKB = – log (KB).
DOC. 2 :
Modèles moléculaires :
Molécule d'ammoniac et schéma de Lewis
L'ion ammonium et schéma de Lewis
DONNÉES :
-
À 25 ° C, le couple
NH4+ /
NH3 est caractérisé par
la constante d’acidité pKA
= 9,2
-
Diagramme de distribution :

Questions
1.
Questions préliminaires.
a)-
Écrire l'équation de la réaction
R1 dont la constante d'équilibre est le produit ionique de
l'eau Ke.
b)-
Écrire l'équation de la réaction
R2 dont la constante d'équilibre est la constante d'acidité
KA du couple NH4+ / NH3.
c)-
Prouver que l'équation de la
réaction R3 à laquelle est associée la constante de basicité
KB du couple NH4+ / NH3
se déduit simplement des deux équations des réactions précédentes R1
et R2.
d)-
Déduire de l'étude de l'équilibre
d'un système contenant simultanément les quatre espèces NH4+
(aq), NH3 (aq),
H3O+ (aq) et HO– (aq),
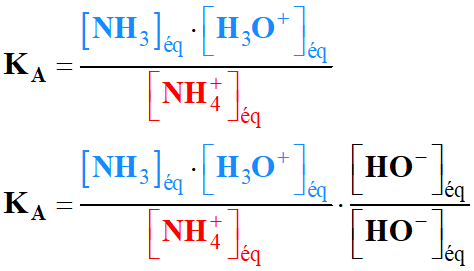
la relation entre les trois constantes d'équilibre KA, KB
et Ke, puis les trois constantes pKA,
pKB et pKe.
2.
Problème :
Une solution, de volume V = 100 mL, est préparée par dissolution
totale dans l'eau d'ammoniac gazeux en quantité n0 = 1,0 mmol.
Cette solution modélise l'eau en sortie du circuit d'aquaponie d'un aquarium.
a)-
Établir le tableau d'avancement
pour la transformation modélisée par le transfert de l'ion hydrogène entre l'eau
et l’ammoniac dissous.
b)-
Calculer le taux d'avancement à
l'équilibre, défini par : τ =
xf / xmax
c)-
Déduire le pH de la
solution d'ammoniac ainsi préparée.
d)-
Vérifier que les calculs effectués
sont compatibles avec le diagramme de distribution du couple NH4+
/ NH3.

2)-
Correction.
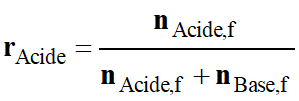
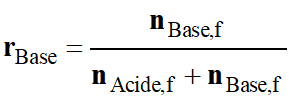
![]()
![]()
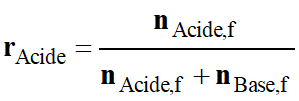
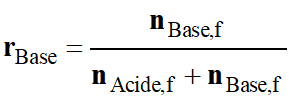
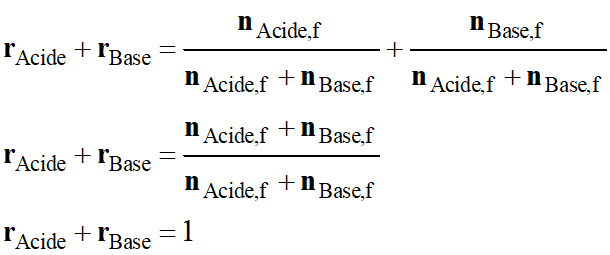
![]()
![]()

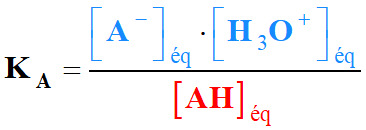
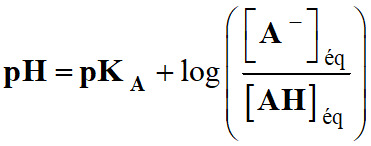
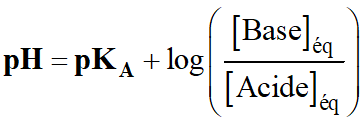
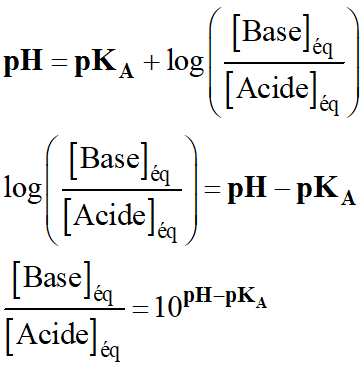
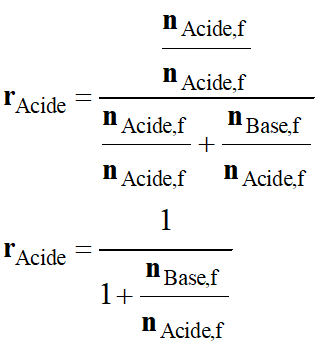
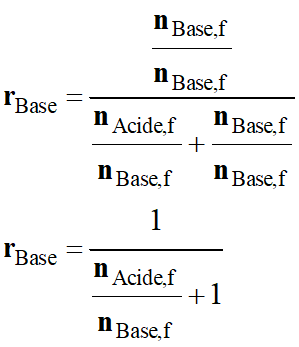
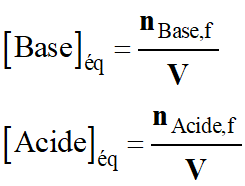 La
grandeur V représentant le volume de
la solution
La
grandeur V représentant le volume de
la solution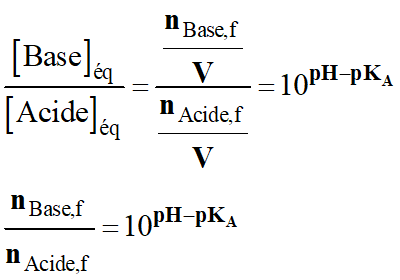
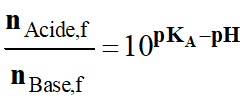










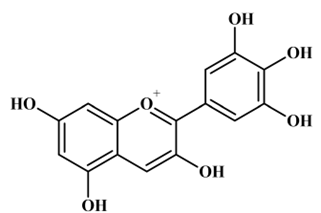
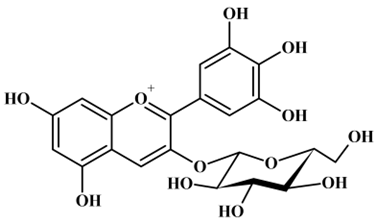
















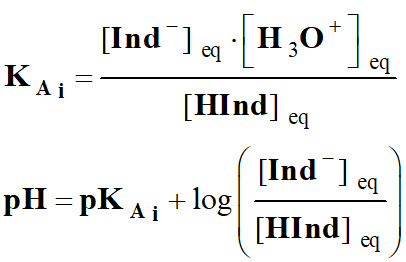
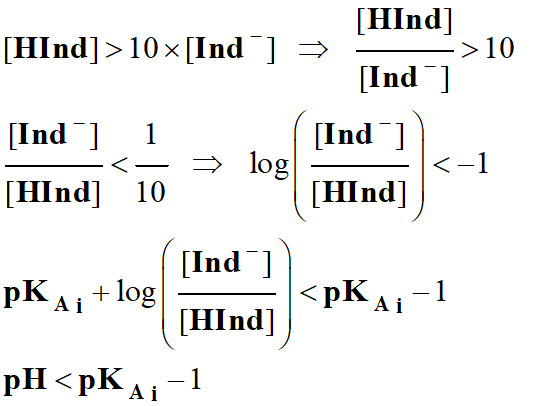
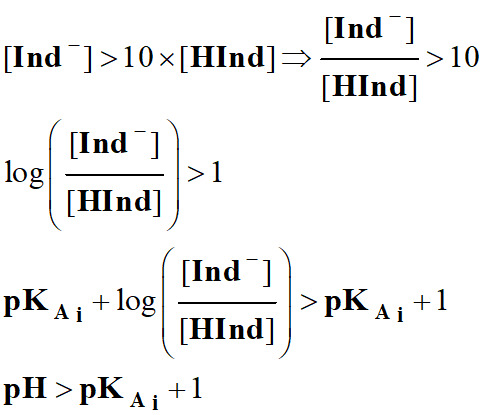
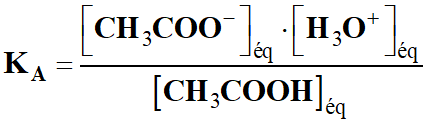
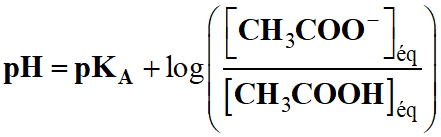

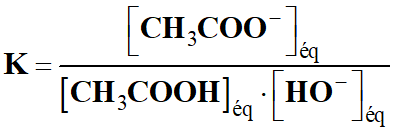
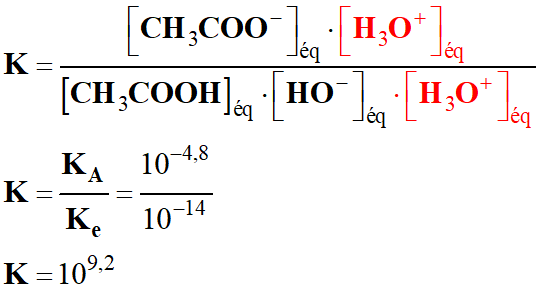
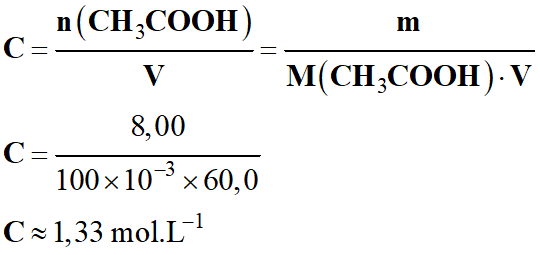
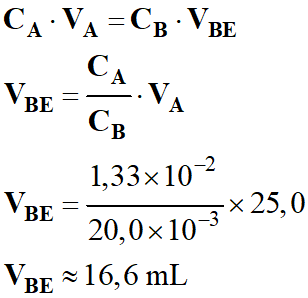
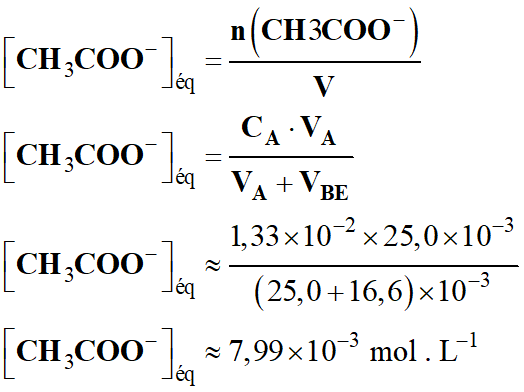
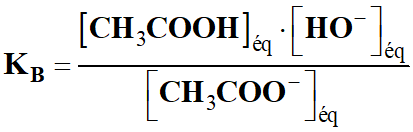
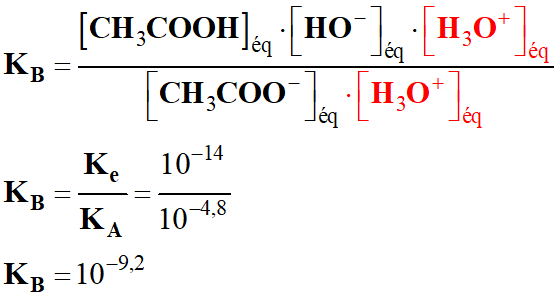
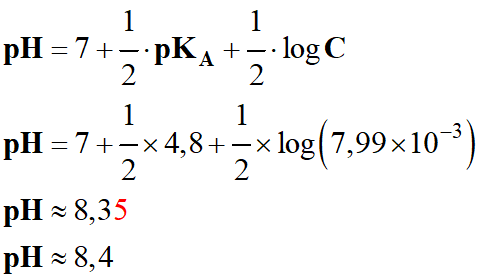







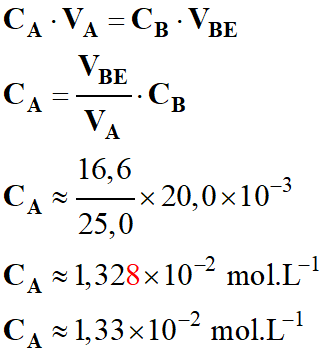



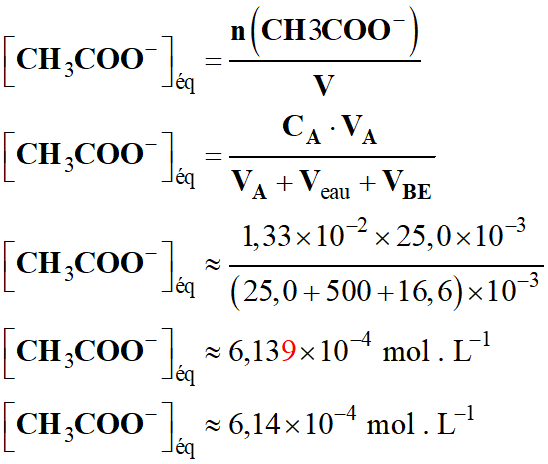
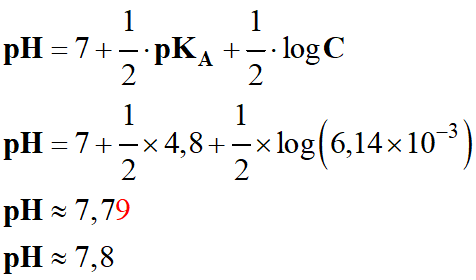
 ou
ou
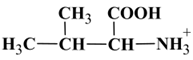







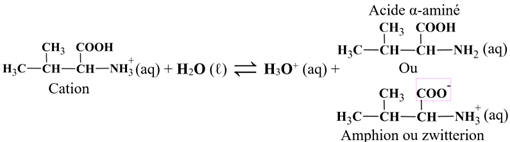





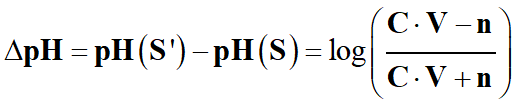
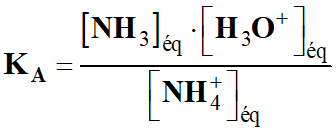
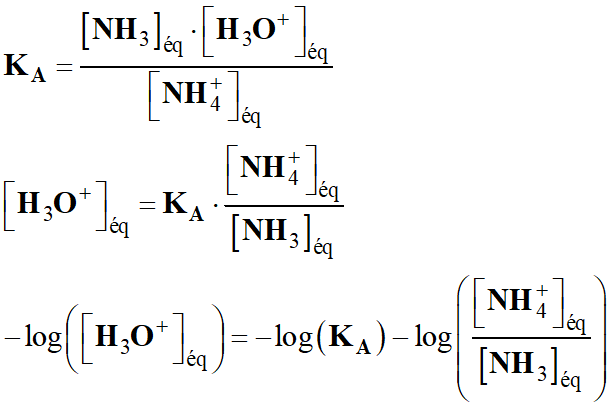
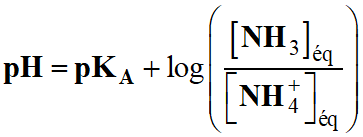
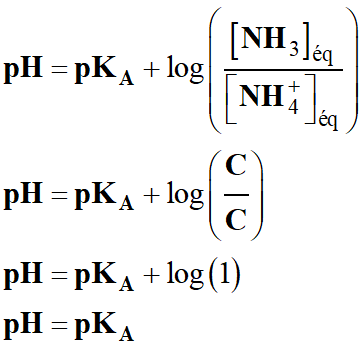
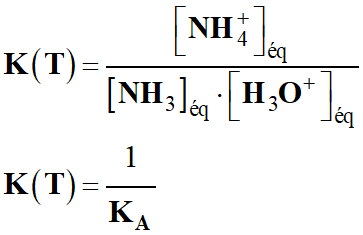
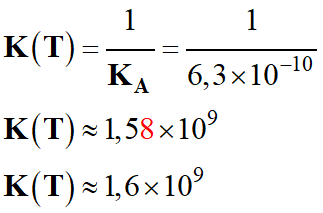
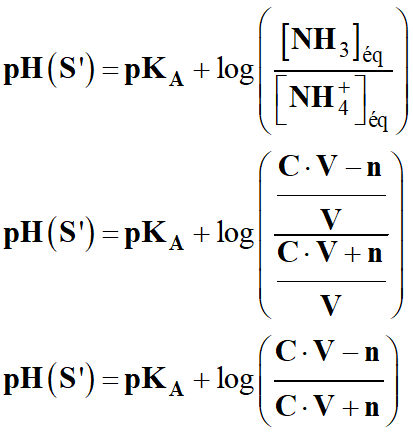
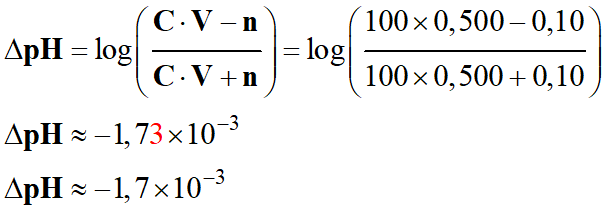
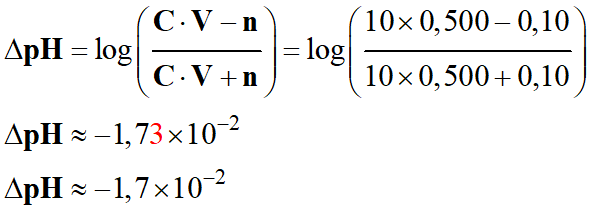


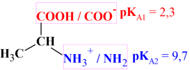





 ):
):





 qui prédomine pour
pH < 2,0.
qui prédomine pour
pH < 2,0. qui prédomine pour
pH >
9,7.
qui prédomine pour
pH >
9,7. globalement neutre ne migre
pas.
globalement neutre ne migre
pas.