|
Chimie |
Contrôle N° 04 1 h : correction |
|
|
|
|
II - Réaction entre l'acide éthanoïque et l'eau . III - Réaction entre l'ammoniac et l'eau. IV - Évolution d'une mélange d'acide éthanoïque et d'ammoniac dans l'eau.. |
|
Données : - Calculatrice autorisée et les mesures sont effectuées à 25
°C. - Acide éthanoïque / ion éthanoate :
CH3COOH /
CH3COO –
:
pKA1
=
4,7. - Ion Ammonium / ammoniac :
NH4 +
/ NH3
:
pKA2
=
9,2. - Les couples de l’eau :
H3O +
/
H2O :
pKA3
= 0 et
H2O /
OH –
:
pKA4
= 14 - Les questions
I,
II,
III
sont indépendantes. |
|
1)- Qu’appelle-t-on produit ionique de
l’eau ? (0,25 pt) - Produit ionique
de l’eau - La définition, le
produit ionique de l’eau est donnée par la relation :
- Ke
= [H3O +]eq .
[OH –]eq - Ceci est vrai
pour toutes les solutions aqueuses. - Le produit
ionique de l’eau est la constante d'équilibre de
la réaction
d’autoprotolyse de l’eau : 2
H2O (ℓ)
= H3O +
(aq) +
OH– (aq) 2)- Déterminer sa valeur à partir des données
précédentes (0,25 pt) - étude
du couple : H2O / OH–
H2O
(ℓ) + H2O (ℓ)
= H3O +
(aq) +
OH– (aq)
- KA4
= Ke = [H3O +]eq . [ OH
–]eq - KA4
= 1,0
× 10 -14 -
pKA4
= 14 |
II-
Réaction de l’acide éthanoïque et de l’eau.![]()
|
On introduit de l’acide éthanoïque pur dans de l’eau. On obtient une solution aqueuse S1 de volume V1 = 10 mL, de concentration C1 = 2,0 × 10– 2 mol / L. La mesure de la valeur du pH de la solution S1 donne pH = 3,2.
1)- Écrire l’équation de la réaction de l’acide éthanoïque avec l’eau. On note (1) cette équation. (0,25 pt) - Équation de la réaction de l’acide éthanoïque avec l’eau.
2)- Tracer le diagramme de prédominance du couple acide éthanoïque / ion éthanoate en fonction du pH. En déduire l’espèce prédominante dans la solution S1. (0,5 pt) - De la réaction précédente, on tire : - - Premier cas : si
-
- Deuxième cas : si - - Troisième cas : si - - représentation sur un axe horizontal : couple CH3COOH / CH3COO– |
- Dans le cas présent comme
pH = 3,2,
pH <
pKA1
= 4,7,
-
c’est l’acide qui prédomine. 3)-
Avancement de la réaction de l’acide éthanoïque avec l’eau. a)- Avancement final
x1f de la réaction de l’acide éthanoïque
avec l’eau (0,5 pt) - Avancement final :
|
Équation |
AH (aq) + |
H2O (ℓ) |
= |
A– (aq) |
+ H3O + (aq) |
|
|
état |
Avancement
x
(mmol) |
mol |
mol |
|
mol |
mol |
|
État
initial (mol) |
0 |
n1 = C1 . V1
|
excès |
|
0 |
e |
|
Avancement
final |
x1f |
n1 – x1f |
excès |
x1f |
x1f |
|
|
Avancement
maximal |
x1max |
n1 – x1max
= 0 |
excès |
|
x1max |
x1max |
|
- x1f
= [H3O +]eq . V1
avec [H3O +]eq
= 10 – pH mol / L
- x1f
= 10 – pH . V1
- x1f
≈ 10– 3,2 × 10
× 10– 3
- x1f
≈ 6,3
× 10– 6 mol b)- Comparer x1f et
l’avancement maximal xmax (avancement qui serait atteint si la réaction
était totale). (0,25 pt) - L’avancement
maximal est l’avancement qui serait atteint si la réaction entre
l’acide éthanoïque
et l’eau était totale.
- L’acide
éthanoïque qui est le réactif en défaut est alors complètement
consommé. - x1max
= n1 . V1 - x1max
≈ 2,0
× 10– 2 ×
10
×
10– 3 - x1max
≈ 2,0
×
10– 4 mol c)- En déduire le taux d’avancement final
τ1 de cette réaction. (0,25 pt) - Taux d’avancement
de la réaction : -
d)- Le résultat est-il cohérent avec celui de
la question 2)- ? Justifier. (0,25 pt) - Il y a seulement
environ 3,2 % de l’acide éthanoïque qui a réagi avec l’eau. - L’acide
éthanoïque réagit peu avec l’eau. - L’espèce qui
prédomine est bien l’acide éthanoïque. - Il reste 96,8 %
d’acide éthanoïque. Il se forme 3,2 % d’ions éthanoate - La réaction entre
l’acide éthanoïque et l’eau est une réaction limitée. - Il y a bien
cohérence entre le taux d’avancement final et l’espèce
prédominante. |
III-
Réaction entre l’ammoniac et l’eau.![]()
|
1)- Écrire l’équation de la réaction de l’ammoniac avec l’eau. On note (2) cette équation. (0,25 pt)
2)- Tracer le diagramme de prédominance du couple ion ammonium / ammoniac en fonction du pH. En déduire l’espèce prédominante dans la solution S 2. (0,5 pt) - Pour étudier les domaines de prédominance, il faut travailler avec la
réaction suivante :
- De la réaction précédente, on tire :
- - Premier cas : si -
- Deuxième cas : si - - Troisième cas : si - représentation sur un axe horizontal : couple NH4 + / NH3 |
|
- Dans le cas présent comme
pH = 10,6,
pH >
pKA2
= 9,2, c’est l’ammoniac
qui prédomine. 3)- Taux d’avancement final τ 2 de cette réaction. (0,5 pt) - Tableau d’avancement de la réaction : |
|
NH3 (aq) + H2O (ℓ) = HO– (aq) + NH4+ (aq) |
(2) |
|
Équation |
NH3
(aq) + |
H2O
(ℓ) |
= |
NH4+
(aq) |
+ HO–
(aq) |
|
|
état |
Avancement
x (mmol) |
mol |
mol |
mol |
mol |
|
|
État initial
(mol) |
0 |
n2
= C2 . V2 |
excès |
0 |
e |
|
|
Avancement
final |
x2f |
n2
– x2f |
excès |
x2f |
x2f |
|
|
Avancement
maximal |
x2max |
n2
– x2max
= 0 |
excès |
x2max |
x2max |
|
|
- - - Seulement 4 % de l’ammoniac a réagi avec l’eau. - L’espèce chimique qui prédomine est bien l’ammoniac. - Il reste 96 % d’ammoniac dans l’eau. - Il se forme seulement 4 % d’ions ammonium. - Ceci est en accord avec le taux d’avancement de la réaction. |
IV-
Évolution d’un mélange d’acide éthanoïque et d’ammoniac dans
l’eau.![]()
|
On réalise une solution S de volume V = 20 mL en introduisant dans l’eau nA = 2,0 × 10– 4 mol d’acide éthanoïque et nB = 1,0 × 10– 4 mol d’ammoniac. On modélise la transformation qui a lieu par la réaction suivante :
1)- Calculer le quotient de réaction du système dans l’état initial : Qr, i. (0,5 pt) - Quotient de réaction initial : - - comme : [NH4+]i = [CH3COO –]i = 0 - Q r, i = 0 2)- Comparer Q r, i au quotient de réaction dans l’état d’équilibre Qr, éq. Que peut-on en déduire ? - Valeur du quotient de réaction à l’équilibre : -
- Comme
Q
r, i <
K, la réaction s’effectue
dans le sens direct. 3)- Exprimer Q r, éq en fonction de l’avancement final x3f de la réaction (on pourra s’aider d’un tableau). En déduire la valeur de l’avancement final x3f. La comparer à la valeur de l’avancement maximal x3max.(1 pt) |
Tableau :
|
Équation |
CH3COOH (aq) + |
NH3 (aq) |
= |
CH3COO – (aq) |
+ NH4+ (aq) |
|
|
état |
Avancement
x
(mol) |
|
|
|
|
|
|
État initial
(mol) |
0 |
n1 =
2,0
× 10 – 4
|
n2 =
1,0
× 10 – 4 |
|
0 |
0 |
|
Avancement
final |
x3f |
n1 – x3f |
n2 – x3f |
x3f |
x3f |
|
|
Avancement
maximal |
x3max |
n1 – x3max
=
0 |
n2 –
x3max
= 0 |
|
x3max |
x3max |
-
- On développe l’expression précédente : -
- Il faut résoudre une équation du deuxième degré en
x3f. - Remarque comme
K
>> 1,
K
– 1 ≈
K - - On calcule les différentes constantes : - - La résolution de cette équation donne deux solutions :
{
x1 =
x3max
≈
1,0
×
10 – 4
mol
x2 =
x3max
≈
2,0
× 10 – 4
mol - La bonne solution est
x1 =
x3f
≈
1,0
× 10– 4
mol
car l’avancement final
d’une réaction ne peut pas être supérieur à
l’avancement maximal. - Ici l’ammoniac est le réactif limitant :
- n2
– x3max
=
0 - n2 =
x3max
- n2 =
x3max
≈
1,0
× 10 – 4
mol 4)-
La transformation du système peut-elle être considéré comme totale ?
à
l’aide du bilan de matière dans l’état final, citer les espèces prédominantes
dans la solution
S.
Expliquer pourquoi la valeur du
pH
de la solution
S
est égale à 4,7. (0,75) - La transformation peut être considérée comme totale car d’une part
:
-
K
> 10
4
et d’autre par car
- x1 =
x3f
≈
1,0
× 10 – 4
mol
≈ x3max
Tableau final
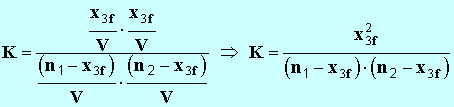
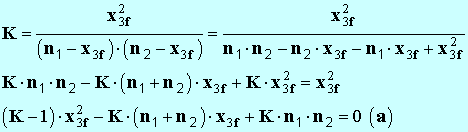
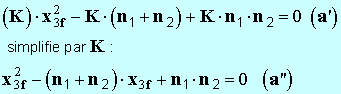
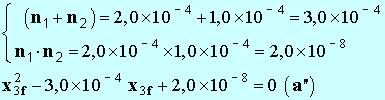
|
Équation |
CH3COOH (aq) + |
NH3 (aq) |
= |
CH3COO– (aq) |
+ NH4 + (aq) |
|
|
état |
Avancement
x (mol) |
|
|
|
|
|
|
État initial
(mol) |
0 |
n1 =
2,0
× 10– 4 |
n2 =
1,0
× 10– 4 |
|
0 |
0 |
|
État final |
xf |
1,0 × 10– 4 |
0 |
1,0 × 10– 4 |
1,0 × 10– 4 |
|
|
- On remarque que : - n (CH3COO –) = n (CH3COOH) ≈ 1,0 × 10– 4 mol - En conséquence :
- |