|
Interaction lumiète-matière. |
|
|
|
|
|
|
QCM N° 18
Interaction
Lumière-matière.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Le photon
est : |
L’une des
particules
constitutives
de l’atome |
Une particule
formant un
quantum
d’énergie
lumineuse |
Une particule
émettant de
la lumière |
B |
|
2 |
On donne le
diagramme
énergétique
d’un atome.
|
Dans l’état
fondamental,
l’énergie de
l’atome vaut
10 eV |
Lorsque
l’énergie
de l’atome
vaut
– 6,0 eV,
l’atome
est excité |
Lorsque
son énergie
est nulle,
l’atome est
ionisé. |
BC |
|
3 |
La fréquence
d’un photon
d’énergie E
= 3,47 eV est :
Données :
c
= 3,00 × 108 m . s – 1
h
= 6,626 × 10 – 34 J . s
1 eV = 1,6 ×
10–19 J |
5,24 × 1033
Hz |
8,37 × 1014
Hz |
5,24 × 1014
Hz |
B |
|
4 |
Un signal Wifi
utilise une
onde
électromagnétique de
fréquence
n
=
2,4 GHz.
Données :
c
= 3,00 × 108 m . s – 1
h
= 6,626 × 10 – 34 J . s
1 eV = 1,6 ×
10–19 J
La longueur
d’onde du
visible est
dans l’intervalle
[400 nm ; 800
nm] |
Cette onde
peut se
propager
dans le vide |
Cette onde
est dans le
domaine
visible |
Sa longueur
d’onde est
de l’ordre
de grandeur
du décimètre |
AC |
|
5 |
Une radiation
de longueur
d’onde λ
= 625 nm a une
fréquence
égale à :
c
= 3,00 × 108 m . s – 1
h
= 6,626 × 10 – 34 J . s
1 eV = 1,6 ×
10–19 J |
4,8 × 1014
Hz |
2,1 × 10–15
Hz |
188 Hz |
A |
|
6 |
La fréquence
d’un photon
d’énergie E
= 3,47 eV est :
Données :
c
= 3,00 × 108 m . s – 1
h
= 6,626 × 10 – 34 J . s
1 eV = 1,6 ×
10–19 J |
5,24 × 1033
Hz |
8,37 × 1014
Hz |
5,24 × 1014
Hz |
B |
|
7 |
À quelle
transition
énergétique
l’émission
d’une
radiation jaune
(λ =
570 nm)
correspond-elle ? |
|
|
|
A |
|
8 |
Deux sources
de lumière
ci-dessous,
une lampe à
vapeur de
sodium et un
laser donnent
une lueur
jaune
identique pour
l’œil humain. |
Le spectre
1 est le
spectre
d’émission
de la
lampe
à vapeur
de sodium |
Le spectre
1 est le
spectre
d’émission
du laser |
Le spectre
2 est ce
que l’on
voit quand
on observe
la lampe
avec une
loupe |
B |
|
9 |
Le spectre du
cadmium : |
Est un
spectre
d’émission |
Est un
spectre
d’absorption |
Prouve que
l’atome de
cadmium
possède au
moins 4
niveaux
d’énergie |
AC |
|
10 |
Un moteur
consomme en
une minute une
énergie
électrique
E = 15 kJ et produit un travail
W = 9,3 kJ. |
La puissance
fournie
vaut
P
= 155 W |
Le
rendement
η = 62 % |
Le
rendement
η = 1,6 % |
AB |
|
11 |
Un panneau solaire convertit 80 W de puissance lumineuse reçue en 12 W de puissance électrique.
Son rendement vaut : |
0,15 |
6,7 % |
15 % |
AC |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Le Photon
(Cours Terminale S : 2000)
La spectroscopie (Cours de terminale 2000)
La lumière : un flux de photons
(Cours Terminale : 2020)
Lumière : Ondes et particules
(Cours Première : 2020)
Transfert quantique d'énergie et dualité onde-corpuscule.
(Cours
Terminale : 2010)

Le photon :
-
En 1926, Gilbert Newton
invente le mot « photons pour nommer ces quanta.
-
Les photons sont des
particules de masse nulle et de charge nulle se propageant à la vitesse de la
lumière.
-
Quantum d’énergie.
-
Énergie d’un photon :
-
L’énergie de la lumière est
transportée par des photons qui présentent un aspect particulaire et un aspect
ondulatoire.
-
L’énergie d’un photon est
donnée par la relation :
-
E
= h
.
n
-
L’énergie
E
représente l’aspect particulaire du photon.
-
La fréquence
n représente son aspect
ondulatoire.
-
Pour une onde
électromagnétique de fréquence
n et de
longueur d’onde λ dans le vide,
-
On peut écrire :
|
Relation de Planck-Einstein :
|
|
La grandeur h
est la constante de Planck :
h = 6,626 × 10 – 34 J . s |
|
La fréquence
n
en hertz (Hz)
La longueur d’onde dans le vide
λ en mètre (m) |
|
La célérité de la lumière dans le vide :
c = 3,00 × 108 m . s – 1 |
|
Énergie
E en joule (J) ou
électronvolt (eV)
-
1 eV =
1,6 × 10–19 J |
-
Cette relation met en
évidence le caractère à la fois :
-
Particulaire :
photon, particule de masse nulle et d’énergie
Ephoton.
-
Ondulatoire :
fréquence ν,
longueur d’onde λ.
-
On parle de
dualité onde-corpuscule.
|
|
λ0 :
longueur d’onde dans le vide (m) |
|
c :
vitesse de la lumière dans le vide (m . s–1) |
|
|
T :
période (s) |
|
|
ν :
fréquence (Hertz) |
Niveau d’énergie d’un atome :
-
Les variations d’énergie d’un
atome sont quantifiées.
-
L’atome ne peut exister que
dans certains états d’énergie ou niveaux d’énergie bien définis.
-
Un photon de
fréquence ν est émis lorsque l’atome
effectue une transition d’un niveau d’énergie
Ep
vers un niveau inférieur
En tel
que :
-
Ep
- En
= h
. ν
-
Il résulte de ceci que les
énergies d’un atome sont quantifiées.
-
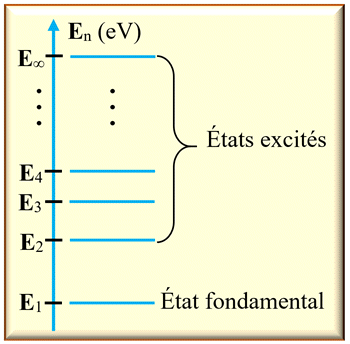
Diagramme de niveaux
d’énergie.
-
Sur le diagramme de niveaux
d’énergie d’un atome :
-
Le niveau d’énergie le plus
bas correspond à l’état stable de l’atome.
-
On l’appelle
l’état fondamental
-
Les autres niveaux
correspondent à des états moins stables.
-
On les appelle
les états excités.
-
L’état de plus haute énergie
correspond à la perte d’un électron : l’atome est dit ionisé.
-
Par
convention, son énergie est notée :
E∞
= 0 eV.
-
Comme les écarts entre les
niveaux d’énergie sont faibles, on utilise l’électron-volt :
-
1 eV = 1,6 ×
10–19 J
-
Remarque : Les énergies des
autres états sont négatives.
-
Schéma d’un diagramme
d’énergie d’un atome :
Énergie d’un photon et sa fréquence :
-
L’énergie d’un photon est
donnée par la relation :
-
E
= h .
ν
-

Énergie d’un photon, sa longueur d’onde et sa
fréquence :
-
Relation donnant l’énergie
d’un photon : en fonction de la fréquence ou en fonction de sa longueur d’onde
-
![]()
-
On peut calculer la longueur
d’onde de la radiation :
-

Fréquence de la radiation :
-
Relation :
-

Fréquence associée à un photon :
(question 6, idem question 3)
-
Relation :
-

Transition électronique :
-
Émission d’un photon :
-
Dans ce cas,
Einitial
> Efinal
-
L’atome perd de l’énergie en
émettant un photon.
-
Sur un diagramme d’énergie,
on représente cette transition par une
flèche verticale
orienté vers le bas.
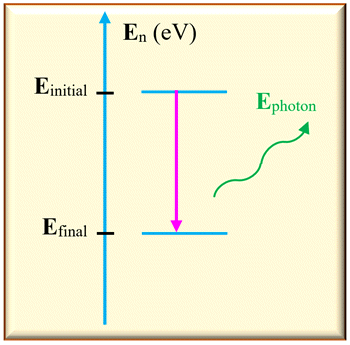
-
L’énergie libérée est égale à
la différence d’énergie entre les deux niveaux :
-
ΔE
= | Efinal
– Einitial
|
-
Cette énergie est transportée
par un photon :
-
Ephoton
= ΔE
= | Efinal
– Einitial
| = h
. ν
-
Premier cas :
-

-
Deuxième cas :
-

-
Troisième cas : le diagramme
correspond à l’absorption d’un photon :
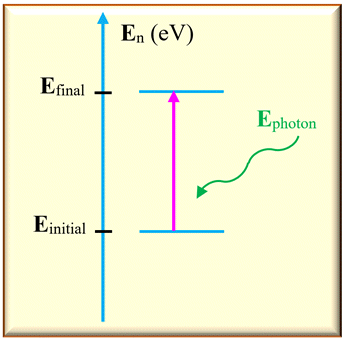
►
Absorption d’un photon par un atome.
-
Dans ce cas,
Einitial <
Efinal
-
L’atome gagne de
l’énergie en absorbant un photon.
-
Sur un diagramme
d’énergie, on représente cette transition par une
flèche verticale
orienté vers le haut.
Lumière émise par un laser :
-
Un laser émet une lumière
monochromatique.
-
elle est
constituée de rayonnements ayant tous la même longueur d'onde
λ caractéristique
du laser utilisée.
-
On ne peut pas
décomposer la lumière émise par un laser.
-
Le laser rouge utilisé au
lycée est une radiation de longueur d’onde λ
= 633 nm = 6,33
x
10–7 m.
-
La lumière produite par un
laser est constituée d’une seule radiation, elle est monochromatique.
-
Lumière blanche :
-
Spectre de la
lumière blanche :
-
Spectre de la lampe à vapeur
de sodium :
-
Le doublet du sodium : radiations
jaunes de longueur d’onde voisine de 590 nm
-
(en réalité, il s’agit d’un
doublet :589,0 nm et 589,6 nm)

Spectre d’émission :
-
Un spectre d’émission
est un spectre produit par la lumière directement émise par une source.
-
Le spectre d’émission d’une
entité chimique est constitué de raies colorées sur fond noir.
-
On est en présence d’un
spectre de raies.
Spectre d’absorption :
-
Un spectre d’absorption est
un spectre obtenu en analysant la lumière blanche qui a traversé une substance.
-
Le spectre d’absorption d’une
entité chimique est constitué de raies noires sur fond coloré.
-
On est en présence d’un
spectre de raies.
-
Exemple :
-
Lampe à vapeur de
mercure :

-
Spectre d'absorption et d'émission du mercure :-
Une entité chimique ne peut
absorber que les radiations qu’elle est capable d’émettre.
-
Les raies d’émission ou
d’absorption permettent d’identifier une entité chimique présente dans un gaz.
-
Chaque entité chimique
possède son propre diagramme d’énergie.
-
Il est ainsi possible
d’identifier une entité chimique (atome, molécule ou ion) à partir de son
spectre d’émission ou d’absorption.
-
Les radiations émises ou
absorbées sont caractéristiques d’un atome car elles dépendent des niveaux
d’énergie de cet atome.
-
Le spectre d’émission du
cadmium, donné dans la question, est constitué de 4 raies d’émission.
-
En conséquence, l’atome de
cadmium possède au moins 4 niveaux d’énergie.
Rendement et puissance d’un moteur électrique :
-
Le rendement d’un moteur
électrique est le rapport de l’énergie utile Wu
par l’énergie totale reçue WE
par le moteur.
-
![]()
-
Le rendement est un nombre
sans unité. On peut l’exprimer en pourcentage.
-
Dans le cas présent :
E =
WE
et Wu
= W
-

-
Puissance fournie :
-

Rendement d’un panneau solaire :

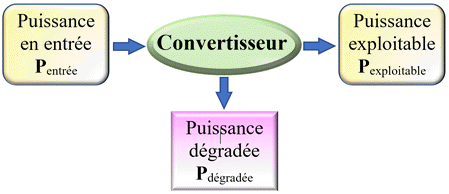
-
Le panneau photovoltaïque :
-
Le panneau solaire convertit
la puissance solaire en puissance électrique.
-
On en déduit
que la puissance en entrée
Pentrée
est la puissance du rayonnement solaire
PR.
-
La puissance
exploitable Pexploitable
est la puissance
électrique Pélec
disponible pour le circuit électrique.
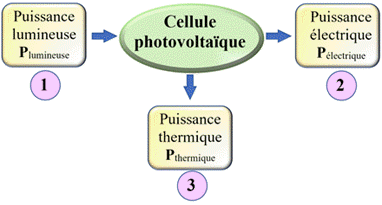
-
Rendement :
|
|
η
sans unité |
|
Pélec
en watt (W) |
|
|
PR
en watt (W) |
-
Dans le cas
présent : Pentrée
= PR
puissance lumineuse reçue.
-
Pexploitable
= Pélec
puissance électrique disponible.
-

|
|