|
|
Lumière : Ondes et particules |
|
|
|
|
|
I-
Introduction : rappels et compléments. 1)- La célérité de la lumière. 2)- La lumière polychromatique et
monochromatique. |
|
II-
La lumière et la dualité onde-particule. |
|
III-
L’interaction lumière-matière. 1)- Quantification de l’énergie des atomes. 2)- Émission et absorption de la lumière par un
atome. |
|
1)- L’origine des raies du mercure.
|
|
Certaines
images ont été réalisées |
|
1)- Exercice 03 page 348 : Connaître la longueur d’onde
et la fréquence.
2)- Exercice 07 page 348 : Convertir des unités.
3)- Exercice 08 page 348 : Donner un ordre de grandeur.
4)- Exercice 09 page 349 : Calculer une énergie à partir
d’une fréquence.
5)- Exercice 11 page 349 : Identifier une transition
énergétique.
6)- Exercice 13 page 349 : Calculer une énergie à partir
d’un spectre.
7)- Exercice 14 page 349 : Déterminer la couleur d’une
raie.
8)- Exercice 15 page 349 : Exploiter une transition
énergétique.
9)- Exercice 16 page 349 : Utiliser un diagramme
d’énergie.
10)- Exercice 20 page 350 : Thermographie.
11)- Exercice 28 page 352 : Lumière d’une étoile : Véga.
12)- DS 01 : Le laser à Argon (50 min) : Exercice 28 page
353.
|
I- Introduction : Rappels
et compléments.
1)- La célérité de la
lumière.
-
En 1674, étudiant
les éclipses de la planète Jupiter sur son satellite Io,
- Le Danois Römer donne une première estimation de la vitesse de la lumière dans le vide.
-
La valeur fixée
pour la vitesse de propagation de la lumière dans le vide est :
|
c = 299 792 458 m . s |
-
C’est une constante
Universelle.
-
Cette vitesse est
une vitesse limite.
-
Aucun objet
matériel ne peut atteindre cette vitesse dans le vide.
-
Dans les milieux
transparents, la lumière se déplace moins vite que dans le vide.
-
La vitesse de la
lumière dans l’air est peu différente de celle dans le vide.
-
Comme valeur
approchée dans l’air et le vide, on choisit la valeur suivante :
|
cair
≈
c
≈
3,00 × 108
m . s |
2)- La lumière
polychromatique et monochromatique.
-
Déviation et
dispersion de la lumière blanche par un prisme :
-
Le prisme dévie et
décompose la lumière blanche en lumières colorées du rouge au violet.
-
C'est un phénomène
de dispersion.
-
L'ensemble des
couleurs obtenues constitue le spectre de la lumière blanche.
-
Le spectre est
continu du rouge au violet.
-
La lumière blanche
est constituée de plusieurs couleurs ou radiations : c’est une lumière
polychromatique.
b)-
La lumière émise par un
laser.
-
On éclaire une
fente avec un faisceau laser de couleur rouge et on envoie le faisceau obtenu
sur la face d’un prisme.
-
La lumière produite
par un laser est constituée d’une seule radiation, elle est monochromatique.
-
La lumière blanche
est un mélange de toutes les radiations visibles.
-
Spectre de la
lumière blanche :
-
On est en présence
d’un spectre continu.
-
De même, un corps
chaud émet un spectre continu qui dépend de la température du corps chaud.
-
Plus le corps est
chaud et plus le spectre s’étend vers le violet.
-
Exemple :
Spectre d’une lampe à incandescence dont on augmente la
tension

d)-
Spectres de raies d’émission.
-
Exemple : Cas de la
lampe à vapeur de mercure
-
On analyse à l’aide
du spectroscope la lumière émise par une lampe à vapeur de mercure.
-
La
lampe à vapeur de mercure contient des atomes (Hg)
de mercure sous faible pression.
-
Ces atomes
subissent des décharges électriques et sont excités.
-
Eux aussi subissent
des décharges électriques et sont excités.
-
Spectre de la lampe
à vapeur de mercure :
-
Les principales longueurs d’ondes (les plus visibles) :
-
615 nm, 568 nm, 546 nm, 542 nm, 436 nm,
405 nm.
-
Le spectre de cette lumière n'est pas continu.
-
On parle de spectre
de raies d’émission
-
Chaque spectre est
composé de raies colorées sur fond noir
-
Chaque raie colorée
correspond à une radiation émise par l’entité.
-
Conclusion :
-
Le spectre obtenu
est caractéristique des atomes du gaz qui émet les radiations.
-
Un spectre de raies
constitue la signature d’un élément chimique et révèle sa présence.
-
Il permet
d’identifier une entité chimique (atome ou ion).
II- La lumière et la
dualité onde-particule.
-
La lumière a une
nature ondulatoire.
-
On parle de l’onde
lumineuse.
-
L’onde lumineuse
résulte de la propagation d’une perturbation électromagnétique dans les milieux
transparents.
-
Les ondes
lumineuses périodiques sont appelées des radiations.
-
Contrairement aux
ondes mécaniques, la propagation des ondes lumineuses ne nécessite pas de
support matériel.
-
La lumière peut se
propager dans le vide.
-
La
lumière est une onde transversale : la direction de propagation est
perpendiculaire
à la direction de la perturbation.
-
L’onde lumineuse
résulte de la propagation simultanée d’une perturbation électrique et d’une
perturbation magnétique.
-
Dans le vide ou
dans les milieux transparents homogènes, la lumière se propage en ligne droite.
-
Une radiation
lumineuse est caractérisée par :
-
Sa
fréquence ν (en Hz) ou sa
période T (en s).
-
Sa longueur d’onde dans le vide
λ0.
-
Remarque :
-
La fréquence d’une
radiation lumineuse ne dépend pas du milieu de propagation alors que la longueur
d’onde dépend du milieu de propagation.
►
Relation
fondamentale :
|
|
λ0 :
longueur d’onde dans le vide (m) |
|
c :
vitesse de la lumière dans le vide (m . s–1) |
|
|
T :
période (s) |
|
|
ν :
fréquence (Hertz) |
-
Remarque : pour les
radiations lumineuses, on préfère utiliser la lettre grecque ‘’nu’’.
-
De manière
générale, on caractérise une radiation lumineuse par sa longueur d’onde dans le
vide.
-
Complément : l’œil
humain n’est sensible qu’à certaines radiations lumineuses.
b)-
Les domaines d’application.
-
Le domaine de
radiations lumineuses visibles s’étend de 400 nm (violet) à 780 nm (rouge).
-
Domaine de
fréquences correspondant :
400 nm ≤
λ ≤ 780 nm
-
Spectre des ondes
électromagnétiques :
-
Le spectre des
ondes électromagnétiques est découpé, de façon arbitraire, en divers domaines.
►
Les sources de
rayonnements :
-
Les corps célestes
émettent des rayonnements dans divers domaines de longueurs d’onde.
-
Il est possible de
caractériser certaines sources grâce aux types de rayonnements qu’elles
émettent.
-
Le document
suivant, donne des exemples de rayonnements dans divers domaines du spectre
électromagnétique.
-
On remarque que la
lumière visible ne représente qu’une infime partie du spectre électromagnétique.
-
Le rayonnement
cosmique : il est constitué par des astroparticules, telles que des protons, des
noyaux d’hélium, qui se propagent dans le vide interstellaire.
-
-
Les objets célestes
« chauds », tels que quasars, naines blanches, étoiles dites chaudes, émettent
une grande part de leur rayonnement dans le domaine de l’ultraviolet.
-
Les objets
« froids », comme les planètes, les étoiles jeunes, les nuages de poussières,
émettent principalement dans le domaine de l’infrarouge.
-
Les phénomènes de
diffraction et d’interférences de la lumière s’expliquent par ses propriétés
ondulatoires. (Chap. N° 03 Propriétés des Ondes.)
-
En 1900, Max Planck
fut conduit à postuler la quantification de l’énergie transportée par les ondes
électromagnétiques.
-
Il postule que
l’énergie électromagnétique ne peut s’échanger que par « paquets » ou quanta
d’énergie.
-
En 1905, Albert
Einstein émet l’idée que ces quanta d’énergie sont transportés par des
particules.
-
On parle de modèle
particulaire de la lumière.
-
En 1926, Gilbert
Newton invente le mot « photons pour nommer ces quanta.
-
Les photons sont
des particules de masse nulle et de charge nulle se propageant à la vitesse de
la lumière.
►
Énergie d’un photon :
-
L’énergie de la
lumière est transportée par des photons qui présentent un aspect particulaire et
un aspect ondulatoire.
-
L’énergie d’un
photon est donnée par la relation :
-
E = h
.
ν
-
L’énergie E représente
l’aspect particulaire du photon.
-
La fréquence
n
représente son aspect ondulatoire.
-
Pour une onde électromagnétique de fréquence
ν et de longueur d’onde
λ dans le vide,
-
On peut écrire :
|
Relation de Planck-Einstein :
|
|
La grandeur
h est la constante de Planck :
h = 6,626
× 10– 34
J . s |
|
La fréquence
ν
en hertz (Hz) La longueur
d’onde dans le vide λ en
mètre (m) |
|
La célérité de
la lumière dans le vide : c
= 3,00
× 108 m . s – 1 |
|
Énergie
E en joule (J) |
|
Cette relation met
en évidence le caractère à la fois :
-
Particulaire :
photon, particule de masse nulle et d’énergie
Ephoton.
-
Ondulatoire :
fréquence ν,
longueur d’onde λ.
-
On parle de dualité
onde-corpuscule. |
III- L’interaction
lumière-matière.
1)- Quantification de
l’énergie des atomes.
►
L’atome d’hydrogène :
-
Pour expliquer la
présence de raies d’émission de l’atome d’hydrogène, Niels Bohr propose un
modèle de structure de cet atome en introduisant la notion de niveau d’énergie.
-
Spectre d’émission
de l’atome d’hydrogène :
►
En 1913, BOHR énonce
les postulats suivants :
-
Les variations
d’énergie d’un atome sont quantifiées.
-
L’atome ne peut
exister que dans certains états d’énergie ou niveaux d’énergie bien définis.
- Un photon de fréquence ν est émis lorsque l’atome effectue une transition d’un niveau d’énergie Ep vers un niveau inférieur En tel que :
-
Ep
- En
= h .
ν
-
Il résulte de ceci
que les énergies d’un atome sont quantifiées.
-
Contrairement à l’énergie du système S
= {planète + satellite},
-
Dans
le cas de l’atome d’hydrogène : l’énergie du système
{proton + électron} ne peut prendre que certaines valeurs
discrètes.
-
Le modèle
planétaire de l’atome est à rejeter.
-
Ce qui est vrai
pour l’atome d’hydrogène est vrai aussi pour les autres atomes.
-
Ceci reste valable
pour les molécules qui sont des associations d’atomes.
-
Il en va de même
pour les noyaux des atomes.
-
C’est pour cette raison que lors de la désexcitation
d’un noyau, il y a émission d’un rayonnement γ.
-
L’énergie d‘un
atome est quantifiée, l’énergie d’une molécule est quantifiée et l’énergie d’un
noyau est quantifiée.
b)-
Diagramme de niveaux
d’énergie.
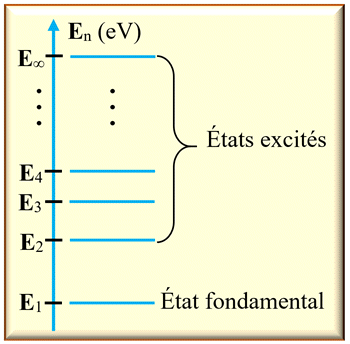
-
Sur le diagramme de
niveaux d’énergie d’un atome :
-
Le niveau d’énergie
le plus bas correspond à l’état stable de l’atome.
-
On l’appelle
l’état
fondamental
-
Les autres niveaux
correspondent à des états moins stables.
-
On les appelle
les états
excités.
-
L’état de plus
haute énergie correspond à la perte d’un électron : l’atome est dit ionisé.
-
Par convention, son
énergie est notée :
E∞ = 0 eV.
-
Comme les écarts
entre les niveaux d’énergie sont faibles, on utilise l’électron-volt :
-
1 eV
= 1,60 × 10–19 J
-
Remarque : Les
énergies des autres états sont négatives.
►
Schéma d’un diagramme
d’énergie d’un atome :
2)- Émission et absorption
de la lumière par un atome.
-
L’étude des spectres der raies d’émission et
d’absorption des atomes a permis aux physiciens de comprendre l’interaction
lumière-matière.
►
Exemple de l’atome
d’hydrogène :
-
Pour obtenir ce
spectre, on soumet de l’hydrogène à des décharges électriques dans une ampoule
-
Ce dispositif
fournit de l’énergie aux atomes d’hydrogène.
-
Les atomes gagnent
de l’énergie et se retrouvent dans un état excité instable.
-
Ils se désexcitent
spontanément pour retrouver un état plus stable et une énergie plus basse.
-
Au cours de cette
désexcitation, ils émettent de l’énergie lumineuse.
-
On observe un
spectre de raies et non un spectre continu.
-
Les fréquences des
radiations émises ne peuvent prendre que certaines valeurs particulières.
-
On dit que les
fréquences sont quantifiées.
-
Ce spectre de raies
est caractéristique de l’hydrogène, il permet de l’identifier.
-
Un atome
d’hydrogène ne peut prendre que certains niveaux d’énergie.
-
Spectre
d’émission :
-
Spectre
d’absorption :
-
Un atome absorbe
les radiations qu’il est capable d’émettre.
-
Au cours d’une
transition entre deux états d’énergie
Einitial
et Efinal le photon absorbé ou émis par un atome possède une énergie telle que :
|
|
|
La grandeur
h est la constante de Planck :
h = 6,626
× 10– 34
J . s |
|
La fréquence
ν en hertz (Hz) La longueur
d’onde dans le vide λ en
mètre (m) |
|
La célérité de
la lumière dans le vide : c
= 3,00 × 108
m . s– 1 |
|
Énergie
E et ΔE en
joule (J) |
b)-
Émission de la lumière par un
atome.
-
Dans ce cas,
Einitial >
Efinal
-
L’atome perd de
l’énergie en émettant un photon.
-
Sur un diagramme
d’énergie, on représente cette transition par une
flèche verticale
orienté vers le bas.
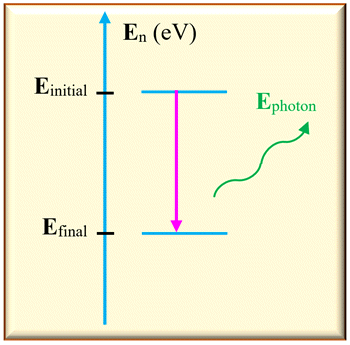
-
L’énergie libérée
est égale à la différence d’énergie entre les deux niveaux :
-
ΔE
= | Efinal –
Einitial
|
-
Cette énergie est
transportée par un photon :
-
Ephoton =
ΔE = |
Efinal
–
Einitial | =
h .
ν
-
La fréquence
ν
découle de la différence d’énergie
ΔE
= | Efinal –
Einitial
|
-
Si cette fréquence
appartient au domaine du visible, elle correspond alors à une raie colorée dans
le spectre d’émission de l’atome.
c)-
Absorption de la lumière par
un atome.
-
Dans ce cas,
Einitial <
Efinal
-
L’atome gagne de
l’énergie en absorbant un photon.
-
Sur un diagramme
d’énergie, on représente cette transition par une
flèche verticale
orienté vers le haut.
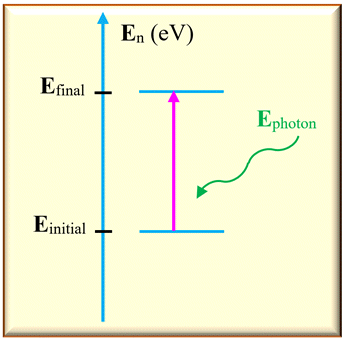
-
L’énergie absorbée
est égale à la différence d’énergie entre les deux niveaux :
-
ΔE
= | Efinal –
Einitial
|
-
Cette énergie est
transportée par un photon :
-
Ephoton =
ΔE = |
Efinal
–
Einitial | =
h .
ν
-
La fréquence
ν
découle de la différence d’énergie
ΔE
= | Efinal –
Einitial
|
-
L’absorption
d’énergie lumineuse par un atome ne peut se faire que si l’énergie du photon
permet une transition d’un niveau
Einitial à un niveau supérieur
Efinal
tel que :
-
Efinal –
Einitial
=
h
. ν
-
Si cette fréquence
ν
appartient au domaine du visible, elle correspond alors à une raie noire dans le
spectre de la lumière blanche.
-
Exemple spectre
d’émission et d’absorption de l’atome de sodium :
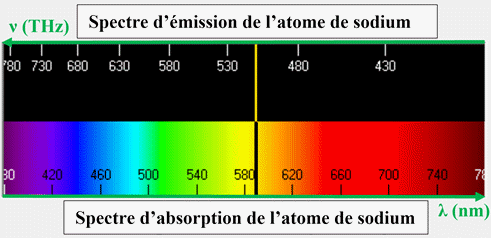
►
En conclusion :
-
Chaque entité
chimique possède son propre diagramme d’énergie.
-
Il est ainsi
possible d’identifier une entité chimique (atome, molécule ou ion) à partir de
son spectre d’émission ou d’absorption.
-
Les radiations
émises ou absorbées sont caractéristiques d’un atome car elles dépendent des
niveaux d’énergie de cet atome.
1)- L’origine des raies du
mercure.
-
La lumière émise
par une lampe à vapeur de mercure est une lumière polychromatique.
-
Certaines de ces
lampes sont utilisées comme lampe germicides car les radiations ultraviolettes
qu’elles émettent détruisent les germes pathogènes.
-
Lampe à vapeur de
mercure :

►
Spectres de la lampe à
vapeur de mercure :
-
Les principales
longueurs d’ondes (les plus visibles) :
-
615 nm, 568 nm, 546 nm, 542 nm, 436 nm,
405 nm.
►
Spectre d’émission du
mercure et intensité lumineuse en fonction de la longueur d’onde :
►
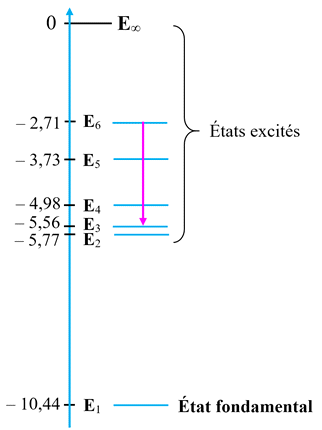
Diagramme de niveaux
d’énergie simplifié de l’atome de mercure :
-
Tableau : Longueurs
d’onde de quelques radiations émises par la lampe à vapeur de mercure :
|
Couleur |
Violet
Rouge 130
Vert 0
Bleu 200 |
Bleu
Rouge 17
Vert 0
Bleu 255 |
Vert
Rouge 143
Vert 255
Bleu 0 |
Vert
Rouge 150
Vert 255
Bleu 0 |
Vert/Jaune
Rouge 219
Vert 255
Bleu 0 |
Orange
Rouge 255
Vert 137
Bleu 0 |
|
λ
(nm) |
405 |
436 |
542 |
546 |
568 |
615 |
![]() Quelques questions :
Quelques questions :
-
Protocole
expérimental pour obtenir le spectre de la lumière émise par la lampe à vapeur
de mercure.
-
Vérifier que le
spectre obtenu est en accord avec les longueurs d’onde indiquées dans le
tableau.
- On étudie la transition du niveau d’énergie E6 au niveau d’énergie E3.
- Identifier dans le spectre d’émission la raie correspondante.
- La radiation émise par la lampe germicide a une longueur d’onde proche de 256 nm.
- Sachant que cette
radiation correspond à un retour à l’état fondamental de l’atome, de quelle
transition s’agit-il ?
►
Réponses :
-
Montage
expérimental :
►
Longueurs d’onde :
Exploitation graphique
-
Étude de la transition du niveau d’énergie
E6
au niveau d’énergie E3.
-
Dans ce cas,
Einitial = E6
< Efinal = E3
-
L’atome perd de
l’énergie en émettant un photon.
-
L’énergie libérée
est égale à la différence d’énergie entre les deux niveaux :
-
ΔE
= | Efinal –
Einitial
| = E6
– E3
-
Cette énergie est
transportée par un photon :
-
Ephoton =
ΔE = |
Efinal
–
Einitial | = E6
– E3
=
h
. ν63
-
La fréquence
ν63 découle de la différence d’énergie :
-
ΔE
= | Efinal –
Einitial
| = = E6
– E3
-
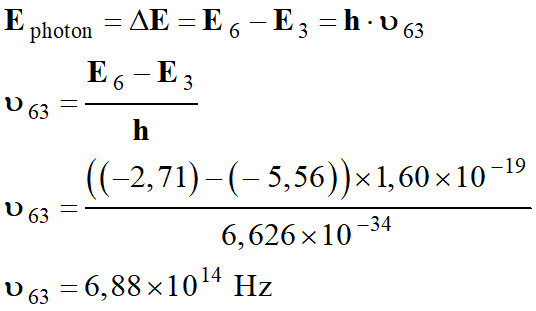
-
Longueur d’onde de
la radiation :
-
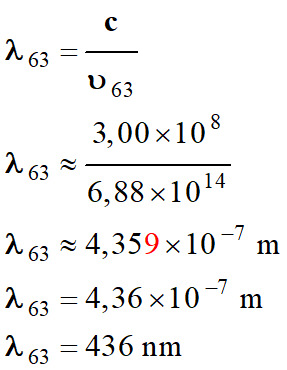
-
Il s’agit de la
radiation bleue : 
-
Transition qui donne la radiation de longueur
d’onde : λ
= 256 nm.
-
Au plus l’écart est
grand entre les niveaux d’énergie, au plus la fréquence est élevée et au plus la
longueur d’onde est petite.
►
Première méthode :
-
On peut essayer la
transition du niveau 6 au niveau 1 :
-
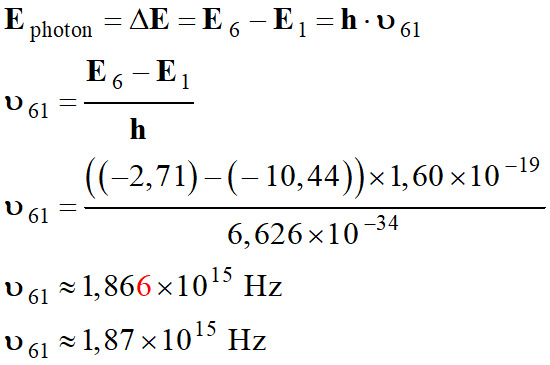
-
Longueur d’onde de
la radiation :
- 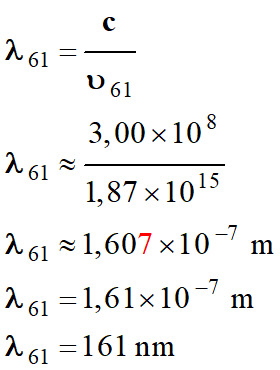
-
Il ne s’agit pas de
cette transition :
-
Transition du
niveau 5 au niveau 1 :
-
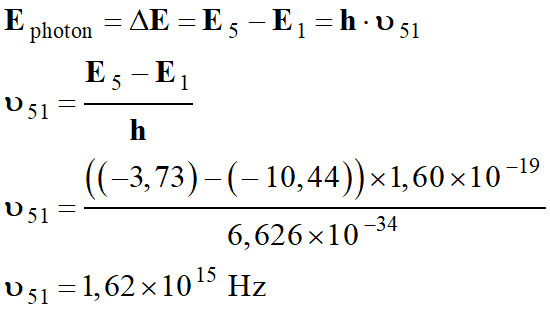
-
Longueur d’onde de
la radiation :
-
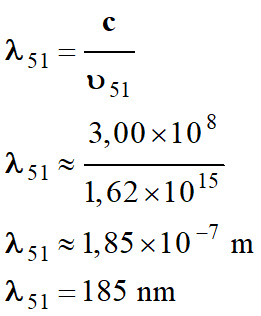
-
Il ne s’agit pas de
cette transition :
-
Transition du
niveau 4 au niveau 1 :
-
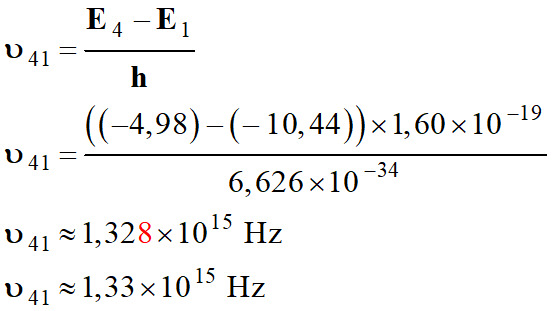
-
Longueur d’onde de
la radiation :
-
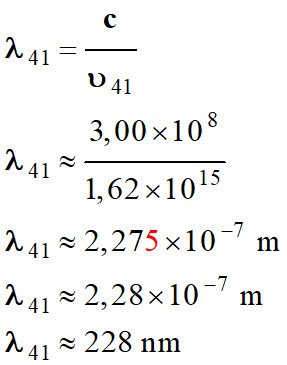
-
Il ne s’agit pas de
la transition du niveau 4 au niveau 1, mais on se rapproche.
-
Transition du
niveau 3 au niveau 1 :
-
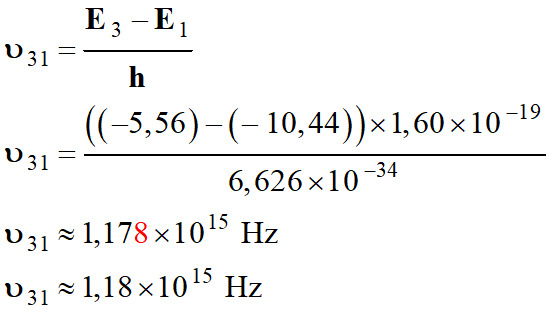
-
Longueur d’onde de
la radiation :
-
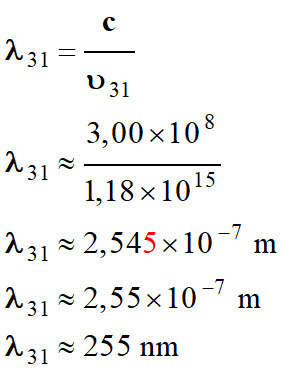
-
Il s’agit de la
transition du niveau 3 au niveau 1.
►
Autre méthode (plus
rapide) :
-
Soit
En le niveau d’énergie initial.
-
Le niveau final est
E1, le niveau fondamental.
-
On connait la
longueur d’onde de la radiation :
λn1
≈ 256 nm
-
Attention
à l’unité d’énergie : 1 eV = 1,60 × 10–19
J
-
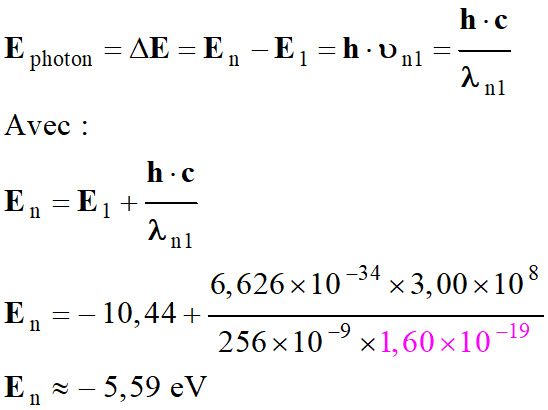
-
Il s’agit bien de
la transition du niveau 3 au niveau 1.
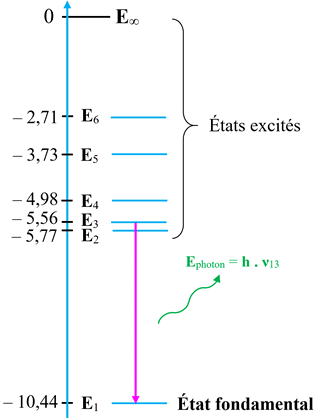
-
Cette radiation
appartient au domaine des U.V.
2)- DM : Le cas de l’atome
d’hydrogène.
|
L'atome d'hydrogène est constitué
d'un proton et d'un électron.
Les niveaux
d'énergie de l'atome sont donnés par la relation :
Le nombre,
n, est un nombre entier positif.
L'état de plus
basse énergie correspond à n
= 1, le premier état excité à
n = 2, etc.,
n =
∞ correspondant à l'état ionisé:
L'atome
d'hydrogène a perdu son électron et il se forme l'ion
H +. a)- Calculer la
valeur du niveau d'énergie E1 en (eV) de l’atome
d’hydrogène dans son état fondamental. b)- Représenter sur un diagramme en énergie les cinq premiers niveaux d'énergie (en eV). On prendra une échelle adaptée. c)- L'atome, initialement dans son état fondamental, absorbe un photon de fréquence ν = 2,91 × 1015 Hz. Calculer la valeur
du nombre n qui caractérise le niveau dans lequel
se trouve
l'atome après l'absorption du photon. d)- L'atome peut alors se désexciter par émission spontanée. Quelles sont les différentes transitions possibles a priori ? Calculer les longueurs d'onde des photons correspondants. Faire un schéma représentant les diverses transitions. Dans quel domaine du spectre électromagnétique
se situent ces radiations ?
-
Données :
-
e = 1,6 × 10– 19
C ;
c = 3,00 × 108
m . s–1
-
1 eV = 1,60 × 10–19
J ; h = 6,626 × 10– 34
J . s |
|
1)- Exercice 03 page 348 : Connaître la longueur d’onde
et la fréquence.
2)- Exercice 07 page 348 : Convertir des unités.
3)- Exercice 08 page 348 : Donner un ordre de grandeur.
4)- Exercice 09 page 349 : Calculer une énergie à partir
d’une fréquence.
5)- Exercice 11 page 349 : Identifier une transition
énergétique.
6)- Exercice 13 page 349 : Calculer une énergie à partir
d’un spectre.
7)- Exercice 14 page 349 : Déterminer la couleur d’une
raie.
8)- Exercice 15 page 349 : Exploiter une transition
énergétique.
9)- Exercice 16 page 349 : Utiliser un diagramme
d’énergie.
10)- Exercice 20 page 350 : Thermographie.
11)- Exercice 28 page 352 : Lumière d’une étoile : Véga.
12)- DS 01 : Le laser à Argon (50 min) : Exercice 28 page
353.
|
|
|