|
Lumière : Ondes et corpuscules |
|
|
|
|
|
|
QCM N°
18
Lumière :
Ondes et corpuscule.
La lumière et
la dualité onde corpuscule.
L’interaction
lumière-matière
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La vitesse de
la lumière
dans le vide
d’une onde
électromagnétique est : |
3,00 × 10–8
m . s–1 |
3,00 × 108
m . s–1 |
345 m . s–1 |
B |
|
2 |
La fréquence
ν et la
longueur
d’onde λ d’une
onde sont
liées par : |
|
|
|
BC |
|
3 |
Une
onde électromagnétique
de longueur
d’onde 586 nm
appartient au
domaine : |
Des
infrarouges |
Des
ultraviolets |
Du visible |
C |
|
4 |
Une onde
électromagnétique
de fréquence 109
Hz peut
être utilisée : |
Pour la
radiographie |
En
téléphonie |
En
radioactivité |
B |
|
5 |
L’énergie d’un
photon
s’exprime avec la
relation : |
|
|
|
AB |
|
6 |
L’énergie d’un
photon
peut s’exprimer
en : |
joule seconde
(J . s) |
joule
(J) |
Électronvolt
(eV) |
BC |
|
7 |
L’énergie d’un
photon
de longueur
d’onde
λ
= 450 nm est :
Données :
c
= 3,00 × 108 m . s–1
1 eV = 1,60 × 10–19 J
h
= 6,63 × 10–34 J . s |
4,42 × 10–19
J |
4,42 × 10–28
J |
4,42 × 10–18
J |
A |
|
8 |
La longueur
d’onde
d’un photon
d’énergie
E
= 4,67 eV est : |
405 nm |
266 nm |
681 nm |
B |
|
9 |
Les niveaux
d’énergie
d’un atome sont :
|
Continus |
Discontinus |
Quantifiés |
BC |
|
10 |
L’état de plus
basse
énergie est
appelé : |
État
excité |
État
fondamental |
État
ionisé |
B |
|
11 |
Au cours d’une
transition
du niveau
d’énergie Ep
au niveau
d’énergie En
telle que Ep
> En : |
Un photon
est émis |
Un photon
est absorbé |
Un photon est
émis et un
autre absorbé |
A |
|
12 |
Au cours d’une
transition
du niveau
d’énergie Ep
au niveau
d’énergie En,
un photon peut
être émis
ou absorbé avec
une
énergie Ephoton
égale à : |
Ephoton =
En + Ep |
Ephoton =
|En – Ep| |
Ephoton =
|Ep – En| |
BC |
|
13 |
Le spectre
suivant
est un spectre :
|
Continu |
D’émission |
D’absorption |
B |
|
14 |
Un spectre de
raies
d’émission : |
Permet de
caractériser
une entité
chimique |
Est
monochromatique |
Est constitué
d’une infinité
de radiations |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
La célérité de la lumière.
Déviation et dispersion de la lumière blanche par un
prisme :
La lumière émise par un laser.
L’onde électromagnétique.
Relation fondamentale :
|
|
λ0 :
longueur d’onde dans le vide (m) |
|
c :
vitesse de la lumière dans le vide (m . s–1) |
|
|
T :
période (s) |
|
|
ν :
fréquence (Hertz) |
Énergie d’un photon :
|
Relation de Planck-Einstein :
|
|
La grandeur h est la constante de Planck :
h = 6,626
× 10– 34
J . s |
|
La fréquence
n
en hertz (Hz)
La longueur
d’onde dans le vide λ en
mètre (m) |
|
La célérité de la lumière dans le vide :
c
= 3,00
× 108 m . s– 1 |
|
Énergie
E en joule (J) |
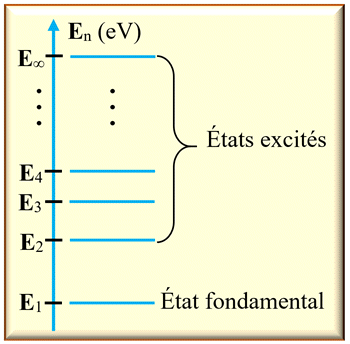
Diagramme de niveaux d’énergie.
►
Schéma d’un diagramme d’énergie d’un atome :
|
|
|
La grandeur
h est la constante de Planck :
h = 6,626 ×10 – 34
J . s |
|
La fréquence
n
en hertz (Hz)
La longueur
d’onde dans le vide λ en
mètre (m) |
|
La célérité de la
lumière dans le vide : c
= 3,00 × 108 m . s – 1 |
|
Énergie
E et ΔE en
joule (J) |
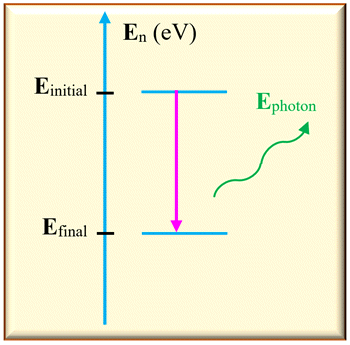
Émission de la lumière par un atome.
Absorption de la lumière par un atome.
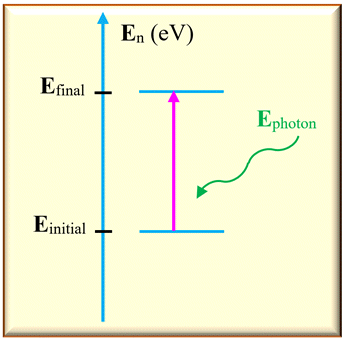
Diagramme d’énergie et entité chimique :
|
|