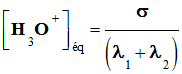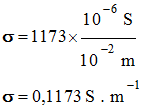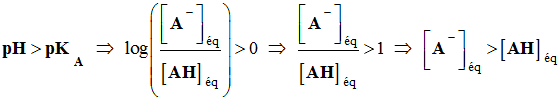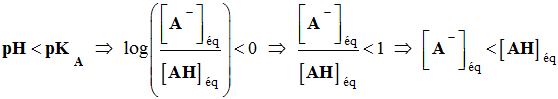|
Chap. N° 13 |
Réaction chimique par échange de proton. Cours. |
|
|
|
|
Exercices : énoncé avec correction a)- Exercice 8 page 340 : Utiliser la définition du pH. b)- Exercice 10 page 340 : Étudier un équilibre chimique. c)- Exercice 11 page 340 : Montrer qu’une réaction est totale. d)- Exercice 13 page 341 : Reconnaître deux couples acide / base. e)- Exercice 14 page 341 : étudier des réactions acido-basiques. f)- Exercice 16 page 341 : vérifier que l’autoprotolyse de l’eau est
une réaction très limitée. g)- Exercice 18 page 342 : Tracer un diagramme de prédominance. h)- Exercice 20 page 342 : Calculer le pH d’une solution d’acide
fort. i)-
Exercice 21page 342 : Calculer le pH d’une solution de base
forte. j)-
Exercice 24 page 342-343 : Mesure d’un pH et incertitudes. k)- Exercice 32 page 345 : Point isoélectrique de la glycine. |
I-
Définition et mesure du pH.
a)-
Introduction
-
Toutes les solutions aqueuses contiennent les ions
oxonium H3O+ (aq) et les
ions hydroxyde HO–.
- Comme la valeur de la concentration molaire [H3O+] peut varier entre quelques mol . L–1 et 10–14 mol . L–1,
- le chimiste danois SORENSEN proposa une
grandeur plus facile à manipuler, le pH (1909).
-
La notation pH est l’abréviation de « potentiel
d’Hydrogène ».
-
La molécule d’eau et l’ion oxonium :
|
La molécule d’eau |
l’ion oxonium |
|
α ≈
105 °
|
|
b)-
Définition :
|
Définition du pH : - Pour une solution aqueuse diluée, [H3O+] ≤ 0,05 mol . L–1, - Le pH est défini par : - pH = – log [H3O+] - Cette relation est équivalente à : - [H3O+]
= 10– pH mol
. L–1 |
►
Remarque :
-
Le pH est une grandeur sans unité.
-
La fonction « log »
représente la fonction logarithme décimal :
-
log 1 = 0, log 10 = 1, log 10 n = n.
-
[H3O+]
représente le nombre qui mesure la concentration en
mol . L–1.
-
La connaissance du pH permet de calculer la
concentration molaire en ions H3O+.
-
Exemple1 :
-
pH = 2,0 ;
-
[H3O+] = 10–
pH mol . L–1
-
[H3O+] = 1,0
× 10–
2 mol . L–1
-
Le pH augmente d’une unité lorsque la
concentration [H3O+] est divisée
par dix.
-
Échelle des pH :
-
Le pH d’une solution aqueuse diminue
lorsque la concentration en ion oxonium [H3O+]
augmente ↑.
-
Le pH d’une solution aqueuse augmente
lorsque la concentration en ion oxonium [H3O+]
diminue ↓.
a)-
Les indicateurs colorés et le papier pH.
-
Comme indicateurs colorés, on utilise, l'hélianthine, le
bleu de bromothymol et la phénolphtaléine.
-
L'utilisation des indicateurs colorés permet de
déterminer un encadrement de la valeur du pH d'une
solution.
-
Le papier pH est imbibé d'un mélange de plusieurs
indicateurs colorés, il peut donner une valeur du pH à
0,5 unité près.
b)-
Le pH-mètre.
-
Il est constitué d’une sonde de mesure reliée à un
voltmètre électronique.
- La sonde de mesure est constituée d’une électrode de verre et d’une électrode de référence
- Les deux électrodes
peuvent être combinées ou séparées.
-
La tension U qui apparaît aux bornes de la sonde
lorsqu’elle est plongée dans une solution aqueuse est une
fonction affine du pH :
-
U = a pH + b.
-
Les grandeurs a et b sont des coefficients
positifs qui dépendent de la température de la solution et de
l’état des électrodes.
-
Il est nécessaire d’étalonner le pH-mètre avant
toute mesure.
-
L’étalonnage du pH-mètre nécessite l’utilisation
de deux solutions étalons (solutions tampons) de pH
connu.
-
Mesure du pH :
-
Pour effectuer la mesure du pH d’une solution
aqueuse, la sonde doit être rincée à l’eau distillée, essuyée
puis plongée dans la solution étudiée.
-
Après agitation et stabilisation de la mesure, la valeur
du pH est relevée.



Montage permettant d'effectuer
un suivi pH-métrique
lors d'une réaction acido-basique.
(Exemple : on peut réaliser un
dosage pH-métrique)

c)-
Précision de la mesure.
-
Dans les conditions habituelles, au lycée, on peut
mesurer un pH, au mieux, à 0,05 unité près (le plus
souvent à 0,1 unité près).
|
Précision de la mesure :
|
-
Application 1 :
-
Déterminer la valeur de la concentration [H3O+]
sachant que le pH de la solution vaut : pH =
3,9 ;
-
[H3O+] = 10–
pH mol . L–1
-
[H3O+] = 10–
3,9 mol
. L–1
-
[H3O+]
≈ 1,3 × 10–4 mol
/ L.
a)-
Expérience :
![]() Dans une fiole jaugée de volume V = 500,0
mL, partiellement remplie d’eau distillée,
Dans une fiole jaugée de volume V = 500,0
mL, partiellement remplie d’eau distillée,
-
On verse avec précaution Vapp = 2,86 mL
(ou mapp = 3,00 g) d’acide éthanoïque ou
acétique de formule CH3COOH.
-
On mélange, puis on complète avec de l’eau distillée
jusqu’au trait de jauge et on mélange.
-
On donne :
-
Masse molaire de l’acide éthanoïque :
-
M = 60,05 g
/ mol, densité ; d = 1,05 ;
-
Masse volumique de l’eau µ
0 = 1,00 g / mL.
-
On verse un volume V1 = 40 mL de la
solution obtenue dans un bécher et on mesure le pH de
cette solution.
-
Le pH-mètre indique que le pH de la
solution est égal à 2,90.
-
Équation de la réaction :
|
CH3COOH (aq) + H2 O (ℓ) → CH3COO– (aq) + H3O+ (aq) |
b)-
Questions :
-
Déterminer la valeur de la concentration C1
en acide éthanoïque de la solution obtenue.
-
Reproduire et compléter le tableau d’avancement de la
réaction.
|
Équation |
CH3COOH
(aq) |
+ H2O
(ℓ) |
→ |
CH3COO–
(aq) |
+ H3O+ (aq) |
|
|
état |
Avancement
x
(mol) |
|||||
|
État initial (mol) |
0 |
C1
. V1 |
Solvant |
0 |
0 |
|
|
Au cours de la
transformation |
x |
…… |
Solvant |
…… |
…… |
|
|
Avancement
final |
xf |
…… |
Solvant |
…… |
…… |
|
|
Avancement
maximal |
xmax |
…… |
Solvant |
…… |
…… |
|
-
Déterminer la valeur de l’avancement maximal xmax
de la réaction.
-
Déterminer la valeur de l’avancement final, noté xf
à partir de la valeur du pH de la solution.
-
Comparer xmax et xf,
puis conclure.
c)-
Réponses :
-
Valeur de la concentration C1 en acide
éthanoïque de la solution obtenue :
- Quantité de matière initiale d’acide éthanoïque :
- C’est
la quantité de matière d’acide éthanoïque apporté.
-
Masse d’acide éthanoïque utilisé :
-
m = µ . V
-
Or, on connaît la densité de l’acide éthanoïque :
-

-
relation :
-
m = µ0 . d .V
-
Quantité de matière correspondante :
-
C’est la quantité de matière initiale d’acide
éthanoïque :
-

-
Valeur de la concentration C1
-

-
Tableau d’avancement de la réaction :
-
n1 = C1 . V1
≈ 1,00
× 10–1
× 40
× 10–3
-
n1 ≈ 4,0
× 10–3 mol
|
Équation
|
CH3COOH
(aq)
|
+ H2O
(ℓ) |
→ |
CH3COO
– (aq)
|
+ H3O
+(aq) |
|
|
état |
Avancement
x
(mol) |
mol |
mol |
|
mol |
mol |
|
État initial
(mol)
|
0 |
n1
= C1
. V1
n1
≈ 4,0 × 10–3
mol |
Solvant |
|
0 |
0 |
|
Au cours de la
transformation
|
x |
C1
. V1
– x |
Solvant |
x |
x |
|
|
Avancement
final |
xf |
C1
. V1
– xf |
Solvant |
xf |
xf |
|
|
Avancement
maximal |
xmax
|
C1
. V1
– xmax
= 0 |
Solvant |
|
xmax |
xmax |
-
L’avancement maximal xmax serait
atteint si l’acide éthanoïque était totalement consommé.
-
Dans ce cas :
-
C1 . V1 – xmax
= 0
-
xmax = C1 . V1≈
4,0
× 10–3 mol
-
Valeur de l’avancement final, noté xf à
partir de la valeur du pH de la solution :
-
D’après de tableau d’avancement de la réaction, on peut
écrire que :
-
xf = nf (H3O
+)
-
D’autre part : pH = 2,9 qui est équivalent à [H3O
+]f = 10–
pH mol . L–1
-
xf = nf (H3O +) = [H3O +]f . V1
-
xf ≈ 10–
2,9 ×
40 × 10–3
-
xf ≈ 5,0
× 10–5 mol
-
Conclusion :
-
On constate que xf <
xmax
-
La réaction entre l’acide éthanoïque et l’eau est
instantanée, mais n’est pas totale.
-
Le réactif limitant n’ayant pas totalement réagi, les
réactifs et les produits coexistent dans le mélange réactionnel
à l’état final.
2)- Notion d’équilibre chimique.
a)-
Réaction entre l’acide éthanoïque et l’eau : addition
d’un réactif.
![]() Addition d’acide éthanoïque pur à une solution
d’acide éthanoïque :
Addition d’acide éthanoïque pur à une solution
d’acide éthanoïque :
-
Dans un bécher A,
on verse 20 mL d’une solution d’acide éthanoïque de
concentration Ci
= 0,10 mol / L.
-
La mesure du pH
de cette solution donne pH
»
2,9.
-
On ajoute avec précaution quelques gouttes d’acide
éthanoïque pur.
-
Après agitation et stabilisation, le pH de la
solution vaut pHA
»
2,7.
-
En ajoutant quelques gouttes d’acide éthanoïque pur, on
constate une diminution de la valeur du
pH.
-
En conséquence la concentration en ion oxonium augmente.
-
On peut considérer que le volume de la solution n’a
pratiquement pas varié.
-
L’augmentation de la concentration en ions oxonium
provient de l’augmentation de la quantité de matière d’ions
oxonium.
-
Des ions oxonium se sont formés au cours de la réaction
chimique.
-
Le système a évolué dans le sens de la formation des ions
oxonium, c’est-à-dire dans le sens direct de l’équation de la
réaction.
|
CH3COOH
(aq)
+ H2O (ℓ) → CH3COO
–
(aq)
+ H3O + (aq) |
b)-
Réaction entre l’acide éthanoïque et l’eau : addition
d’un produit.
![]() Addition d’éthanoate de sodium dans une solution
d’acide éthanoïque
Addition d’éthanoate de sodium dans une solution
d’acide éthanoïque
-
Dans un bécher B,
on verse 20 mL d’une solution d’acide éthanoïque de
concentration Ci
= 0,10 mol / L.
-
La mesure du pH
de cette solution donne : pH
»
2,9.
-
On ajoute 0,5 g d’éthanoate de sodium solide dans le
bécher B.
-
Après agitation et stabilisation, le
pH de la solution
vaut pHB
»
5,3.
-
Lors de l’ajout de 0,5 g d’éthanoate de sodium, le pH
de la solution augmente, cela correspond à une diminution de la
concentration en ions oxonium.
-
Le volume n’ayant pratiquement pas varié, le système a
évolué dans le sens de la disparition des ions oxonium,
c’est-à-dire dans le sens inverse de l’équation de la réaction.
|
CH3COO–
(aq)
+ H3O + (aq)
→
CH3COOH (aq)
+ H2O (ℓ) |
c)-
Conclusion :
-
La réaction mise en jeu peut s’effectuer dans les deux
sens.
-
Pour l’écriture symbolique de cette réaction, on utilise
une double flèche  .
.
-
On écrit :
|
CH3COOH
(aq) + H2O (ℓ)
|
-
On indique ainsi que le système atteint un état
d’équilibre.
-
La double flèche
 traduit le fait que
les deux réactions sont simultanées et que le système peut
évoluer dans un sens ou dans l’autre.
traduit le fait que
les deux réactions sont simultanées et que le système peut
évoluer dans un sens ou dans l’autre.
- On est en présence d’un équilibre chimique dynamique.
- Les
deux réactions se produisent simultanément et annulent leurs
effets.
-
L’état final est un état d’équilibre entre les
différentes espèces chimiques.
d)-
Généralisation :
|
Equilibre chimique : - Un système chimique atteint un état d’équilibre lorsque, dans l’état final, les réactifs et les produits sont
simultanément présents. - L’équation de la réaction s’écrit alors avec une double
flèche qui traduit le fait que deux réactions, inverses l’une de l’autre, peuvent
se produire simultanément dans le système. |
III- Acide et base selon Bronsted.
1)- Notion d’acide et de base selon
Bronsted.
-
Un acide est une espèce chimique capable de céder au
moins un proton H
+.
-
On écrit : AH →
H
+ +
A –
-
Une base est une espèce chimique capable de capter au
moins un proton
-
On écrit : A
– + H
+
→ AH
-
Exemples :
-
HCl → H
+
+ Cl
–
-
CH3COOH
→
H
+
+ CH3COO
–
-
NH4+
→
H
+
+ NH3
-
L’espèce chimique A
– donne l’acide
AH en captant un proton
H
+.
-
On dit que A
– est la base conjuguée de l’acide
AH.
-
On parle du couple acide / base : AH / A–.
-
Exemples :
-
AH
 H
+
+ A
– couple
AH / A
–
H
+
+ A
– couple
AH / A
–
-
B + H
+
![]() BH
+ couple BH
+ / B
BH
+ couple BH
+ / B
-
Tableau de quelques couples acide / base
conjuguée :
|
Acide |
Base
conjuguée |
|
HCOOH Acide formique Acide
méthanoïque |
HCOO– Ion formiate Ion méthanoate |
|
CH3COOH Acide acétique Acide éthanoïque |
CH3COO– Ion acétate Ion éthanoate |
|
C6H5COOH Acide benzoïque
|
C6H5COO– Ion benzoate
|
|
(CO2,
H2O) Dioxyde de
carbone dissous dans
l’eau |
HCO3– Ion
hydrogénocarbonate |
|
NH4+ Ion ammonium |
NH3 Ammoniac |
|
H3O
+
Ion oxonium |
H2O
Eau |
|
H2O Eau |
HO–
Ion hydroxyde |
-
L’eau appartient à deux couples acido-basiques.
-
L’ion H3O
+ est l’acide du couple H3O
+ (aq) / H2O (ℓ)
-
L’ion HO – (aq)
est la base du couple H2O (ℓ) / HO
– (aq).
-
L’eau est la base du couple
H3O
+ (aq) / H2O (ℓ) et l’acide
du couple H2O (ℓ) / HO –
(aq).
-
On dit que l’eau est un ampholyte ou une espèce
amphotère.
4)- Réaction acido-basique et
transfert de proton.
-
Une réaction acido-basique consiste à un transfert d'un
proton entre l’acide À1H d’un couple
sur la base A2–
d’un autre couple.
-
Couple acide / base 1 : A1H
![]() H
+ + A1–
H
+ + A1–
-
Couple acide / base 2 : A2H
![]() H
+ + A2–
H
+ + A2–
-
Équation de la réaction :
-
On se place dans le cas où l’acide A1H
réagit sur la base A2–
-
A1H +
A2– →
A1–
+ A2H
-
cette
réaction met en jeu les couples acide / base suivants : A1H
/ A1–
et A2H / A2–.
-
Exemple : Réaction entre l’acide éthanoïque et l’eau :
-
Cette réaction met en jeu les couples suivants :
-
CH3COOH (aq) / CH3COO
– (aq) :
CH3COOH (aq) ![]() CH3COO
– (aq) + H+
CH3COO
– (aq) + H+
-
H3O
+ (aq) / H2O (ℓ) :
H3O
+ (aq)
 H2O
(ℓ) + H+
H2O
(ℓ) + H+
|
CH3COOH
(aq) |
|
|
|
CH3COO–
(aq) |
+ |
H+ |
(1) |
|
H2O
(ℓ) |
+ |
H+ |
|
H3O
+ (aq) |
|
|
(2) |
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO–
(aq) |
+ |
H3O
+ (aq) |
(1) + (2) |
-
La double flèche
 indique que la
réaction peut se produire dans les deux sens.
indique que la
réaction peut se produire dans les deux sens.
-
Un transfert de protons a lieu entre les deux couples
acide / base.
5)- Acide faible et base faible.
![]() Un
acide AH est faible si sa réaction avec l’eau n’est pas
totale.
Un
acide AH est faible si sa réaction avec l’eau n’est pas
totale.
|
AH (aq) |
+ |
H2O
(ℓ) |
|
A–
(aq) |
+ |
H3O
+ (aq) |
|
-
Exemple d’acides faibles :
-
L’acide éthanoïque, l’ion ammonium, les acides
carboxyliques de façon générale.
![]() Une
base A –
est faible si sa réaction avec l’eau n’est pas totale.
Une
base A –
est faible si sa réaction avec l’eau n’est pas totale.
|
A–
(aq) |
+ |
H2O
(ℓ) |
|
AH (aq) |
+ |
HO– (aq) |
|
-
Exemples de bases faibles :
-
L’ammoniac, les ions carboxylate, les amines sont des
bases faibles dans l’eau.
►
Cas des acides α-aminé :
-
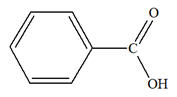
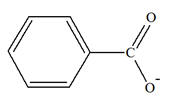
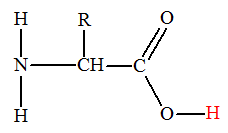
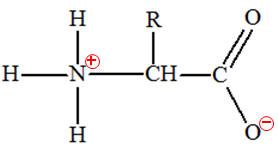
Un acide α-aminé contient les groupes caractéristiques
carboxyle – COOH et amine – NH2.
-
En solution aqueuse, un acide α-aminé existe
essentiellement sous forme d’ions dipolaires appelés amphions ou
zwitterions.
-
Un amphion résulte du transfert interne d’un proton H+
du groupe carboxyle vers le groupe amine de l’acide α-aminé.
-
On est en présence d’une réaction acido-basique
intramoléculaire.
|
|
|
|
|
|
Acide α-aminé |
|
|
amphion ou
zwitterion |
-
Remarque : l’amphion est un ampholyte comme la molécule
d’eau.
-
C’est l’acide du couple amphion / anion :
|
H3N+
– CHR – COO– (aq) |
|
|
|
H2N
– CHR – COO– (aq) |
+ |
H+ |
|
Amphion |
|
|
|
Anion |
|
|
-
C’est la base du couple cation / amphion :
|
H3N+
– CHR – COOH
(aq) |
|
|
|
H3N+
– CHR – COO– (aq) |
+ |
H+ |
|
Cation |
|
|
|
Amphion |
|
|
a)-
Valeur du pH de l'eau pure à 25° C.
-
Le pH de l'eau pure à 25° C est égal à 7,0.
-
pH = 7 => [H3O+]
≈ 1,0
x 10–7 mol
/ L
-
L'eau pure contient des ions oxonium.
b)-
Réaction d'ionisation de l'eau :
-
L'eau est électriquement neutre.
-
Comme elle contient des ions oxonium H3O+ chargés
positivement, elle contient obligatoirement des anions, les ions
hydroxyde HO–.
-
On peut écrire l'équation bilan suivante :
-
2 H2O (ℓ) → H3O+ (aq)
+ HO– (aq)
-
Cette réaction porte le nom d'Autoprotolyse de l'eau.
-
C'est une réaction limitée.
-
Seulement 2 molécules d'eau sur 550 millions participent
à la formation des ions :
-
Considérons 1,0 L d'eau pure à 25° C :
-
n (H2O) ≈ 55,6 mol
-
n (H3O+)
≈ 1,0 × 10–7 mol
-
n (OH–)
≈ 1,0 × 10–7 mol
-
Il existe une réaction inverse à la réaction
d'autoprotolyse de l'eau, c'est la réaction acido-basique :
-
H3O+ (aq)
+ HO–
(aq) → 2 H2O (ℓ)
- Il existe dans l'eau deux réactions inverses qui se produisent simultanément.
- Elles annulent mutuellement leurs effets.
- On arrive à un équilibre chimique dynamique.
-
2 H2O (ℓ)  H3O+ (aq)
+ HO– (aq)
H3O+ (aq)
+ HO– (aq)
-
sens
direct : autoprotolyse de l'eau : réaction limitée
-
sens
inverse : réaction acido-basique : réaction quasi-totale.
-
Dans l'eau pure, on trouve : une espèce majoritaire,
l'eau et des espèces ultra minoritaires, les ions oxonium et les
ions hydroxyde.
c)-
Produit ionique de l’eau à 25 ° C.
-
2 H2O (ℓ)  H3O+ (aq)
+ OH– (aq)
H3O+ (aq)
+ OH– (aq)
-
Cet équilibre chimique est caractérisé par une constante
d'équilibre Ke appelé produit ionique de
l'eau.
-
Ke = [H3O+]
éq. [OH–]
éq => Ke ≈ 1,0 x 10–14 ceci
pour toutes les solutions aqueuses à 25° C
-
Ke est un nombre qui n'a pas d'unité.
-
Les concentrations doivent être exprimées en mol . L–1.
-
Pour éviter l'emploi de l'exposant 10, on utilise une
échelle logarithmique, on pose :
-
pKe = – log Ke
=> pKe ≈ 14 à 25 °C soit Ke
= 10–pKe
-
remarque :
Le produit ionique de l'eau varie de manière sensible avec la
température.
-
Tableau :
|
Température en °
C |
pKe |
|
0° |
14,96 |
|
25° |
14,00 |
|
40° |
13,53 |
|
60° |
13,02 |
|
80° |
12,6 |
|
100° |
12,26 |
d)-
Application :
-
Le pH d'une solution A à 25° C est égal à
2,0. Que peut-on déduire de cette valeur ?
-
pH = 2,0
-
Par définition :
-
pH = - log [H3O+]éq
cette relation est équivalente à [H3O+]
éq = 10–
pH mol . L–1
-
[H3O+] éq = 10–
2,0 mol
. L–1
-
[H3O+]
éq ≈ 1,0 × 10–2 mol
. L–1.
-
D'autre part :
-
Ke
= [H3O+]
éq . [OH–]
éq ≈
1,0 × 10–14
=>
[OH–]
éq = 10pH
– pKe mol . L–1
-
[OH–]
éq = 102
– 14 mol . L–1
-
[OH–]
éq ≈ 1,0
× 10–12 mol
. L–1
2)- Solutions neutre, acide,
basique.
a)-
Solution neutre :
-
Une solution neutre contient autant d'ions oxonium que
d'ions hydroxyde.
-
[H3O+]éq
= [OH–]
éq
=>
[H3O+]
éq 2 =
Ke
=>
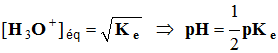
-
À 25° C, pKe = 14 et pH = 7
pour les solutions neutres.
b)-
Solution acide :
-
Elle contient plus d'ions oxonium que d'ions hydroxyde.
-
À 25° C, pKe = 14 et pH < 7
pour les solutions acides.
c)-
Solution basique :
-
Elle contient plus d'ions hydroxyde que d'ions hydronium.
-
À 25° C, pKe = 14 et pH > 7
pour les solutions basiques.
3)- Constante d’acidité KA
et pKA.
a)-
Définition :
-
On considère l’acide AH (aq), de couple AH
(aq) / A –
(aq), qui réagit avec l’eau selon l’équation :
|
AH (aq) |
+ |
H2O
(ℓ) |
|
A–
(aq) |
+ |
H3O+ (aq) |
|
-
La constante d’acidité KA du couple
AH (aq) / A –
(aq) est la valeur numérique du quotient suivant :
-
On écrit :
-

-
Par définition : pKA = – log KA,
soit KA = 10–
pKA
b)-
Application : Détermination de la constante d’acidité
d’un couple AH (aq) / A
– (aq) par conductimétrie.
►
Questions :
|
On mesure la conductivité σ d’une solution aqueuse S d’acide méthanoïque HCOOH (aq) de
concentration molaire en soluté apporté C =
5,0 × 10–2 mol . L–1. La valeur de la conductivité de
la solution aqueuse S d’acide méthanoïque
vaut σ = 1 173 μS · cm–1. -
Couples acide / base mis en jeu. -
HCOOH (aq) / HCOO–
(aq) -
H3O
+ (aq) / H2O (ℓ) -
Conductivités ioniques molaires : -
λ1 = λ (HCOO–)
= 5,46
× 10–3 S . m2 . mol–1. -
λ 2 = λ (H3O+) = 35,0
× 10–3 S . m2 . mol–1. -
λ 3 = λ (HO–)
= 1,99
× 10–3 S . m2 . mol–1.
dans l’état d’équilibre en fonction de n0
et n (H3O+)éq.
- Cette valeur est-elle en
accord avec le résultat trouvé précédemment ? |
||||||||||||||||||||||||||||||||||||||||
►
Réponses :
|
-
Équation de la réaction entre l’acide
méthanoïque et l’eau :
-
Tableau d’avancement de la réaction :
-
Relation entre les quantités d’ions n
(HCOO–)éq et n (H3O+)éq dans l’état
d’équilibre : -
n (HCOO–)éq
et n (H3O+)éq = xf -
Relation entre les concentrations [HCOO–]
éq et [H3O+] éq dans l’état
d’équilibre. -
-
Expression la conductivité σ en
fonction des concentrations des ions dans l’état
d’équilibre et des conductivités ioniques molaires. -
σ = λ (H3O+) . [H3O+] éq + λ
(HCOO–) . [HCOO–]
éq -
σ = λ2 . [H3O+] éq + λ1
. [HCOO–] éq -
σ = (λ2 +
λ1) . [H3O+] éq -
Unités : σ (S . m–1), λ2
(S . m2 . mol–1), λ1
(S . m2 . mol–1), [H3O+] éq (mol . m–3) -
Expression de la concentration [H3O+] éq et les unités de
chacune des grandeurs. -
-
Unités : σ (S . m–1), λ2
(S . m2 . mol–1), λ1
(S . m2 . mol–1), [H3O+] éq (mol . m–3) -
Valeur de la concentration [H3O+] éq en mol . m–3
puis la convertir en mol . L–1. -
Il faut convertir la valeur de la
conductivité σ = 1 173 μS · cm–1
en S · m–1 -
-
-
[H3O+] éq ≈ 2,90
× 10–3 mol . L–1. -
Valeur de la concentration [HCOO–]
éq en mol . L–1. -
[HCOO–] éq = [H3O+] éq ≈
2,90
× 10–3 mol . L–1 -
Expression la constante d’acidité KA
associée au couple HCOOH (aq) / HCOO–
(aq). -
-
Expression de la quantité d’acide méthanoïque
n (HCOOH)éq dans l’état
d’équilibre en fonction de n0 et
n (H3O+)éq. -
À partir du tableau d’avancement de la
réaction, on peut écrire : -
n (HCOOH)éq = n0
– xf -
n (HCOOH)éq = n0
– n (H3O+)éq -
Relation entre les concentrations [HCOOH]
éq, C et de [H3O+] éq. -
-
Valeur de de KA pour le
couple étudié. -
-
La valeur trouvée est en accord avec la
valeur donnée dans les tables. |
|||||||||||||||||||||||||||||||||||||||||||||||
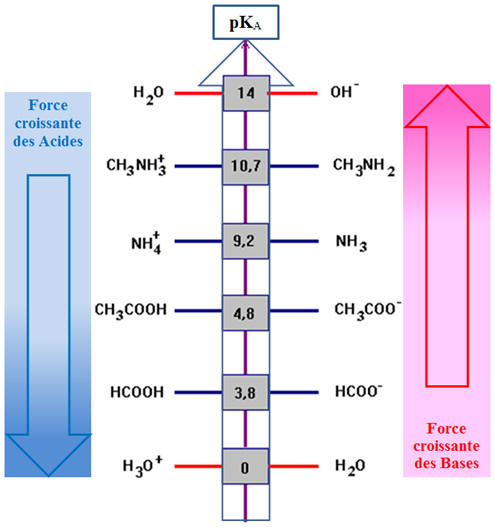
4)- Échelle des pKA
dans l’eau.
-
Valeurs des pKA pour quelques couples
acide / base dans l’eau.
►
Remarques :
-
Pour une même concentration en soluté apporté :
-
Un acide est d’autant plus fort qu’il cède facilement un
proton et donc que son pKA du couple auquel il
appartient est petit ou que son KA est
grand.
-
Une base est d’autant plus forte qu’elle capte facilement
un proton et donc que son pKA du couple auquel
elle appartient est grand ou son KA est
petit.
-
En solution aqueuse, l’acide le plus fort est l’ion
oxonium H3O+ (aq) et la base
la plus forte l’ion hydroxyde HO– (aq).
-
Exploitation de l’échelle des pKA :
-
L’acide éthanoïque (pKA = 4,8) est
situé au –dessus de l’acide méthanoïque (pKA =
3,8)
-
L’acide méthanoïque HCOOH (aq) est un acide plus
fort que l’acide éthanoïque CH3COOH
(aq).
-
En revanche, l’ion éthanoate CH3COO–
(aq) (base conjuguée de l’acide éthanoïque) est une base
plus forte que l’ion méthanoate HCOO– (aq)
(base conjuguée de l’acide méthanoïque).
-
Étude du couple AH (aq) / A–
(aq) :
-
À ce couple est associée la réaction suivante :
|
AH (aq) |
+ |
H2O
(ℓ) |
|
A–
(aq) |
+ |
H3O+ (aq) |
-
On associe à cette réaction une constante d’acidité :
-

-
En utilisant pKA = – log KA
-
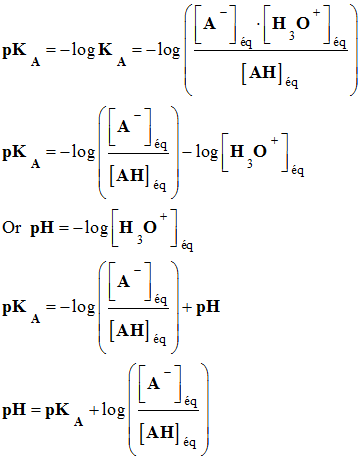
-
La relation :
-

-
Permet de considérer trois cas :
►
Premier cas :
-
L'acide et la base conjuguée ont la même concentration.
►
Deuxième cas :
-
La base A–
est l'espèce prédominante
►
Troisième cas :
-
L’acide AH
est l’espèce prédominante.
-
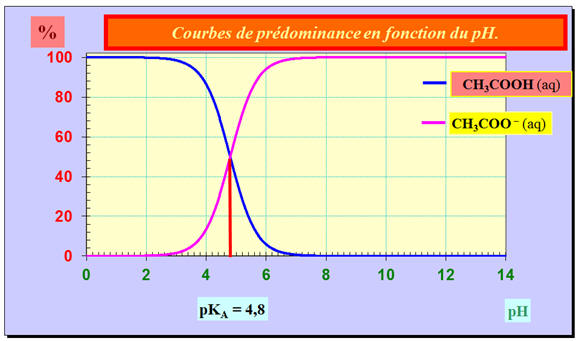
Exemple : couple CH3COOH
(aq) / CH3COO
– (aq).
-
représentation
sur un axe horizontal : couple
AH /
A –.
6)- Contrôle du pH, solution
tampon.
-
Une solution tampon est une solution dont le pH
varie faiblement lors de l’addition modérée :
-
D’un acide,
-
D’une base,
-
Ou par une dilution modérée.
-
Une telle solution contient un acide faible et sa base
conjuguée en concentrations voisines.
-
Le pH d’une telle solution est voisin du pKA
du couple acide / base considéré.
-
Prévoir une application :
V-
Acide fort et base forte dans l’eau.
a)-
Définition d’un acide fort :
![]() Un
acide AH est fort dans l’eau si sa réaction avec l’eau
est totale.
Un
acide AH est fort dans l’eau si sa réaction avec l’eau
est totale.
-
L’équation de cette réaction s’écrit alors avec une
simple flèche :
|
AH
(aq) |
+ |
H2O
(ℓ) |
→ |
A–
(aq) |
+ |
H3O+
(aq) |
-
Le pH d’une solution diluée d’acide fort, de
concentration C en soluté apporté, est :
|
pH = –
log C |
Valable pour
10–2
mol . L–1 ≤ C ≤ 10–6
mol . L–1 |
-
Exemples :
-
Le chlorure d’hydrogène est un acide fort dans l’eau.
|
HCℓ (g) |
+ |
H2O
(ℓ) |
→ |
Cℓ–
(aq) |
+ |
H3O+ (aq) |
-
Tableau :
|
Concentration |
C mol / L |
10–1 |
10–2 |
10–3 |
10–4 |
10–5 |
10–6 |
10–7 |
10–8 |
|
Acide chlorhydrique |
pH |
1,1 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
6,79 |
6,98 |
|
|
– log C |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
-
Formule de l’acide chlorhydrique : {H3O
+ (aq) + Cℓ
– (aq)} (solution aqueuse de chlorure
d’hydrogène)
-
Application :
- On dissout n = 1,0 × 10–2 mol de chlorure d’hydrogène HCℓ (g) dans un litre d’eau.
- Quel
est le pH de la solution obtenue ?
-
Le chlorure d ‘hydrogène est une acide fort.
-
La concentration en soluté apporté : C = 1,0
× 10–2 mol
. L–1.
-
pH = – log C
-
pH ≈ – log 1,0
× 10–2
-
pH ≈ 2,0.
b)-
Définition d’une base forte :
![]() Une
base A– est forte dans l’eau si sa réaction
avec l’eau est totale.
Une
base A– est forte dans l’eau si sa réaction
avec l’eau est totale.
-
L’équation de cette réaction s’écrit alors avec une
simple flèche :
|
A
–
(aq) |
+ |
H2O
(ℓ) |
→ |
AH
(aq) |
+ |
HO
–
(aq) |
-
Le pH d’une solution diluée de base forte, de
concentration C en soluté apporté, est :
|
pH = 14 +
log C |
Valable pour
10–2
mol . L–1 ≤ C ≤ 10–6
mol . L–1 |
-
Exemples de bases fortes :
-
La solution aqueuse d’hydroxyde de sodium ou soude, la
solution aqueuse d’hydroxyde de potassium, l’ion éthanolate en
solution aqueuse.
-
Donner les équations bilans des réactions de ces bases
avec l’eau.
-
Solution aqueuse d’hydroxyde de sodium :
NaOH (s) +
H2O
(ℓ) → (Na+,
H2O)
(aq) +
OH– (aq)
-
Cela revient à la dissolution d’un composé ionique dans
l’eau que l’on peut écrire plus simplement :
|
|
Eau |
|
|
|
|
NaOH (s) |
→ |
Na+
(aq) |
+ |
HO
–
(aq) |
-
formule de
la soude : {Na+ (aq)
+ HO– (aq)}
(solution aqueuse d’hydroxyde de sodium)
-
Solution aqueuse d’hydroxyde de potassium :
|
|
Eau |
|
|
|
|
KOH (s) |
→ |
K+
(aq) |
+ |
HO
–
(aq) |
-
L’ion éthanolate en solution aqueuse :
|
CH3CH2O– (aq)
+ H2O (ℓ) |
→ |
CH3CH2OH
(aq) + OH– (aq) |
c)-
Remarque :
-
Dans l'eau, il n'existe pas d'acide plus fort que
H3O+ (aq) et de base plus forte que
HO
– (aq).
-
On dit que l'eau a un effet nivelant.
2)- Réaction entre un acide fort et
une base forte.
-
L’équation d’un acide fort avec une base forte s’écrit :
|
H3O+
(aq) |
+ |
HO
–
(aq) |
→ |
2 H2O
(ℓ) |
-
C’est la réaction inverse de l’autoprotolyse de l’eau.
-
La réaction d’autoprotolyse de l’eau est très limitée
dans le sens direct (Seulement 2 molécules d'eau sur 556
millions participent à la formation des ions).
-
Alors que la réaction acido-basique est très avancée dans
le sens direct.
-
On la considère comme totale (quasi-totale) et peut
s’écrire avec une flèche.
-
Remarque :
-
La réaction entre un acide fort et une base forte libère
de l’énergie thermique et s’accompagne d’une élévation de
température du mélange réactionnel.
-
L’énergie thermique libérée par la réaction est d’autant
plus grande que les quantités de matière mises en jeu sont
importantes.
2)- Exercices :
a)-
Exercice 8 page 340 : Utiliser la définition du pH.
b)-
Exercice 10 page 340 : Étudier un équilibre chimique.
c)-
Exercice 11 page 340 : Montrer qu’une réaction est
totale.
d)-
Exercice 13 page 341 : Reconnaître deux couples acide /
base.
e)-
Exercice 14 page 341 : étudier des réactions
acido-basiques.
f)-
Exercice 16 page 341 : vérifier que l’autoprotolyse de
l’eau est une réaction très limitée.
g)-
Exercice 18 page 342 : Tracer un diagramme de
prédominance.
h)-
Exercice 20 page 342 : Calculer le pH d’une
solution d’acide fort.
i)-
Exercice 21page 342 : Calculer le pH d’une
solution de base forte.
j)-
Exercice 24 page 342-343 : Mesure d’un pH et
incertitudes.
k)-
Exercice 32 page 345 : Point isoélectrique de la glycine.
|
|