|
Chap. N° 13 |
Réactions chimiques par échange de protons. Exercices. |
|
|
|
I- Exercice 8 page 340 : Utiliser la définition du pH.
|
1)-
Rappeler les expressions permettant de calculer :
-
Le pH à partir
de la concentration [H3O+] ;
-
La concentration [H3O+] à
partir du pH. 2)-
On dispose de quatre solution A, B,
C et D telles que :
- Recopier puis compléter le tableau. 3)-
Comment varie la concentration [H3O+]
lorsque le pH augmente ? |
|
1)-
Expressions permettant de calculer :
-
Le pH à partir
de la concentration [H3O+] :
pH = – log [H3O+]
-
La concentration [H3O+] à
partir du pH : [H3O+]
= 10–
pH mol
. L–1
-
Ceci pour une
solution aqueuse diluée, [H3O+]
≤ 0,05 mol . L–1 2)-
Tableau complété :
3)-
Variation de la concentration en [H3O+] :
-
Lorsque le
pH
augmente ↑, la
concentration [H3O+]
diminue ↓. |
II- Exercice 10 page 340 : Étudier un équilibre chimique.
|
Pour se défendre, les fourmis utilisent deux moyens : Leurs
mandibules, qui immobilisent l’ennemi, et la
projection d’acide formique qui provoque des
brûlures. L’acide formique, ou acide méthanoïque, HCOOH, donne lieu à un équilibre chimique avec l’eau. L’équation de
la réaction, associée à cet équilibre est :
Le pH d’une solution d’acide formique de volume V = 50,0 mL et de concentration molaire apportée
C = 1,0
× 10–3 mol . L–1
vaut 3,5. 1)-
Établir le tableau d’avancement de la réaction. 2)-
Déterminer l’avancement maximal xmax. 3)-
Calculer l’avancement final xf
de la
réaction. 4)-
Comparer xf et xmax.
Conclure. 5)-
Calculer les quantités de matières des espèces
chimiques dans l’état d’équilibre final. |
|
1)-
Tableau d’avancement de la réaction.
2)-
Avancement maximal xmax. - L’eau étant le solvant, elle est en large excès.
- L’acide
méthanoïque est le réactif limitant.
-
n – xmax
= 0
-
xmax
= n ≈
5,0
×
10–5 mol 3)-
Avancement final xf de la
réaction.
-
D’après le tableau
d’avancement de la réaction : xf =
néq (H3O+)
-
On connaît la valeur
du pH de la solution :
-
pH = 3,5
-
Par définition :
-
pH
= - log [H3O+]éq cette relation est équivalente à [H3O+]
éq = 10– pH mol . L–1
-
[H3O+]
éq = 10–
3,5 mol
. L–1
-
Avec : néq
(H3O
+) = [H3O+]
éq . V
-
xf
= néq (H3O
+) = [H3O+]
éq . V ≈ 10–
3,5 .
50,0
×
10–3 mol
-
xf
≈ 1,6
×
10–5 mol 4)-
Comparaison xf et xmax
et conclusion : - xf < xmax, la réaction n’est pas totale, elle est limitée. - On atteint un équilibre chimique. - L’acide méthanoïque n’est pas totalement dissocié dans l’eau :
- C’est un
acide faible. 5)-
Quantités de matières des espèces chimiques dans
l’état d’équilibre final.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
III- Exercice 11 page 340 : Montrer qu’une réaction est totale.
|
Une solution aqueuse S d’acide bromhydrique est obtenue en faisant réagir du bromure d’hydrogène avec de l’eau, selon la
réaction d’équation :
Le pH de la solution S, sa concentration molaire C en soluté apporté et son
volume V valent respectivement :
-
pH = 2,6 ;
C = 2,51
× 10–3 mol
. L–1 et V = 50,0 mL. 1)-
Établir le tableau d’avancement de la réaction. 2)-
Calculer l’avancement maximal xmax,
puis l’avancement final xf de la
réaction. 3)- La réaction étudiée est-elle totale ? Comment cela
se traduit-il dans l’écriture de l’équation de la
réaction. |
|
1)-
Tableau d’avancement de la réaction.
2)-
Avancement maximal xmax et
avancement final xf de la
réaction.
-
Avancement final :
-
L’eau étant le
solvant, elle est en large excès. L’acide
bromhydrique est
le réactif limitant.
-
n – xmax
= 0
-
xmax
= n ≈
1,26
×
10–4 mol ≈ 1,3
×
10–4 mol (si on garde deux chiffres
significatifs)
-
Avancement final :
-
On connaît la valeur
du pH de la solution :
-
pH = 2,6
-
Par définition :
-
pH
= - log [H3O+]éq
cette relation est équivalente à [H3O+]
éq = 10–
pH mol
. L–1
-
[H3O+]
éq = 10–
2,6 mol
. L–1
-
Avec : néq
(H3O
+) = [H3O+]
éq . V
-
xf
= néq (H3O
+) = [H3O+]
éq . V ≈ 10–
2,6 ×
50,0
×
10–3 mol
-
xf
≈ 1,3
× 10–4 mol - Comme la quantité de matière a été déterminée à partir d’une valeur de pH,
- on ne peut donner le résultat
qu’avec deux chiffres significatifs.
-
On remarque que xmax
≈ xf. 3)-
Réaction totale.
-
xmax
= n ≈
1,26
×
10–4 mol ≈ 1,3
×
10–4 mol (si on garde deux chiffres
significatifs)
-
xf
≈ 1,3
× 10–4 mol
-
La réaction est
totale car xmax
= xf
(au nombre
de chiffres significatifs près)
-
La molécule de
bromure d’hydrogène n’existe pas en solution
aqueuse.
-
La réaction entre le
bromure d’hydrogène et l’eau s’écrit avec une flèche
dans le sens direct.
-
Remarque : on est en
présence d’un acide fort : pH = – log C,
avec
10 –2
mol . L–1 ≤ C ≤ 10
–6
mol . L–1
|
|||||||||||||||||||||||||||||||||||||||||
IV- Exercice 13 page 341 : Reconnaître deux couples acide / base.
1)-
Identifier les deux couples acide / base associés à
la réaction. 2)-
L’aniline est-elle un acide faible ou une base
faible dans l’eau ? 3)-
Montrer que la réaction acido-basique précédente
s’interprète comme l’échange d’un proton entre deux
espèces appartenant à deux couples acide / base
différents. |
|
1)-
Identification les deux couples acide / base
associés à la réaction.
-
Couples (1) : H2O
(ℓ) / HO
– (aq)
-
Couples (2) :
C6H5NH3+
(aq) /
C6H5NH2
(aq) 2)-
L’aniline une base faible dans l’eau :
-
D’après l’équation
donnée, on remarque qu’il y a une double flèche : - Cela indique que la réaction entre l’aniline est l’eau n’est pas totale.
- On est en présence d’un équilibre chimique.
-
De plus la réaction
donne des ions hydroxyde
HO
– (aq).
-
L’aniline est une
base faible dans l’eau.
-
Formule de
l’aniline :
3)-
Étude de la réaction acido-basique :
|
V- Exercice 14 page 341 : étudier des réactions acido-basiques.
|
Un comprimé effervescent contient entre autres, de l’acide acétylsalicylique (ou aspirine), C9H8O4, et de l’hydrogénocarbonate de sodium,
NaHCO3. L’aspirine C9H8O4 (aq), est un acide faible dans l’eau et l’ion
hydrogénocarbonate,
HCO3–
(aq), est une base faible dans l’eau. 1)-
Écrire l’équation de la réaction qui se produit
entre l’aspirine et l’eau. 2)-
Écrire l’équation de dissolution de
l’hydrogénocarbonate de sodium dans l’eau, en la
considérant comme totale. 3)- L’acide conjugué de l’ion hydrogénocarbonate HCO3– (aq) est le dioxyde de carbone dissous CO2, H2O (aq). Écrire l’équation
de la réaction qui se produit entre l’ion
hydrogénocarbonate et l’aspirine. 4)-
Justifier l’effervescence observée lors de la
dissolution du comprimé dans l’eau. |
|
Pour aller plus loin :
Formulation et dosage de l’Aspirine. Effet Tampon 1)-
Équation de la réaction qui se produit entre
l’aspirine et l’eau.
-
L’aspirine est un
acide faible dans l’eau. On arrive à un équilibre
chimique (double flèche).
2)-
Équation de dissolution de l’hydrogénocarbonate de
sodium dans l’eau, en la considérant comme totale.
-
Réaction totale : une
simple flèche dans le sens direct.
3)-
Équation de la réaction qui se produit entre l’ion
hydrogénocarbonate et l’aspirine.
4)-
Effervescence observée lors de la dissolution du
comprimé dans l’eau.
-
En milieu acide, les
ions hydrogénocarbonate se transforment en dioxyde
de carbone.
-
La solubilité du
dioxyde de carbone dans l’eau à 25 °C est de l’ordre
de 0,1 mol / L.
-
La limite de
solubilité est très vite atteinte et on observe un
dégagement gazeux de dioxyde de carbone. Pour aller plus loin :
Formulation et dosage de l’Aspirine. Effet Tampon
|
VI- Exercice 16 page 341 : vérifier que l’autoprotolyse de l’eau est
une réaction très limitée.
|
La réaction d’autoprotolyse de l’eau a lieu dans toute solution aqueuse et notamment dans l’eau pure. Des mesures
précises réalisées en laboratoire ont montré qu’à 25
° C le pH
de l’eau pure est égal à 7,0. On considère un volume
V = 1,0
L d’eau pure à 25 ° C. 1)-
Reproduire et compléter le tableau d’avancement
ci-dessous, associé à la réaction d’autoprotolyse de
l’eau :
2)-
Calculer la quantité de matière initiale d’eau notée
n0. 3)-
Calculer la valeur de l’avancement maximal xmax. 4)-
Déduire du pH, la valeur de l’avancement
final xf. 5)-
Comparer xf
et xmax. Conclure.
-
Donnée : masse
volumique de l’eau μeau = 1000 g .
L–1. |
||||||||||||||||||||||||||||
|
1)-
Tableau d’avancement :
2)-
Quantité de matière initiale d’eau notée n0.
-
3)-
Valeur de l’avancement maximal xmax.
-
L’avancement total
est atteint lorsque l’eau a été totalement
consommée :
-
4)-
Valeur de l’avancement final
xf.
-
On connaît la valeur
du pH de la solution :
-
pH = 7,0
-
Par définition :
-
pH
= - log [H3O+]éq
cette relation est équivalente à [H3O+]
éq = 10–
pH mol
. L–1
-
[H3O+]
éq = 10–
7,0 mol
. L–1
-
Avec : néq
(H3O
+) = [H3O+]
éq . V
-
xf
= néq (H3O
+) = [H3O+]
éq . V ≈ 10–
7,0 ×
1,0
mol
-
xf
≈ 1,0
× 10–7 mol - Comme la quantité de matière a été déterminée à partir d’une valeur de pH,
- On ne peut donner le résultat qu’avec
deux
chiffres significatifs. 5)-
Comparer xf
et xmax. Conclure.
-
xf
≈ 1,0
× 10–7 mol
et xmax ≈ 28 mol.
-
xf
<< xmax
-
Le nombre de
molécules d’eau dissociées est très faible. - La réaction est très limitée dans le sens direct.
- On est en présence d’un
équilibre chimique.
-
La réaction est quasi
totale dans le sens inverse (réaction acido-basique) |
||||||||||||||||||||||||||||
VII- Exercice 18 page 342 : Tracer un diagramme de prédominance.
|
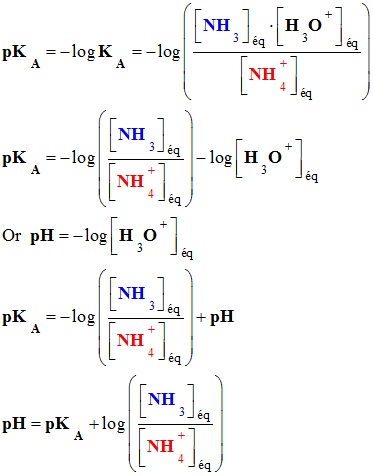
L’ammoniac NH3 (aq) est une base faible dans l’eau. Le couple ion ammonium / ammoniac a pour constante d’acidité : KA
= 6,3
× 10–10 à 25 ° C. 1)-
Calculer le pKA associé au couple
acide / base. 2)-
Tracer le diagramme de prédominance correspondant. 3)-
Le pH d’une solution aqueuse d’ammoniac vaut
10,6. a)-
Quelle est l’espèce
prédominante dans la solution ? b)-
Calculer la valeur du
quotient
c)-
Le résultat obtenu est-il en
accord avec la réponse à la question 3)- a)- ? |
|
1)-
Valeur du pKA associé au couple
acide / base.
-
Par définition :
pKA = – log KA,
soit
KA = 10– pKA
-
pKA
= – log KA = – log (6,3
× 10–10)
-
pKA
= 9,2 2)-
Diagramme de prédominance correspondant. 3)-
Le pH d’une solution aqueuse d’ammoniac vaut
10,6. a)-
Espèce prédominante dans la
solution :
-
Dans ce cas pH
> pKA, l’espèce qui prédomine est
l’ammoniac NH3 (aq)
-
Avec le diagramme de
prédominance : b)-
Valeur du quotient
-
On utilise la
relation :
Additif (pour retrouver la relation)
-
-
c)-
Le résultat obtenu est en
accord avec la réponse à la question 3)- a)- :
-
NH3
prédomine devant NH4+
Additif :
Pour retrouver la relation
-
Étude du couple
NH4+
(aq) / NH3
(aq) :
-
À ce couple est
associée la réaction suivante :
-
On associe à cette
réaction la constante d’acidité :
-
-
En utilisant pKA
= – log KA
-
|
VIII- Exercice 20 page 342 : Calculer le pH d’une solution d’acide
fort.
|
L’acide nitrique
HNO3
(ℓ) est un acide fort dans l’eau. On considère une solution aqueuse S d’acide nitrique de concentration molaire
en soluté apporté
C = 2,5
× 10–3 mol . L–1. 1)-
Définir un acide fort dans l’eau. 2)-
Écrire l’équation de la réaction entre l’acide
nitrique HNO3 (ℓ) et l’eau. 3)-
Calculer le pH de la solution S. 4)- On dilue dix fois la solution S : on obtient une solution S’. Quel est le pH de la
solution S’ ? |
|
1)-
Définition un acide fort dans l’eau.
-
Un acide AH
est fort dans l’eau si sa réaction avec l’eau est
totale.
-
L’équation de cette
réaction s’écrit alors avec une simple flèche :
2)-
Équation de la réaction entre l’acide nitrique
HNO3 (ℓ) et l’eau.
3)-
Valeur du pH de la solution S.
-
Le pH d’une
solution diluée d’acide fort, de concentration C
en soluté apporté, est :
-
La valeur de la
concentration C = 2,5
× 10–3 mol . L–1
appartient
bien au domaine de validité :
-
pH = – log
C = – log (2,5
× 10–3)
-
pH ≈ 2,6 4)-
Valeur du pH de la solution S’ ?
-
On a effectué une
dilution :
-
C’ = C
/ 10
-
C’= 2,5
× 10–4 mol . L–1
-
La valeur de la
concentration C’ = 2,5
× 10–4 mol . L–1 appartient
bien au domaine de validité :
-
pH = – log
C = – log (2,5
× 10–4)
-
pH ≈ 3,6 |
IX- Exercice 21page 342 : Calculer le pH d’une solution de base
forte.
|
Une solution
aqueuse S d’hydroxyde de sodium est préparée par
dissolution totale du solide
NaOH
(s). La solution obtenue est une
solution de base forte de concentration
C = 5,0
× 10–2 mol . L–1. 1)-
Écrire l’équation de la dissolution. 2)-
Calculer le pH de la solution S. 3)-
On dilue dix fois la solution S : on obtient
une solution S’. Quel est le pH de la
solution S’ ? |
|
1)-
Équation de la dissolution.
-
La réaction de
dissolution de l’hydroxyde de sodium NaOH (s)
est une réaction totale dans l’eau.
-
Solution aqueuse
d’hydroxyde de sodium :
NaOH (s) +
H2O
(ℓ) →
(Na+,
H2O)
(aq)
+
OH– (aq)
-
Cela revient à la
dissolution d’un composé ionique dans l’eau que l’on
peut écrire plus simplement :
-
formule
de la soude : {Na+ (aq)
+ HO– (aq)}
(solution aqueuse d’hydroxyde de sodium) 2)-
Valeur du pH de la solution S.
-
Une base A–
est forte dans l’eau si sa réaction avec l’eau est
totale.
-
L’équation de cette
réaction s’écrit alors avec une simple flèche :
-
Le pH d’une
solution diluée de base forte, de concentration C
en soluté apporté, est :
-
La valeur de la
concentration C = 5,0
x 10–2 mol . L–1appartient
bien au domaine de validité :
-
pH = 14 + log
C = 14 + log (5,0
× 10–2)
-
pH ≈ 12,7
-
pH ≈ 13 3)-
Valeur du pH de la solution S’
-
On a effectué une
dilution :
-
C’ = C
/ 10
-
C’= 5,0
× 10–3 mol . L–1
-
La valeur de la
concentration C’ = 2,5
× 10–4 mol . L–1 appartient
bien au domaine de validité :
-
pH = 14 + log
C = 14 + log (5,0
× 10–3)
-
pH ≈ 11,7
-
pH ≈ 12 |
X- Exercice 24 page 342-343 : Mesure d’un pH et incertitudes.
|
1)-
Le pH-mètre : a)-
Quel réglage du pH-mètre
doit-on réaliser avant de mesurer le pH de la
solution. b)-
Comment nomme-t-on les
solutions permettant de réaliser ce réglage ? 2)- Sachant que l’incertitude de la mesure donnée par le pH-mètre est de : 0,05 unité pH, écrire le
résultat de la mesure sous la forme :
pHsolution
= pHmesuré ± U (pH) 3)-
En déduire un encadrement de la concentration [H3O+]solution
correspondante et l’incertitude U ([H3O+]). 4)-
Calculer l’incertitude relative
5)-
Pourquoi la concentration [H3O+]solution,
déduite d’une mesure de pH, doit-elle
s’exprimer avec, au plus, deux chiffres
significatifs ? |
|
1)-
Le pH-mètre : a)-
Réglage du pH-mètre :
-
Il est nécessaire
d’étalonner le pH-mètre avant toute mesure.
-
L’étalonnage du pH-mètre
nécessite l’utilisation de deux solutions étalons
(solutions tampons) de pH connu.
-
Il faut régler aussi
le bouton température sur la valeur de la
température de la solution. b)-
Les solutions utilisées :
-
Solutions étalons (pH1
= 4,00 ; pH2 = 7,00) 2)-
Incertitude de la mesure donnée par le pH-mètre :
-
pHsolution
= pHmesuré ± U (pH)
-
pHsolution
= 2,52 ± 0,05 3)-
Encadrement de la concentration [H3O+]solution
correspondante et l’incertitude U ([H3O+]).
-
De la relation :
-
pHsolution
= 2,52 ± 0,05
-
On tire : Encadrement
de la valeur du pH 2,47
≤
pHsolution
≤ 2,57
-
Par définition :
[H3O+] = 10–
pH mol
. L–1
-
[H3O+]mesuré
= 10–
2,52 mol
. L–1
-
[H3O+]mesuré
≈ 3,02
× 10–3 mol . L–1
-
Par définition :
pH =
– log [H3O+]
2,47 ≤
pHsolution
≤ 2,57 2,47
≤
– log
[H3O+]solution
≤
2,57 2,47
≥
log
[H3O+]solution
≥
2,57
-
Comme la fonction
logarithme décimal est une fonction croissante :
x1
< x2
=>
log
x1 < log x2 et log
a ≤ log
x ≤ log b =>
10a
≤ x
≤ 10b
-
On obtient :
10–
2,47 mol
. L–1 ≥
[H3O+]solution
≥ 10–
2,57 mol
. L–1 3,39
× 10–3 mol . L–1 ≥
[H3O+]solution
≥ 2,69
× 10–3 mol . L–1 2,69
× 10–3 mol . L–1 ≤
[H3O+]solution
≤
3,39
× 10–3 mol . L–1 - Incertitude sur la valeur de la concentration [H3O+]solution de la solution : - L’incertitude U ([H3O+] = 0,35 × 10–3 mol . L–1
-
[H3O+]
solution =
(3,04
± 0,35)
× 10–3
mol . L–1 4)-
Valeur de l’incertitude relative :
-
Valeur de
l’incertitude sur la mesure du pH :
-
-
Valeur de
l’incertitude relative sur la valeur de la
concentration [H3O+]solution :
-
- Une incertitude relative d’environ 2 % sur la valeur du pH entraîne une incertitude relative
d’environ 10 %
(plus de 5 fois plus) sur celle de la concentration
[H3O+]solution.
-
5)-
La concentration [H3O+]solution
et chiffres significatifs : - Conséquence : Une mesure de pH effectuée à 0,05 unité près conduit à une valeur de la concentration [H3O+] connue à 11,5 % près.
Une simple mesure de pH
ne peut donner une concentration avec précision.
-
Il faut limiter le
nombre de chiffres significatifs pour représenter
une concentration déduite de la valeur du pH. - Toute concentration déduite de la valeur du pH sera exprimée avec : 2 chiffres significatifs au maximum .
-
Dans le cas présent,
on donne :
-
[H3O+]solution
≈ 3,0
× 10–3 mol . L–1 |
XI- Exercice 32 page 345 : Point isoélectrique de la glycine.
|
|
|
|
|
|





 (aq)
(aq) (aq)
(aq)

 .
.




 .
.

