|
Chim
N° 04 : |
|
|
|
- Pour une réaction limitée, se déroulant en milieu homogène et à une température donnée, il existe une constante K traduisant l'état d'équilibre du système.

- Remarque : si l'un des réactifs est en large excès (exemple : le solvant), on peut considérer que sa concentration reste constante au cours de la réaction.
- On définit alors la constante réduite si B est en large excès :
-

- En conséquence, la grandeur Kr est un nombre sans dimension.
- On considère une solution aqueuse d'acide éthanoïque. C'est un acide faible et la réaction avec l'eau est limitée.
- À cet équilibre est associée une constante d'équilibre :
Avertissement :
Remarque : Dans ce qui
suit, les grandeurs
[CH3COOH],
[H3O+]
et [CH3COO
–]
représentent les concentrations des espèces chimiques à l'équilibre chimique
On peut utiliser la
notation suivante
: [CH3COOH]eq,
[H3O+]eq
et [CH3COO –]eq
-

- Or l'eau est le solvant et il est en large excès.
- On peut utiliser la constante réduite liée à la dissociation de l'acide dans l'eau.
- On l'appelle la constante d'acidité notée : Kr = KA.
-

- Généralisation : par définition, la constante d'acidité du couple AH / A – est donnée par la relation :
![]() La grandeur KA
ne dépend que de la température, c'est
une grandeur sans dimension.
La grandeur KA
ne dépend que de la température, c'est
une grandeur sans dimension.
![]() Elle s'exprime sans unité.
Elle s'exprime sans unité.
- On
définit aussi : pKA = – log KA =>
KA = 10 – pKA
- Exemples :
|
Couple (1) |
CH3COOH
/ CH3COO – |
KA =
1,8 x 10 – 5 |
pKA =
4,8 |
|
Couple (2) |
NH4+ /
NH3 |
KA =
6,3 x 10 – 10 |
pKA =
9,2 |
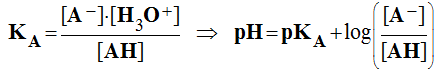
4)- Mise en solution d'un acide faible. Réaction prépondérante.
- Dans une solution aqueuse d'acide faible, il y a deux réactions en compétition.
- La dissociation de l'acide :

- Et la réaction d'autoprotolyse de l'eau :
![]()
![]() Si l'acide n'est pas trop dilué et si la
constante d'acidité est grande par rapport au produit ionique de l'eau, la
réaction de dissociation de l'acide est prépondérante devant la réaction
d'autoprotolyse de l'eau.
Si l'acide n'est pas trop dilué et si la
constante d'acidité est grande par rapport au produit ionique de l'eau, la
réaction de dissociation de l'acide est prépondérante devant la réaction
d'autoprotolyse de l'eau.
- En
conséquence : [A –] ≈ [H3O+]
5)- Mise en solution d'une base faible. Remarque importante.
- La mise en solution d'une base faible conduit à un équilibre chimique :
- La constante de dissociation KB est appelée constante de protonation ou de "basicité".
- Il découle de ceci que l'espèce BH+ est un acide faible tel que :
-
remarque
: KA . KB = Ke
=> pKe
= pKA +
pKB
-
Exemple :
|
Couple (2) |
NH4+ /
NH3 |
KA = 6,3 x
10 – 10 |
pKA = 9,2 |

- Lorsque l'on met en solution une base faible B, il y a deux réactions en compétition :

- et la réaction d'autoprotolyse de l'eau :
![]()
![]() Si la base n'est pas trop diluée et si la
constante de "basicité" n'est pas trop grande par rapport au produit ionique de
l'eau, la réaction de protonation de la base est prépondérante devant
l'autoprotolyse de l'eau.
Si la base n'est pas trop diluée et si la
constante de "basicité" n'est pas trop grande par rapport au produit ionique de
l'eau, la réaction de protonation de la base est prépondérante devant
l'autoprotolyse de l'eau.
- En
conséquence : [OH –] ≈ [BH+]
► Quel est le pKA
du couple H3O+/
H2O
?
-
H3O+
+ H2O
= H3O+
+ H2O
(1)
=> pKA =
0
► Quel est le pKA
du couple H2O
/ OH –?
-
H2O
+
H2O
= H3O+
+ OH – (2) = KA
= Ke = [H3O+]
. [OH –]
- pKA
= pKe = 14
II- Classification des couples acide / base.
- La force d'un acide est relative au solvant utilisé.
- On s'intéresse à la force des acides dans l'eau.
- La force d'un acide est liée à la quantité d'ion hydronium que fournit la réaction d'une quantité déterminée de cet acide dans l'eau.
- Cas des acides forts :
- Si l'acide est fort, la réaction avec l'eau est totale.
|
AH
+ H2O
→ A –
+ H3O+ |
![]() Tous les acides forts ont la même force dans
l'eau et ne peuvent être différenciés.
Tous les acides forts ont la même force dans
l'eau et ne peuvent être différenciés.
![]() On dit que l'eau nivelle la force des acides.
On dit que l'eau nivelle la force des acides.
![]() L'acide le plus fort dans l'eau est H3O+.
L'acide le plus fort dans l'eau est H3O+.
- Cas des acides faibles :
- la réaction avec l'eau est limitée.
|
AH
+ H2O
=
A – +
H3O+ |
|
AH
+
H2O
=
A–
+
H3O+
|
![]() Plus l'équilibre est déplacé dans le sens direct
de l’écriture est plus l'acide est fort.
Plus l'équilibre est déplacé dans le sens direct
de l’écriture est plus l'acide est fort.
![]() Un acide faible est d'autant plus fort que sa
réaction avec l'eau est moins limitée.
Un acide faible est d'autant plus fort que sa
réaction avec l'eau est moins limitée.
|
HCOOH |
CH3COOH |
|||||
|
C ≈ 1,0
× 10 – 2
mol / L |
C ≈ 1,0
× 10 – 2
mol / L |
|||||
|
Acide méthanoïque |
pH ≈ 2,9 |
Acide éthanoïque |
pH ≈ 3,4 |
|||
|
pKA ≈
3,8 |
pKA ≈
4,8 |
|||||
|
KA ≈
1,6
× 10 – 4 |
KA ≈
1,6
× 10 – 5 |
- Exemple :
![]() Conclusion : À concentration égale, l'acide
méthanoïque se dissocie plus que l'acide éthanoïque. L'acide méthanoïque est un
acide plus fort que l'acide éthanoïque.
Conclusion : À concentration égale, l'acide
méthanoïque se dissocie plus que l'acide éthanoïque. L'acide méthanoïque est un
acide plus fort que l'acide éthanoïque.
![]() Un acide est d'autant plus fort dans l'eau que sa
constante d'acidité KA
du couple est grande et donc que son pKA est petit.
Un acide est d'autant plus fort dans l'eau que sa
constante d'acidité KA
du couple est grande et donc que son pKA est petit.
-
La force d'une base est liée à la quantité d'ion
hydroxyde que fournit la réaction d'une quantité déterminée
de cette base dans l'eau
- Cas des bases fortes : la base est forte si la réaction avec l'eau est totale.
|
B
+ H2O
→ OH –
+ BH+ |
![]() Toutes les bases fortes ont la même force dans
l'eau et ne peuvent être différenciées.
Toutes les bases fortes ont la même force dans
l'eau et ne peuvent être différenciées.
![]() On dit que l'eau nivelle la force des bases.
On dit que l'eau nivelle la force des bases.
![]() La
base la plus forte dans l'eau est OH–.
La
base la plus forte dans l'eau est OH–.
- Cas des bases faibles : la réaction avec l'eau est limitée.
|
B
+ H2O
=
OH – +
BH+ |
![]() Plus l'équilibre est déplacé dans le sens direct
est plus la base est forte.
Plus l'équilibre est déplacé dans le sens direct
est plus la base est forte.
![]() Une base faible est d'autant plus forte que sa
réaction avec l'eau est moins limitée.
Une base faible est d'autant plus forte que sa
réaction avec l'eau est moins limitée.
- Exemple :
|
|
|
CH3NH2 |
|
|
|
NH3 |
|
|
|
C ≈ 1,0
× 10 – 2 mol / L |
|
|
|
C ≈ 1,0
× 10 – 2 mol / L |
|
Méthylamine |
|
pH ≈ 11,3 |
|
Ammoniac |
|
pH ≈ 10,6 |
|
|
|
pKA ≈ 10,7 |
|
|
|
pKA ≈ 9,2 |
|
|
|
KA ≈ 2,0
× 10 – 11 |
|
|
|
KA ≈ 6,3
×
10 – 10 |
![]() Conclusion : à concentration égale, la
méthylamine se dissocie plus que l'ammoniac. La méthylamine est une base plus
forte que l'ammoniac.
Conclusion : à concentration égale, la
méthylamine se dissocie plus que l'ammoniac. La méthylamine est une base plus
forte que l'ammoniac.
![]() Une base est d'autant plus forte dans l'eau que
sa constante d'acidité KA
du couple est faible et donc que son pKA est plus grand.
Une base est d'autant plus forte dans l'eau que
sa constante d'acidité KA
du couple est faible et donc que son pKA est plus grand.
![]() Conséquences : considérons les couples suivants :
A1 / B1 et
A2 / B2.
Conséquences : considérons les couples suivants :
A1 / B1 et
A2 / B2.
![]() Si
A1 est un acide plus fort que
A2,
alors B1 est une base plus faible que
B2.
Si
A1 est un acide plus fort que
A2,
alors B1 est une base plus faible que
B2.
![]() Une base est d'autant plus faible que son acide
conjugué est fort et inversement.
Une base est d'autant plus faible que son acide
conjugué est fort et inversement.
- L'ion
hydronium est l'acide le plus fort qui puisse exister dans l'eau.
- L'ion
hydroxyde est la base la plus forte qui puisse exister dans l'eau.
-
tout acide faible est plus faible
que H3O+,
acide du couple H3O+
/ H2O
- Et toute
base faible est plus faible que OH
–, base du couple H2O
/ OH –.
- On va
construire une échelle des pKA qui est représentée
verticalement.
- Les pKA
croissant vers le haut.
- Les
acides sont situés à droite et les bases conjuguées à gauche de l'axe vertical.
- Les
couples extrêmes sont : H3O+
/ H2O et H2O
/ OH –.
III- Domaines de prédominance.

-
Premier cas : si

- L'acide est la base conjuguée ont la même concentration.
-
Deuxième cas : si

- La base est l'espèce prédominante
-
Troisième cas : si

- représentation sur un axe horizontal :

![]() Les indicateurs colorés sont constitués par des
couples acide faible / base faible dont les espèces conjuguées ont des teintes
différentes.
Les indicateurs colorés sont constitués par des
couples acide faible / base faible dont les espèces conjuguées ont des teintes
différentes.
- Écriture symbolique :
-

- On admet que l'indicateur coloré prend sa teinte acide si :
-

- On admet que l'indicateur prend sa teinte basique si :
-

- Domaine de prédominance :
1)- Prévision du sens d'une réaction acido-basique en milieu aqueux.
- La réaction acido-basique consiste en l'échange de protons entre deux couples acide / base en présence d'un solvant l'eau.
-
Couple (1) :

-
Couple (2) :

- Si l'on mélange les deux couples (1) et (2), il peut se produire les réactions suivantes :
-
remarque
:

- En utilisant les constantes d'acidité des deux couples, on peut écrire :
-

- Envisageons le cas : KA1 > KA2
- : KR1 > 1 et : KR2 < 1 : La réaction est déplacée dans le sens direct.
- Si on utilise l'échelle des pKA, on peut classer les deux couples acide / base sur cet axe.
- Si l'on mélange le couple (1) et le couple (2), la réaction avancée fait intervenir l'acide le plus fort et la base la plus forte.
![]() La règle du gamma permet de trouver le sens de la
réaction avancée.
La règle du gamma permet de trouver le sens de la
réaction avancée.
![]() L'équilibre est d'autant plus déplacé dans le
sens direct que la constante d'équilibre :
KR1 est grande.
L'équilibre est d'autant plus déplacé dans le
sens direct que la constante d'équilibre :
KR1 est grande.
-
C'est-à-dire que :
: KA1
est grand par rapport à KA2.
-

- La réaction effective d'un acide avec une base est d'autant plus avancée que la différence des pKA des couples mis en jeu est grande.
- Remarque importante :
![]() On admet que la réaction est pratiquement totale
si : ΔpKA >
4 => KR > 10
4
On admet que la réaction est pratiquement totale
si : ΔpKA >
4 => KR > 10
4
![]() On dit que la réaction est quantitative.
On dit que la réaction est quantitative.
![]() Exemple :
Exemple :
- On verse une solution d'ammoniac dans une solution d'acide benzoïque. Observe-t-on une réaction acido-basique entre ces réactifs ?
- Couples :
|
Les couples : |
|||
|
Couple (1) |
NH4+ / NH3 |
KA1 = 6,3 x 10 – 10 |
pKA1 = 9,2 |
|
Couple (2) |
C6H5COOH / C6H5COO
– |
KA2 = 6,3 x 10 – 5 |
pKA2 = 4,2 |
- On utilise l'échelle des pKA.
- Les réactions possibles sont les suivantes :
|
NH3 +
H2O =
OH – +
NH4+
(1) |
|
C6H5COOH
+ H2O
= C6H5COO
– + H3O+
(2) |
|
C6H5COOH
+ NH3
= C6H5COO
– + NH4+
(3) |
- Le but est de trouver la réaction avancée, la réaction prépondérante ou la réaction principale, puis de négliger l'effet des autres réactions devant la réaction avancée.
- La connaissance des valeurs des constantes d'acidité, permet d'affirmer que les réactions (1) et (2) sont limitées et que les espèces majoritaires sont : NH3 et C6H5COOH.
- Parmi les espèces présentes, la base la plus forte est l'ammoniac NH3 et l'acide le plus fort est l'acide benzoïque C6H5COOH.
![]() Toute base appartenant à un couple de
pKA
donné réagit :
Toute base appartenant à un couple de
pKA
donné réagit :
![]() Selon une réaction avancée avec tout acide
appartenant à un couple de pKA plus petit
Selon une réaction avancée avec tout acide
appartenant à un couple de pKA plus petit
![]() Selon une réaction limitée avec tout acide
appartenant à un couple de pKA plus grand.
Selon une réaction limitée avec tout acide
appartenant à un couple de pKA plus grand.
![]() La règle du gamma permet de retrouver l'équation
bilan de la réaction avancée :
La règle du gamma permet de retrouver l'équation
bilan de la réaction avancée :
|
C6H5COOH
+ NH3
=
C6H5COO –
+ NH4+
(3) |
- On peut calculer la constante de cet équilibre :
-

- En conséquence, la réaction est quasi-totale et on peut écrire :
|
C6H5COOH
+ NH3
→ C6H5COO
– + NH4+
(3) |
![]() La réaction prépondérante fait intervenir la base
la plus forte et l'acide le plus fort présents dans le mélange.
La réaction prépondérante fait intervenir la base
la plus forte et l'acide le plus fort présents dans le mélange.
2)- Méthode de prévision des réactions.
a)- Recenser les espèces mises en jeu.
b)- Rechercher les couples correspondants à ces espèces.
c)- Classer les espèces suivant la valeur des pKA et les placer entre les couples extrêmes de l'eau.
d)- Marquer en les soulignant, les espèces prédominantes pour chaque couple.
e)- Rechercher l'acide le plus fort et la base la plus forte présents dans le milieu.
f)- Faire réagir l'acide le plus fort et la base la plus forte jusqu'à épuisement d'un des deux réactifs.
g)- Recommencer avec les nouvelles espèces obtenues.
h)- Le couple restant en fin de réaction détermine la valeur du pH de la solution finale.
1)- Dissolution de l'acide benzoïque dans l'eau.
![]() On dissout de l'acide benzoïque dans l'eau.
On dissout de l'acide benzoïque dans l'eau.
- On donne :
|
Couple |
C6H5COOH / C6H5COO
– |
KA ≈ 6,3 x 10 – 5 |
pKA ≈ 4,2 |
- Quelle est la réaction prépondérante ou principale ?
- Est-elle avancée ou limitée ?
- Échelle des pKA.
- Réaction principale :
|
C6H5COOH
+ H2O
=
C6H5COO –
+ H3O+
(2) |
|
pKR = pKA
= 4,2 => KR = 10
– 4,2 |
|
KR ≈ 1,6
× 10 – 5 << 1 |
- La réaction prépondérante ou principale est limitée (mais moins limitée que la réaction d'autoprotolyse de l'eau).
2)- Réaction entre la soude et l'acide benzoïque.
![]() On mélange (VB
= 80 mL ; CB = 0,25 mol /L) de
soude et (VA = 20 mL ;
CA = 0,50 mol
/ L) d'acide benzoïque.
On mélange (VB
= 80 mL ; CB = 0,25 mol /L) de
soude et (VA = 20 mL ;
CA = 0,50 mol
/ L) d'acide benzoïque.
- Donner la réaction prépondérante et en déduire le pH de la solution obtenue.
- Échelle des pKA et espèces présentes :
- La réaction prépondérante :
|
C6H5COOH
+ OH –
=
C6H5COO –
+ H2O
(1) |
|
pKR =14 –
4,2 => KR = 10
14 – 4,2 |
|
KR ≈ 6,3
x× 10 9 >> 10
4 |
- La réaction est quasi-totale :
|
C6H5COOH |
+
OH – |
→ |
C6H5COO
– |
+
H2O |
|
|
État initial mol |
nA
= CA . VA nA =
0,010 |
nB
= CB . VB nA =
0,010 |
0 |
Excès |
|
|
État final mol |
≈ 0,0 |
≈ 0,01 |
≈ 0,01 |
Excès |
- espèces présentes en fin de réaction.
- En conséquence, il faut faire une nouvelle étude.
- La
solution est basique car elle contient deux bases : OH –, base
forte et C6H5COO
–, une base faible.
- C'est la base forte initialement en excès, qui impose le pH de la solution.
- Il faut calculer la concentration en ion hydroxyde.
-
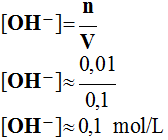
- pH ≈ 14 – log C
=> pH ≈ 14 – 1 => pH ≈ 13
3)- Comprimé d'aspirine effervescent.
![]() Le comprimé contient de l'acide acétylsalicylique
que l'on note AH et de
l'hydrogénocarbonate de sodium.
Le comprimé contient de l'acide acétylsalicylique
que l'on note AH et de
l'hydrogénocarbonate de sodium.
- Donner les espèces présentes lors de la dissolution dans l'eau.
- Donner l'équation bilan de la réaction prépondérante.
- Donner la constante d'équilibre KR de cette réaction.
- Pourquoi observe-t-on une effervescence ?
- On donne les couples : acide acétylsalicylique / ion acétylsalicylate que l'on note
|
Couple Acide acétylsalicylique / ion acétylsalicylate |
AH / A – |
pKA =
3,6 |
|
Dioxyde de carbone dissous / ion hydrogénocarbonate |
CO2, H
2O / HCO3 – |
pKA1 =
6,4 |
|
ion hydrogénocarbonate / Ion carbonate |
HCO3– /
CO3 2– |
pKA1 =
10,3 |
- échelle des pKA et espèces présentes.
- L'acide acétylsalicylique AH réagit avec l'ion hydrogénocarbonate pour donner du dioxyde de carbone faiblement soluble dans l'eau (ce qui explique le dégagement de dioxyde de carbone c'est-à-dire l'effervescence).
- Équation bilan de la réaction prépondérante :
|
HCO3–
+ AH =
CO2 +
A – |
|
pKR =6,4
– 3,6 => KR =
10 6,4 – 3,6 |
|
KR ≈
6,2
× 10 2 < 10
4 |
- La réaction fortement est déplacée, avancée dans le sens direct mais elle n'est pas quasi-totale.
|
|
|
|