|
Chim
N° 01 :
|
|
|
|
- L'eau est capable de dissoudre un certain nombre de substances solides, liquides et gazeuses.
- On obtient des solutions aqueuses. L'eau est un solvant polaire.
- La molécule d'eau est électriquement neutre, mais l'atome d'oxygène est plus électronégatif que l'atome d'hydrogène ( H : χ H = 2,2 et O : χ O = 3,5).
- En
conséquence, il apparaît une charge partielle négative δ– sur
l'atome d'oxygène et une charge partielle positive δ'+ sur
chaque atome d'hydrogène.
- Dans
l'eau, l'ion hydrogène H+
joue un rôle très particulier du fait de sa petite taille (rH+
= 10–15 m).
Il est beaucoup plus petit que toute autre espèce chimique.
- Dépourvu
d'électrons, il peut s'approcher de très près d'une autre espèce chimique riche
en électrons.
|
|
|
|
Molécule d'eau |
Ion hydronium |
- Il crée une association à la fois solide et de brève durée de vie avec une molécule d'eau pour donner l'ion hydronium : H3O+.
2)- Définition du pH d'une solution aqueuse.
![]() pH = – log [H3O+] cette
relation est équivalente à
[H3O+] = 10– pH mol.L–1
pH = – log [H3O+] cette
relation est équivalente à
[H3O+] = 10– pH mol.L–1
- En toute rigueur, il faut faire intervenir l'activité de l'ion hydronium (H3O+).
- L'activité d'un ion caractérise le comportement de l'ion en tenant compte de sa concentration et des interactions électrostatiques qu'il subit dans le solvant considéré.
-
L'activité est un nombre sans dimension :
![]()
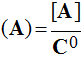
- Activité de A : (A) pas d'unité
- Concentration de A : [A] en mol / L
-
Coefficient d'activité C0 en
mol / L ; pour les espèces
diluées C0 ≈
1,0 mol / L
- Rappels sur la fonction logarithme.
1)- Les indicateurs colorés et le papier pH.
- Comme indicateurs colorés, on utilise, l'hélianthine, le bleu de bromothymol et la phénolphtaléine.
- L'utilisation des indicateurs colorés permet de déterminer un encadrement de la valeur du pH d'une solution.
- Le papier pH est imbibé d'un mélange de plusieurs indicateurs colorés, il peut donner une valeur du pH à 0,5 unité près.
2)- Le pH-mètre ( TP chimie N° 1)
3)- La mesure et sa précision.
- Dans les conditions habituelles, au lycée, on peut mesurer un pH, au mieux, à 0,05 unité près (le plus souvent à 0,1 unité près).
![]() Conséquence : Une mesure de
pH effectuée à 0,05 unité près conduit à une valeur de la
concentration [H3O+] connue à 11,5 % près.
Conséquence : Une mesure de
pH effectuée à 0,05 unité près conduit à une valeur de la
concentration [H3O+] connue à 11,5 % près.
![]() Une simple mesure de pH ne peut donner une concentration avec
précision.
Une simple mesure de pH ne peut donner une concentration avec
précision.
![]() Il faut limiter le nombre de chiffres significatifs pour
représenter une concentration déduite de la valeur du pH.
Il faut limiter le nombre de chiffres significatifs pour
représenter une concentration déduite de la valeur du pH.
![]() Toute concentration déduite de la valeur du
pH sera exprimée avec
2 chiffres significatifs au maximum.
Toute concentration déduite de la valeur du
pH sera exprimée avec
2 chiffres significatifs au maximum.
- Application 1 :
- pH = 3,9 ;
- [H3O+]
≈ 1,3
× 10 –4 mol / L.
1)- Valeur du pH de l'eau pure à 25° C.
- Le
pH de l'eau pure à
25° C est égal à 7,0.
- pH
= 7
- [H3O+]
≈ 1,0
× 10 –7 mol / L
- L'eau
pure contient des ions hydronium.
2)- Réaction d'ionisation de l'eau :
- L'eau est électriquement neutre.
- Comme elle contient des ions hydronium chargés positivement, elle contient obligatoirement des anions : OH–.
- On peut écrire l'équation bilan suivante :
2 H2O → H3O+ + OH–
- Cette réaction porte le nom d'Autoprotolyse de l'eau.
- C'est une réaction limitée.
- Seulement 2 molécules d'eau sur 550 millions participent à la formation des ions :
-
Considérons 1L d'eau pure à 25° C :
-
n (H2O)
≈ 55,6 mol
-
n (H3O+)
≈ 1,0
× 10 –7 mol
-
n (OH–)
≈ 1,0
× 10 –7 mol
- Il existe
une réaction inverse à la réaction d'autoprotolyse de l'eau, c'est la réaction
acido-basique :
-
H3O+
+ OH– → 2 H2O
- Il existe
dans l'eau 2 réactions inverses qui se produisent simultanément.
- Elles
annulent mutuellement leurs effets.
-
On arrive à un équilibre dynamique.
2
H2O
= H3O+
+ OH–
- sens direct : autoprotolyse de l'eau : réaction limitée
- sens inverse : réaction acido-basique : réaction quasi-totale.
- Dans l'eau pure, on trouve : une espèce majoritaire, l'eau et des espèces ultra minoritaires, les ions hydronium et les ions hydroxyde.
2)-
Produit
ionique de l'eau pure à 25° C.
- 2
H2O
= H3O+
+ OH –
- Cet
équilibre chimique est caractérisé par une constante d'équilibre Ke
appelé produit ionique de l'eau.
-
Ke
= [H3O+]
. [OH –]
- Ke
≈ 1,0
× 10
–14 ceci pour l'eau pure à 25° C
-
Ke
est un nombre qui n'a pas d'unité.
- Pour
éviter l'emploi de l'exposant 10, on utilise une échelle logarithmique, on
pose :
- pKe = – log Ke
- pKe ≈ 14 à 25 °C
- remarque : le produit ionique de l'eau varie de manière sensible avec la température.
- Tableau
|
Température en ° C |
pKe |
|
0° |
14,96 |
|
25° |
14,00 |
|
40° |
13,53 |
|
60° |
13,02 |
|
80° |
12,6 |
|
100° |
12,26 |
IV- Le pH des solutions aqueuses.
1)- Invariance du produit ionique de l'eau en solution aqueuse.
![]() Pour toutes les solutions aqueuses,
Ke
= [H3O+]
. [OH–] = cte à une température donnée.
Pour toutes les solutions aqueuses,
Ke
= [H3O+]
. [OH–] = cte à une température donnée.
- Application 2 :
- Le
pH d'une solution
A à 25° C est égal à 2,0. Que peut-on
déduire de cette valeur ?
-
pH = 2,0
- Par
définition :
- pH
= - log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+] = 10
– 2,0 mol.L–1
-
[H3O+]
≈ 1,0
×
10–2 mol / L.
- D'autre
part :
-
Ke
= [H3O+]
. [OH –] ≈ 1,0
× 10–14
-
[OH–]
= 10pH – pKe mol.L–1
-
[OH–] =
102 –
14 mol.L–1
-
[OH–] ≈ 1,0
× 10–12 mol.L–1
- Une solution neutre contient autant d'ions hydronium que d'ions hydroxyde.
- [H3O+]
= [OH –]
- [H3O+]2 =
Ke
-
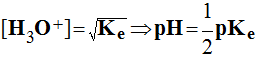
- À 25° C, pKe = 14 et pH = 7 pour les solutions neutres.
3)- Solution
acide.
- Elle contient plus d'ions hydronium que d'ions hydroxyde.
-
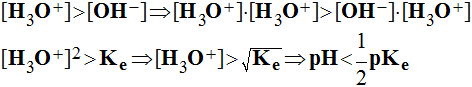
- À 25° C, pKe = 14 et pH < 7 pour les solutions acides.
- Elle contient plus d'ions hydroxyde que d'ions hydronium.
-

- À 25° C, pKe = 14 et pH > 7 pour les solutions basiques.
5)- Électroneutralité des solutions aqueuses.
![]() Toutes les solutions aqueuses sont électriquement neutres :
Toutes les solutions aqueuses sont électriquement neutres :
![]() le nombre de charges positives est égal au nombre de charges
négatives.
le nombre de charges positives est égal au nombre de charges
négatives.
- Application 3 :
- Une solution contient les espèces suivantes : des ions : sodium, chlorure, sulfate, fer III, cuivre II et des molécules : eau, éthanol.
- Écrire l'équation d'électroneutralité :
-
[H3O+]
+ [Na+]
+ 3 [Fe3+]
+ 2 [Cu2+]
= [OH–] + [Cl–]
+ 2 [SO42–]
V- Valeur du pH d'une solution aqueuse d'acide chlorhydrique.
1)- Préparation de la solution. Étude qualitative.
- Le chlorure d'hydrogène est un gaz très soluble dans l'eau
(1litre d'eau peut dissoudre 23,5 mol de HCl à 0° C sous une pression de 1013 hPa c'est-à-dire environ 400 L de gaz)
- La dissolution du HCl dans l'eau est une réaction chimique exothermique.
- Équation bilan :
HCl + H2O → H3O+ + Cl–
- La solution obtenue est appelée acide chlorhydrique. Elle contient les espèces suivantes :
- Des molécules d'eau : solvant (espèce ultra majoritaire)
- Des ions hydronium et chlorure (espèces majoritaires) et des ions hydroxyde (espèce minoritaire)
- Elle ne contient pas de molécules de chlorure d'hydrogène car la réaction est totale.
- Tableau :
|
Concentration
de la solution
en mol / L |
10 –1 |
10 –2 |
10 –3 |
10 –4 |
10 –5 |
10 –6 |
10 –7 |
10 –8 |
10 –9 |
|
pH |
1,1 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
6,8 |
6,98 |
7,0 |
|
– log C |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
- Application 4 :
- On possède une solution d'acide chlorhydrique de concentration C.
- Que peut-on dire de la concentration en ions chlorure, hydronium et hydroxyde ?
- Quelle que soit la concentration C de la solution d'acide chlorhydrique :
- [Cl –] = C.
- Pour la concentration en ion hydronium cela dépend :
|
► Si la solution est trop concentrée :
-
C >
5,0
×
10–2 mol
/ L.
-
pH
≠ – log C => [H3O+]
≠ C
La solution est trop concentrée, il faut tenir
compte de l'activité de
l'ion hydronium.
► Si
1,0
× 10 –6 mol / L <
C < 5,0
×
10 –2 mol / L. -
pH
≈ – log C => [H3O+]
≈ C |
![]() Application 5 :
Application 5 :
- Prenons
le cas ou C = 1,0
× 10 –2 mol / L
- De la
valeur de la concentration, on déduit :
- [Cl–]
= C = 1,0
×
10 –2 mol / L
- De la
valeur du pH,
on tire :
-
pH = 2,0
- Par
définition :
- pH
= - log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+] = 10
– 2,0 mol.L–1
-
[H3O+]
≈ 1,0
× 10 –2 mol / L.
- De la
valeur du produit ionique de l'eau, on peut déduire :
-
pKe = 14 =>
[OH–] = 10 pH –
pKe mol.L–1
-
[OH –] =
10 2 –
14 mol.L–1
-
[OH –] ≈ 1,0
×
10–12 mol.L–1
-
électroneutralité : [H3O+]
= [OH –] + [Cl–].
- Les ions hydroxyde proviennent de l'autoprotolyse de l'eau.
- Ils sont ultra minoritaires.
- Lors de la dissolution, il y a deux réactions chimiques en compétition :
-
HCl +
H2O
→ H3O+
+ Cl – (1) réaction prépondérante
- 2
H2O
= H3O+
+ OH – (2) réaction que l'on peut négliger
► Remarque : Si la solution est trop diluée :
-
C < 1,0
×10 –6 mol / L => pH ≠ –
log C => [H3O+]
≠ C
- La réaction du chlorure d'hydrogène avec l'eau est toujours totale mais, on ne peut plus négliger la réaction l'autoprotolyse de l'eau.
|
|
VI- Valeur du pH d'une solution aqueuse d'hydroxyde de sodium.
1)- Préparation de la solution.
- L'hydroxyde de sodium appelé aussi soude caustique est un solide blanc très soluble dans l'eau.
- Un litre d'eau peut dissoudre 1080 g de soude à 25° C. La dissolution est très exothermique. Lors de la dissolution, il peut y avoir ébullition de la solution ce qui peut entraîner des projections.
- La réaction avec l'eau est totale.
- équation bilan : NaOH s → Na+ + OH– Écriture simplifiée.
- Ou : NaOH s → Na+ (aq) + OH–(aq)
- Écriture simplifiée.
- Remarque : la molécule NaCl n'existe pas, l'écriture [NaCl] n'a pas de sens.
- NaCl est une formule statistique, on est en présence d'un cristal ionique.
- Une solution de soude, de concentration C, a une concentration en ion sodium : [Na+] = C.
- Tableau :
|
Concentration
de la solution
en mol / L |
10 –1 |
10 –2 |
10 –3 |
10 –4 |
10 –5 |
10 –6 |
10 –7 |
10 –8 |
10
–9 |
|
pH |
12,9 |
12,0 |
11,0 |
10,0 |
9,00 |
8,00 |
7,2 |
7,02 |
7,00 |
|
– log C |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
- Application 6 :
- Une solution de soude de
concentration C =
1,0
×
10 –2 mol / L
a un pH =
12.
- Que peut-on déduire de
cette valeur ?
- Concentration des ions
sodium : [Na+] = C= 1,0
×
10 –2 mol / L
- De la mesure du
pH, on peut déduire
la concentration des ions hydronium :
-
pH = 12
- Par
définition :
- pH
= – log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+] = 10
– 12 mol.L–1
-
[H3O+]
≈ 1,0
× 10 –12 mol / L.
- Du
produit ionique de l'eau, on peut déduire la concentration des ions hydroxyde.
-
pKe = 14 =>
[OH –] = 10 pH
– pKe mol.L–1
-
[OH–] =
10 12
– 14 mol.L–1
-
[OH–] ≈ 1,0
×
10 –2 mol.L–1
-
électroneutralité : [Na+]
+ [H3O+]
= [OH
–]
- L'ion hydronium est une espèce ultra minoritaire, elle peut être négligée devant les autres espèces.
- Pour cette concentration, on peut négliger la réaction d'autoprotolyse de l'eau devant la réaction de dissolution de l'hydroxyde de sodium.
- La réaction de dissolution de l'hydroxyde de sodium dans l'eau est prépondérante dans ce cas.
-
[Na+] ≈
[OH –]
|
|
VII- Application. Exercices 10, 12, 17 page 95 et page 96.