|
QCM N° 09 |
Temps, cinétique chimique et catalyse. |
|
|
|
|
Temps, cinétique chimique et catalyse
Temps et cinétique
chimique : Pour chaque question, indiquer la (ou
les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Les réactions suivantes
sont rapides : |
Fermentation alcoolique
des sucres. |
Combustion de l’essence dans un moteur
thermique. |
Réaction entre les ions cuivre II Cu2+ (aq) et les ions hydroxyde
HO– (aq) |
BC |
|
2 |
Les réactions chimiques
suivantes
sont lentes : |
Formation de
la
rouille. |
Précipitation du chlorure
d’argent AgCl (s) |
Formation des stalactites dans
les grottes. |
AC |
|
3 |
Généralement, la rapidité d’évolution d’un système
augmente lorsque : |
La concentration des produits
croît. |
La concentration des réactifs
diminue. |
La concentration des réactifs
augmente. |
C |
|
4 |
Le dégagement de dihydrogène dans la réaction d’équation :
est d’autant plus
rapide, lorsque : |
Le métal fer
est en
poudre. |
Le métal fer
est en
plaque. |
Les ions H+ (aq)
sont concentrés. |
AC |
|
5 |
Généralement, la rapidité
d’évolution d’un système : |
Ne dépend pas de la
température. |
Croît lorsque la température
augmente. |
Diminue lorsque l’avancement
du système croît. |
BC |
|
6 |
Un catalyseur : |
Accélère
une
réaction. |
Figure dans l’équation de
la réaction. |
Diminue le temps de
demi-réaction. |
AC |
|
7 |
Les ions fer III Fe3+ (aq) et le platine Pt (s) catalysent la
réaction d’équation : O2
(g) + 2 H2O
(ℓ) |
La catalyse par le platine est une catalyse
hétérogène. |
La catalyse par les ions fer III Fe3+ (aq) est une catalyse
hétérogène. |
La catalyse par les ions fer III Fe3+ (aq) est une
catalyse homogène. |
AC |
|
8 |
L’amylase est une enzyme, présente dans la salive, qui accélère l’hydrolyse des
sucres lents. |
L’amylase est
un
catalyseur. |
Il est nécessaire de connaître sa formule pour écrire l’équation de
cette
hydrolyse. |
L’hydrolyse des sucres lents est impossible
sans amylase. |
A |
|
9 |
La durée tf
d’une réaction : |
Peut être définie en utilisant
l’avancement. |
Nécessite de connaître le
réactif limitant. |
Ne nécessite pas de connaître le
réactif limitant. |
AB |
|
10 |
Le temps de demi-réaction t1/2 et la durée d’une réaction tf
sont
généralement tels que : |
tf
≥ 2 t1/2
|
tf
= 2 t1/2 |
tf
< 2 t1/2 |
A |
|
11 |
Soit xmax l’avancement maximal d’un système ; pour t = t1/2, l’avancement
noté x1/2
est tel que : |
x1/2
= 2 xmax |
|
xmax > 2 x1/2 |
B |
|
12 |
Le graphique ci-dessous représente l’évolution des quantités de matière en fonction du temps lors de
la réaction
d’équation :
La courbe rouge est la
courbe
de quantité de matière : |
Du méthanol CH3OH |
Du chlorométhane CH3Cl |
Du chlorure d’hydrogène HCl |
B |
|
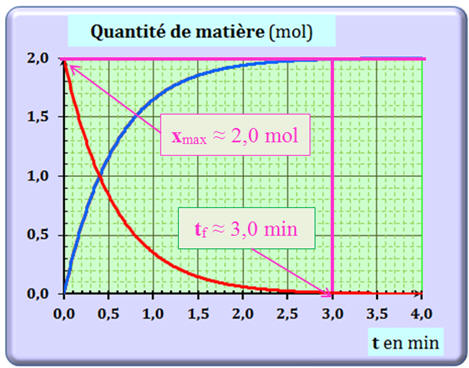
13 |
À partir du graphique de la question précédente, la durée tf de la transformation est définie par un expérimentateur comme la durée pour laquelle l’avancement x de la transformation est égal à
2,0 mol.
Alors : |
tf
≈ 0,10 min |
tf
≈ 1,4 min |
tf
≈ 3,0 min |
C |
|
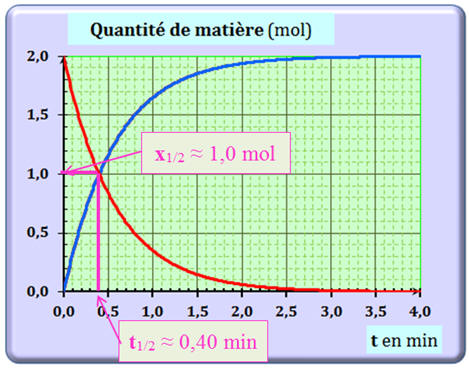
14 |
En utilisant le graphique de la question précédente, le temps de demi-réaction t1/2 de cette
transformation est égal à : |
0,40 min |
0,90 min |
3,0 min |
A |
►
Réactions rapides : 1
-
Une réaction chimique est rapide
si sa durée est inférieure à la seconde.
-
On ne peut pas observer
l’évolution de la réaction à l’œil, elle semble achevée dès que
les réactifs entrent en contact.
-
C’est le cas de certaines
réactions de précipitation. La formation du précipité se fait
instantanément.
►
Réactions lentes : 2
-
Une réaction est lente si sa
durée est de l'ordre de quelques secondes à plusieurs minutes.
-
On peut observer l'évolution de
la réaction.
►
Cas des solides : 3
-
La réaction est d’autant plus
rapide que la surface de contact entre les réactifs est
importante.
-
Pour faire réagir le soufre et le
fer, on prend du fer et du soufre en poudre.
-
On les mélange intimement et pour
amorcer la réaction, on crée un point chaud. Il faut initier la
réaction chimique.
-
Le facteur cinétique essentiel
pour un réactif solide est l’étendue de sa surface de contact
avec les autres réactifs.
►
Concentration des réactifs : 3 et
4
-
De façon générale,
-
L’évolution d’un système chimique
est d’autant plus rapide que les concentrations des réactifs
sont élevées.
►
Influence de la température : 5
-
La température d’un mélange
réactionnel est un facteur cinétique.
-
De façon générale,
-
L’évolution d’un système chimique
est d’autant plus rapide que la température du mélange
réactionnel est élevée.
►
Concentration des réactifs : 5
-
Au
cours du
temps,
l’avancement de la réaction augmente et la concentration des
réactifs diminue. La rapidité d’évolution des systèmes diminue
lorsque la concentration des réactifs diminue.
►
Caractéristiques d’un catalyseur :
6
-
Un catalyseur est une espèce
chimique qui accélère une réaction chimique.
-
La formule du catalyseur
n’apparaît pas dans l’équation de la réaction.
-
Un catalyseur modifie la nature
des étapes permettant de passer des réactifs aux produits.
-
La réaction globale lente est
remplacée par plusieurs réactions rapides.
►
Action d’un catalyseur : 7
►
Catalyse homogène : 7
-
La catalyse est dite homogène
lorsque le catalyseur et le mélange réactionnel constituent une
seule phase (forment un mélange homogène). C’est le cas des gaz
et des liquides miscibles.
-
Exemples : dismutation de l’eau
oxygénée en présence d’ions fer II ou d’ions fer III.
|
Dismutation |
Réaction d'oxydoréduction au cours de laquelle une espèce chimique joue à la fois le rôle d'oxydant et de réducteur (ici l'eau oxygénée H2O2 (aq))
H2O2
(aq) /
H2O |
►
Catalyse hétérogène : 7
-
La catalyse est dite hétérogène
lorsque le catalyseur et le milieu réactionnel se trouvent dans
des phases différentes.
-
Dismutation de l’eau oxygénée
catalysée par un fil de platine.
►
Catalyse enzymatique : 8
-
La catalyse est enzymatique
lorsque le catalyseur et une enzyme.
-
Les enzymes sont des catalyseurs
biologiques qui permettent aux transformations chimiques
nécessaires à la vie de s’effectuer à vitesse élevée.
-
Un catalyseur n’accélère que les
réactions qui sont possibles.
-
L’hydrolyse des sucres lents est
possible sans amylase, mais la réaction est très lente.
►
Durée d’une réaction : 9
-
La durée d’une réaction chimique
est le temps tf nécessaire à la consommation
totale du réactif limitant.
-
Pour
t =
tf,
l’avancement x atteint la valeur maximale
xmax.
-
La durée
tf
d’une réaction nécessite de connaître le réactif limitant.
►
Temps de demi-réaction : 10
-
Le temps de demi-réaction, noté
t1/2,
est la durée nécessaire à la disparition de la moitié du réactif
limitant.
-
Pour
t =
t1/2,
l’avancement, noté
x1/2,
a atteint la moitié de sa valeur maximale
xmax.
►
Temps de réaction : 10
-
L’expérience montre qu’un système
siège d’une réaction caractérisée par le temps de réaction
t
1/2 cesse pratiquement d’évoluer au bout
d’une durée de l’ordre de quelques
t
1/2 (4 à 7 suivant la précision
recherchée).
-
4
t1/2
≤ tf
≤
7
t1/2
-
Le temps de demi-réaction permet
d’évaluer la durée nécessaire à l’achèvement de la
transformation chimique étudiée.
►
Temps de demi-réaction
t1/2 :
11
-
Pour
t =
t1/2,
l’avancement, noté
x1/2,
a atteint la moitié de sa valeur maximale
xmax.
-

►
Courbe : 12

►
Réaction chimique : 12
CH3Cl + HO− → CH3OH + HCl
-
Au cours d’une réaction chimique,
les réactifs disparaissent et les produits se forment.
-
Au cours de la réaction, la
quantité de matière de chlorométhane
CH3Cl diminue au cours du temps.
►
Détermination graphique du temps
de réaction tf :
13
►
Détermination graphique du temps
de demi-réaction
t1/2 :
14
-
Sachant que
xmax
≈ 2,0 mol, on en déduit que
x1/2 ≈
1,0 mol.
-
Par lecture graphique, on peut en
déduire que :
t1/2 ≈
0,40 min.
|
|


