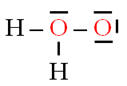|
QCM N° 06 b |
Des atomes aux molécules |
|
|
|
|
QCM N° 05 C: Des atomes aux molécules
Pour chaque question,
indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’atome de carbone C (Z = 6) forme : |
6 liaisons
covalentes. |
4 liaisons
covalentes. |
2 liaisons
covalentes |
B |
|
2 |
La molécule de peroxyde d’hydrogène H2O2 a pour représentation de Lewis : |
|
|
|
B |
|
3 |
La molécule de diazote N2 a pour représentation de Lewis : |
|
|
|
A |
|
4 |
La molécule d’acétylène a pour représentation de Lewis : |
|
|
|
C |
|
5 |
Dans la molécule de méthanal, les atomes de carbone et d’oxygène :
|
mettent en commun
2
électrons. |
sont liés par une
double
liaison. |
respectent la règle
de
l’octet |
BC |
|
6 |
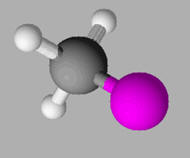
La molécule de fluorométhane est modélisée ci-dessous.
Cette molécule est :
|
plane. |
triangulaire. |
pyramidale. |
C |
|
7 |
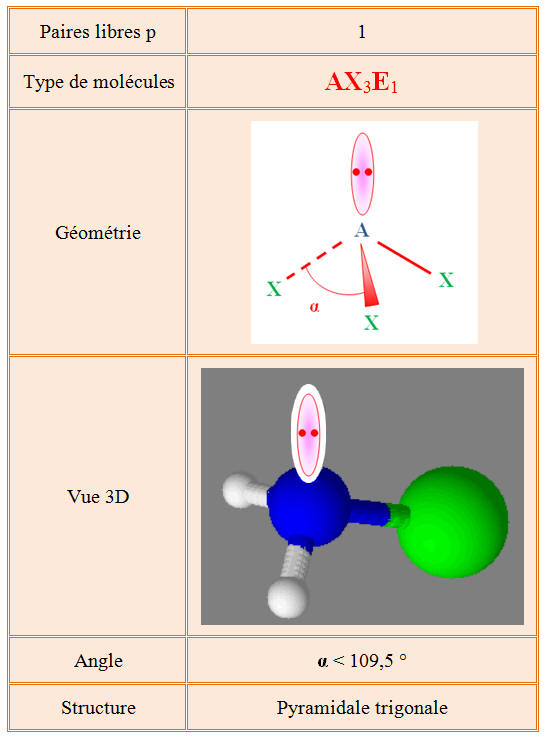
La molécule de chloramine, modélisée ci-dessous est :
|
plane. |
triangulaire. |
pyramidale. |
C |
|
8 |
La géométrie de la molécule de chloramine est due à la répulsion :
|
entre les doublets liants et le doublet non liant de l’atome
d’azote
N. |
entre les
atomes. |
entre les doublets liants
uniquement. |
A |
|
9 |
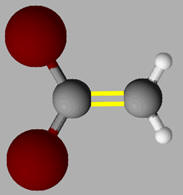
Pour la molécule de 1,1 – dibromoéthène modélisée ci-dessous :
|
une isomérie Z / E
est
possible. |
une isomérie Z / E n’est pas
possible. |
la rotation autour de la double liaison C = C n’est pas
possible. |
BC |
|
10 |
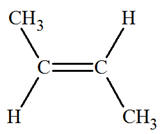
Pour la molécule de but-2-ène, modélisée ci-dessous,
|
une isomérie Z / E
est
possible. |
une isomérie Z / E
n’est
pas possible. |
une isomérisation photochimique
est possible. |
AC |
►
Nombre de liaisons covalentes l’atome de
carbone C :
-
Pour l’atome de carbone, Z = 6
-
Configuration électronique :
K2L4
-
La liaison covalente consiste à la mise en
commun par deux atomes d’un ou plusieurs doublets d’électrons appelés
doublets de liaison ou doublets liants.
-
Le nombre de liaisons covalentes qu’établit
un atome est généralement égal au nombre d’électrons qui lui manque pour
acquérir une structure électronique en
OCTET
ou DUET.
-
En conséquence, l’atome de carbone peut
mettre en commun les 4 électrons (règle de l’Octet : 4 + 4) de la couche
L.
-
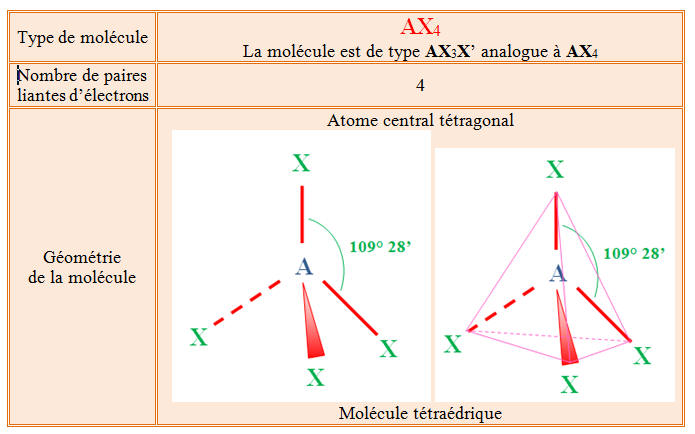
Il peut former 4 liaisons covalentes.
►
Tableau ; cas des atomes que l’on rencontre
souvent
|
Atome |
H |
C |
N |
O |
Cl |
|
Numéro atomique Z |
1 |
6 |
7 |
8 |
17 |
|
Formule électronique |
K1 |
K2 L4 |
K2 L5 |
K2 L6 |
K2 L8
M7 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
4 |
3 |
2 |
1 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
4 |
3 |
2 |
1 |
|
Nombre de doublets non
liants |
0 |
0 |
1 |
2 |
3 |
►
Représentation de
LEWIS.
-
La représentation de
LEWIS
précise l’enchaînement des atomes et la position des doublets liants et non
liants.
-
Dans la représentation de
LEWIS
d’une molécule :
-
Le symbole de l’élément représente le noyau
de l’atome et les électrons internes,
-
Chaque doublet d’électrons externes est
figuré par un tiret.
-
On distingue les doublets liants et les
doublets non liants :
-
Un doublet liant est représenté par un tiret
entre les symboles de deux atomes,
-
Un doublet non liant est représenté par un
tiret situé autour du symbole d’un atome auquel il appartient.
►
La molécule de peroxyde d’hydrogène
H2O2 :
-
Atome d’hydrogène :
-
Pour l’atome d’hydrogène, Z = 1.
-
Configuration électronique :
K1
-
Le nombre de liaisons covalentes qu’établit
un atome est généralement égal au nombre d’électrons qui lui manque pour
acquérir une structure électronique en
OCTET
ou DUET.
-
En conséquence, l’atome d’hydrogène peut
mettre en commun 1 électron (règle du DUET : 1 + 1) de la couche
K.
-
Il peut former 1 liaison covalente.
-
Atome d’oxygène :
-
Pour l’atome d’oxygène,
Z = 8
-
Configuration électronique :
K2L6
-
La liaison covalente consiste à la mise en
commun par deux atomes d’un ou plusieurs doublets d’électrons appelés
doublets de liaison ou doublets liants.
-
Le nombre de liaisons covalentes qu’établit
un atome est généralement égal au nombre d’électrons qui lui manque pour
acquérir une structure électronique en
OCTET
ou DUET.
-
En conséquence, l’oxygène peut mettre en
commun les 2 électrons (Règle de l’Octet : 6 + 2) de la couche
L.
-
Chaque atome d’oxygène, de la molécule de
peroxyde d’hydrogène possède 2
doublets liants et 2 doublets non liants.
|
Atome |
H |
O |
|
Numéro atomique Z |
1 |
8 |
|
Formule électronique |
K1 |
K2 L6 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
2 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
2 |
|
Nombre de doublets non liants |
0 |
2 |
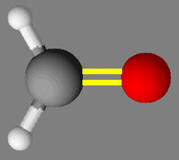
► Molécule de diazote
N2 :
-
Pour l’atome d’azote,
Z = 7
-
Configuration électronique :
K2L5
-
La liaison covalente consiste à la mise en
commun par deux atomes d’un ou plusieurs doublets d’électrons appelés
doublets de liaison ou doublets liants.
-
Le nombre de liaisons covalentes qu’établit
un atome est généralement égal au nombre d’électrons qui lui manque pour
acquérir une structure électronique en
OCTET
ou DUET.
-
En conséquence, l’azote peut mettre en commun
les 3 (Règle de l’Octet : 5 + 3) électrons de la couche
L.
-
Chaque atome d’azote, de la molécule de
diazote possède 3 doublets
liants et un doublet non liant.
|
Atome |
N |
|
Numéro atomique Z |
7 |
|
Formule électronique |
K2 L5 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
3 |
|
Nombre de doublets liants formés pour chaque atome |
3 |
|
Nombre de doublets non liants |
1 |
►
La molécule d’acétylène :
-
Atome d’hydrogène :
-
Pour l’atome d’hydrogène, Z = 1.
-
Configuration électronique :
K1
-
Le nombre de liaisons covalentes qu’établit
un atome est généralement égal au nombre d’électrons qui lui manque pour
acquérir une structure électronique en
OCTET
ou DUET.
-
En conséquence, l’atome d’hydrogène peut
mettre en commun 1 électron (règle du DUET : 1 + 1) de la couche
K.
-
Il peut former 1 liaison covalente.
-
Pour l’atome de carbone, Z = 6
-
Configuration électronique :
K2L4
-
La liaison covalente consiste à la mise en
commun par deux atomes d’un ou plusieurs doublets d’électrons appelés
doublets de liaison ou doublets liants.
-
Le nombre de liaisons covalentes qu’établit
un atome est généralement égal au nombre d’électrons qui lui manque pour
acquérir une structure électronique en
OCTET
ou DUET.
-
En conséquence, l’atome de carbone peut
mettre en commun les 4 électrons (règle de l’Octet : 4 + 4) de la couche
L.
|
Atome |
H |
C |
|
Numéro atomique Z |
1 |
6 |
|
Formule électronique |
K1 |
K2 L4 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
4 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
4 |
|
Nombre de doublets non liants |
0 |
0 |
►
La molécule de méthanal :
|
Atome |
H |
C |
O |
|
Numéro atomique Z |
1 |
6 |
8 |
|
Formule électronique |
K1 |
K2 L4 |
K2 L6 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
4 |
2 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
4 |
2 |
|
Nombre de doublets non liants |
0 |
0 |
2 |
-
Les atomes de carbone et d’oxygène mettent en
commun 4 électrons et respectent la règle de l’Octet.
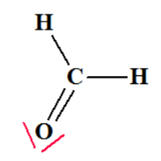
-
Chaque atome d’hydrogène respecte la règle du
Duet.
►
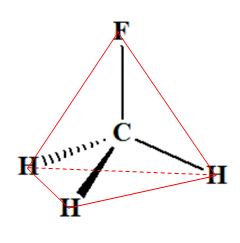
Molécule de fluorométhane :
|
Atome |
H |
C |
F |
|
Numéro atomique Z |
1 |
6 |
9 |
|
Formule électronique |
K1 |
K2 L4 |
K2 L7 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
4 |
1 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
4 |
1 |
|
Nombre de doublets non liants |
0 |
0 |
3 |
-
La molécule de fluorométhane est pyramidale.
CH3F
 ou
ou
- Représentation Schématique :
►
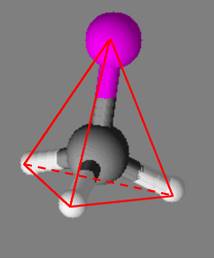
Molécule de chloramine :
|
Atome |
H |
N |
Cl |
|
Numéro atomique Z |
1 |
7 |
17 |
|
Formule électronique |
K1 |
K2 L5 |
K2 L8
M7 |
|
Nombre d’électron manquant à l’atome Pour acquérir une structure stable |
1 |
3 |
1 |
|
Nombre de doublets liants formés pour chaque atome |
1 |
3 |
1 |
|
Nombre de doublets non liants |
0 |
1 |
3 |
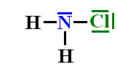
-
C’est une molécule pyramidale.
►
Isomérie :
Définition.
-
Deux molécules isomères ont même formule
brute mais des enchaînements d’atomes différents.
-
Les isomères ont des propriétés physiques et
chimiques différentes et constituent des espèces chimiques distinctes.
►
Formule brute.
-
La formule brute d’une molécule indique la
nature et le nombre des atomes constituant la molécule.
-
Elle ne donne aucune indication sur la
structure de la molécule : chaîne carbonée, groupe fonctionnel,…
►
La formule développée plane.
-
Elle indique
l’enchaînement des atomes et la nature des liaisons qui les unissent.
►
Formule semi-développée.
-
Elle dérive de la formule développée. Elle ne
fait pas apparaître les liaisons entre un atome d’hydrogène et un autre
atome.
►
Formule topologique.
-
La chaîne carbonée est
représentée sous forme de ligne brisée. Les atomes autres que de carbone C
et d’hydrogène H sont représentés de manière explicite ainsi
que les atomes d’hydrogène H qu’ils portent.
►
Les isomères de constitution :
-
Les isomères de constitution sont des
molécules qui ont la même formule brute mais qui différent par
l’enchaînement de leurs atomes.
-
Parmi les isomères de constitution, on
distingue :
-
Les isomères de chaîne : les chaînes
carbonées sont différentes.
-
Les isomères de position : la position du
groupe fonctionnel ou de la double liaison sont différentes.
-
Les isomères de fonction : les groupes
fonctionnels sont différents.
►
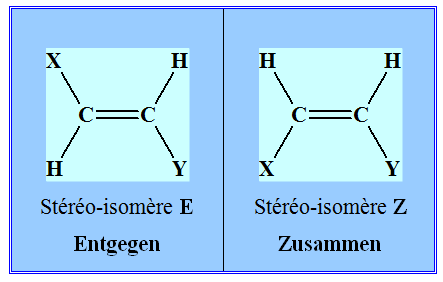
L’isomérie Z et
E ou stéréo-isomérie.
-
Si, dans un alcène de formule générale
CHX=CHY, les deux atomes d’hydrogène sont dans le même demi-plan par
rapport à l’axe de la double liaison C=C, le stéréo-isomère est
Z,
dans le cas contraire, il est E.
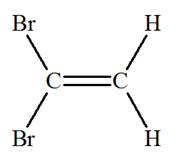
-
La molécule de 1,1 – dibromoéthène,
représentée ci-dessous, ne présente pas d’isomérie
Z /
E. Les
deux atomes de brome Br sont portés par le même atome de carbone.
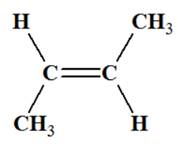
-
La molécule de but-2-ène, représentée
ci-dessous, est celle de l’isomère E.
-
La molécule de formule semi-développée,
CH3–CH=CH–CH3,
représente deux isomères Z /
E.
 et
et 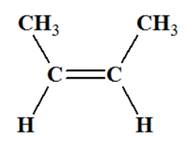
|
|