|
QCM N° 06 |
Atomes et Molécules. |
|
|
|
|
QCM N° 06 : Atomes et Molécules.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
Énoncé |
A |
B |
C |
R |
|
|
1 |
Les gaz nobles : |
Sont quasiment inerte chimiquement |
Possèdent tous un octet électronique |
Ont leur couche externe saturée |
AC |
|
2 |
Combien de liaisons covalentes l’atome de carbone C (Z = 6) forme-t-il ? |
6 |
4 |
2 |
B |
|
3 |
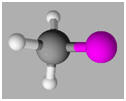
L’atome d’hydrogène H et l’atome d’oxygène O ont pour numéros atomiques respectifs 1 et 8. La molécule d’eau H2O a pour représentation de Lewis : |
|
|
|
C |
|
4 |
L’atome de carbone C et l’atome d’oxygène O ont pour numéros atomiques respectifs 6 et 8. La molécule de dioxyde de carbone CO2 a pour représentation de Lewis : |
|
|
|
B |
|
5 |
L’atome d’azote N a pour numéro atomique Z = 7. La molécule de diazote N2 a pour formule de Lewis : |
|
|
|
A |
|
6 |
Dans la molécule de méthanal, les atomes de carbone (Z = 6) et d’oxygène (Z = 8) :
|
Mettent en commun 2 électrons |
Mettent en commun 4 électrons |
Respectent la règle de l’octet |
BC |
|
7 |
La molécule de fluorométhane est :
|
plane |
Triangulaire |
pyramidale |
C |
|
8 |
La molécule de chloramine est :
|
plane |
Triangulaire |
pyramidale |
C |
|
9 |
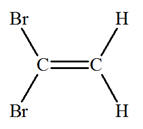
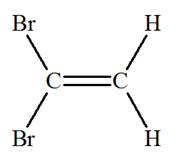
La molécule de 1,1 – dibromoéthène représentée ci-dessous :
|
Est celle de l’isomère Z |
Est celle de l’isomère E |
Ne présente pas d’isomérie Z / E. |
C |
|
10 |
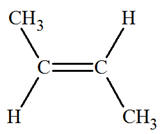
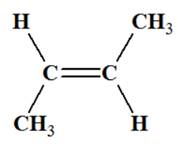
La molécule de but-2-ène représentée ci-dessous :
|
Est celle de l’isomère Z |
Est celle de l’isomère E |
Ne présente pas d’isomérie Z / E. |
B |
|
11 |
L’atome d’oxygène (Z = 8) possède : |
6 électrons de valence |
8 électrons de valence |
2 électrons de valence |
A |
|
12 |
L’atome d’oxygène forme :
|
4 liaisons covalentes |
2 liaisons covalentes |
8 liaisons covalentes |
B |
|
13 |
La formule de Lewis d’une molécule est la représentation : |
Des liaisons entre les atomes |
Des atomes de la molécule et de leurs électrons de valence regroupés en
doublets |
Des doublets liants de la molécule |
B |
|
14 |
Dans la molécule de méthane CH4, l’atome de carbone est au : |
Centre d’un carré dont les atomes d’hydrogène sont aux sommets |
Sommet d’une pyramide dont les atomes d’hydrogène sont les sommets |
Centre d’un tétraèdre dont les atomes d’hydrogène sont les sommets |
C |
|
15 |
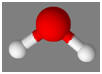
La représentation dans l’espace de la molécule d’eau est : |
|
|
|
A |
|
16 |
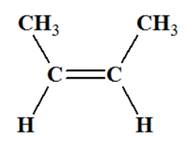
On considère la molécule de formule semi-développée :
CH3–CH=CH–CH3. Cette formule : |
Représente deux isomères
Z / E |
Représente quatre isomères
Z / E |
Ne représente pas d’isomérie
Z / E |
A |
►
Les gaz nobles.
- Les gaz rares ou nobles sont chimiquement très stables.
- Alors que les autres atomes peuvent participer à des réactions chimiques, former des ions, les gaz nobles ou rares, ne sont pas impliqués dans de telles transformations chimiques.
- Cette stabilité est liée au fait que leur dernière couche électronique (couche électronique externe) est saturée (pleine).
- Exemple : la couche électronique externe de l’hélium He contient 2 électrons (couche K qui est saturée à 2 électrons.
- Les autres gaz rares possèdent 8 électrons sur leur couche électronique externe.
- On parle de structure en DUET : atome ou ion qui possède 2 électrons sur sa couche électronique externe (K).
- Et de structure en OCTET : atome ou ion qui possède 8 électrons sur sa couche électronique externe.
►
Règles du
DUET et de OCTET :
- Au cours des transformations chimiques, les atomes tendent à acquérir la structure électronique du gaz rare de numéro atomique le plus proche :
- Soit 2 électrons sur la couche électronique externe lorsque ce gaz rare est Hélium c’est la règle du DUET.
- Soit 8 électrons sur la couche électroniques externe, c’est la règle de l’OCTET.
- Ils acquièrent de ce fait une stabilité maximale.
►
Molécules :
- Une molécule est une entité chimique électriquement neutre Elle est formée d’un nombre limité d’atomes liés entre eux par des liaisons de covalence.
- Le nombre d’atomes d’une molécule est son atomicité.
- Dans la formule d’une molécule, les symboles des éléments présents dans la molécule sont écrits côte à côte avec, en indice, en bas à droite, le nombre d’atomes de chaque élément.
- L’indice 1 n’est jamais spécifié.
- La nature et le nombre des atomes présents dans une molécule sont donnés par sa formule brute.
►
La liaison
covalente.
- Lorsqu’ils forment des molécules, les atomes mettent en commun certains des électrons de leurs couches électroniques externes de façon à s’entourer de 2 ou 8 électrons.
- En conséquence, dans une molécule, les atomes sont liés par des liaisons covalentes ou des liaisons de covalence.
- La liaison covalente consiste à la mise en commun par deux atomes d’un ou plusieurs doublets d’électrons appelés doublets de liaison ou doublets liants.
- Remarque : les électrons mis en commun appartiennent à chacun des deux atomes et doivent être pris en compte dans le total des électrons de chaque atome.
- En formant des liaisons de covalence, chaque atome acquiert, en général, une structure électronique en octet ou en DUET, semblable à celle du gaz noble qui le suit dans la classification périodique.
- Le nombre de liaisons covalentes qu’établit un atome est généralement égal au nombre d’électrons qui lui manque pour acquérir une structure électronique en OCTET ou DUET.
►
Nombre de
liaisons covalentes l’atome de carbone C :
-
Pour l’atome de carbone,
Z = 6
-
Configuration électronique :
K2L4
-
La liaison covalente consiste à
la mise en commun par deux atomes d’un ou plusieurs doublets
d’électrons appelés doublets de liaison ou doublets liants.
-
Le nombre de liaisons covalentes
qu’établit un atome est généralement égal au nombre d’électrons
qui lui manque pour acquérir une structure électronique en
OCTET ou
DUET.
-
En conséquence, l’atome de
carbone peut mettre en commun les 4 électrons (règle de
l’Octet : 4 + 4) de la couche
L.
-
Il peut former 4 liaisons
covalentes.
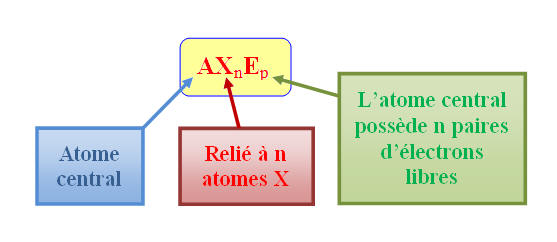
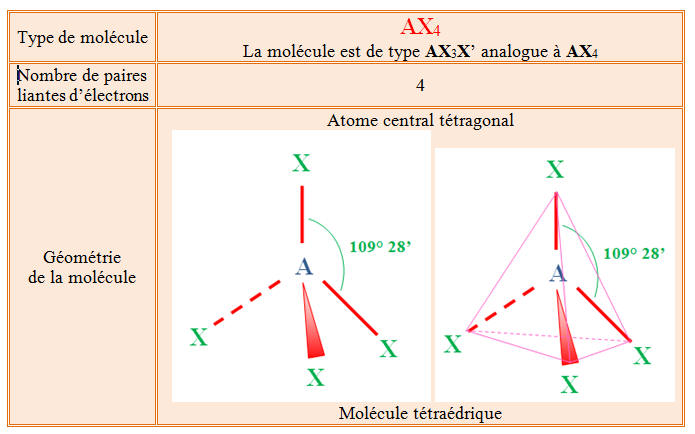
► Méthode VSEPR pour la géométrie des molécules.
►
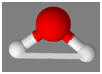
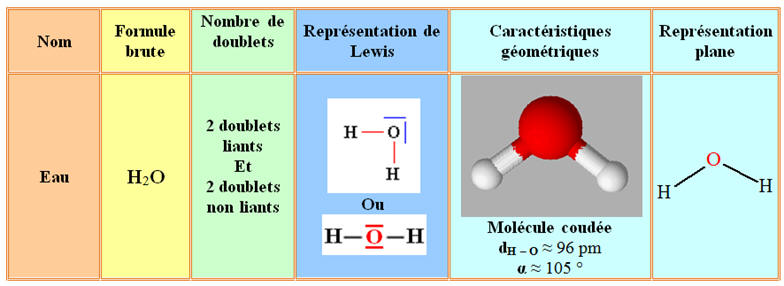
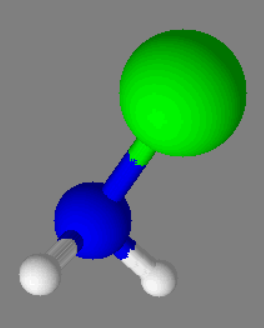
La molécule d’eau :
►
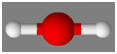
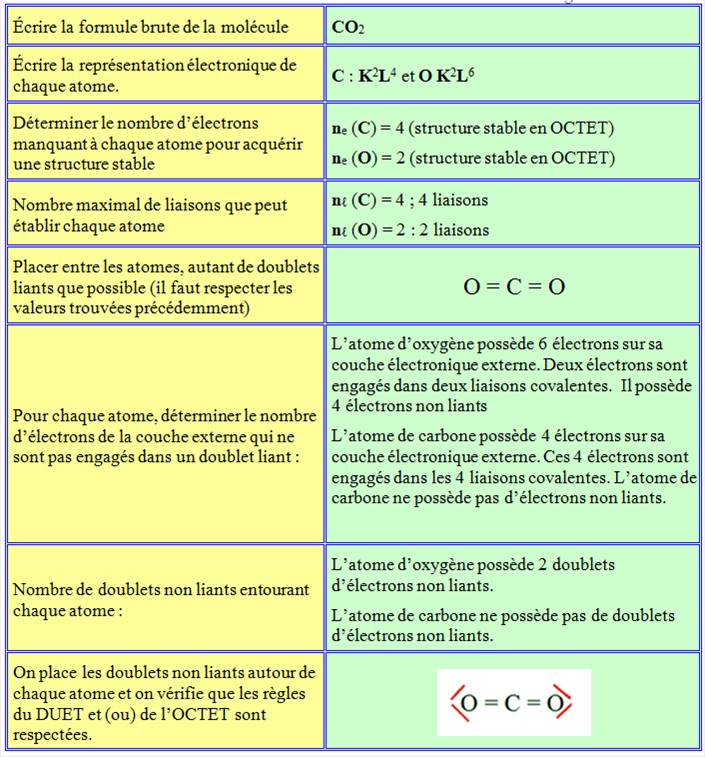
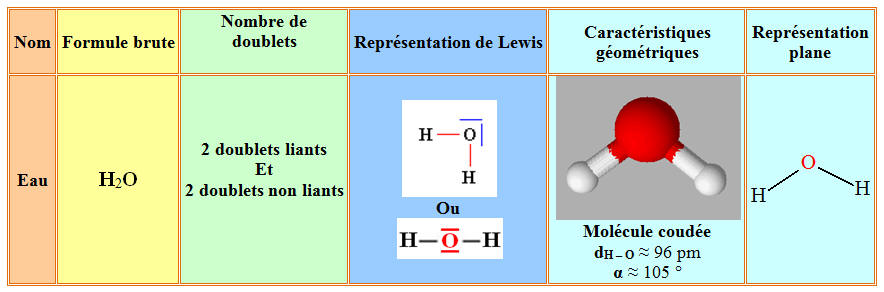
La molécule de
dioxyde de carbone CO2 :
►
Molécule de
diazote N2 :
-
Pour l’atome d’azote, Z =
7
-
Configuration électronique :
K2L5
-
La liaison covalente consiste à
la mise en commun par deux atomes d’un ou plusieurs doublets
d’électrons appelés doublets de liaison ou doublets liants.
-
Le nombre de liaisons covalentes
qu’établit un atome est généralement égal au nombre d’électrons
qui lui manque pour acquérir une structure électronique en
OCTET ou
DUET.
-
En conséquence, l’azote peut
mettre en commun les 3 (Règle de l’Octet : 5 + 3) électrons de
la couche
L.
-
Chaque atome d’azote, de la
molécule de diazote
possède 3 doublets liants et un doublet non liant.

►
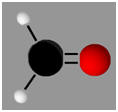
La molécule de
méthanal :
-
Les atomes de carbone et
d’oxygène mettent en commun 4 électrons et respectent la règle
de l’Octet.
-
Chaque atome d’hydrogène respecte
la règle du Duet.
►
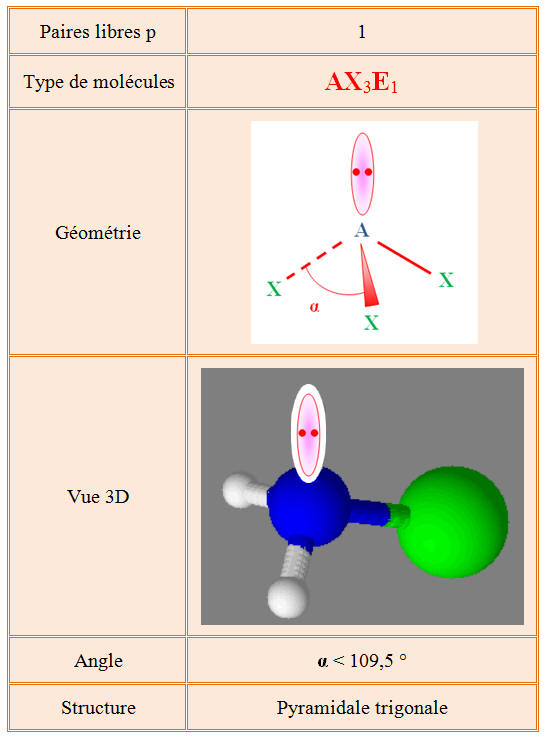
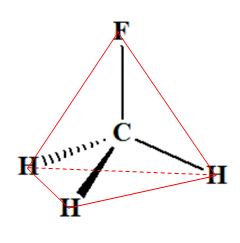
Molécule de
fluorométhane :
-
La molécule de fluorométhane est
pyramidale.
CH3F
 ou
ou
- Représentation schématique :
►
Molécule de chloramine :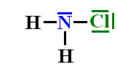
-
C’est une molécule pyramidale.
►
Isomérie :
Définition.
- Deux molécules isomères ont même formule brute mais des enchaînements d’atomes différents.
- Les isomères ont des propriétés physiques et chimiques différentes et constituent des espèces chimiques distinctes.
►
Formule brute.
- La formule brute d’une molécule indique la nature et le nombre des atomes constituant la molécule.
- Elle ne donne aucune indication sur la structure de la molécule : chaîne carbonée, groupe fonctionnel,…
►
La formule développée plane.
- Elle indique l’enchaînement des atomes et la nature des liaisons qui les unissent.
►
Formule
semi-développée.
- Elle dérive de la formule développée.
- Elle ne fait pas apparaître les liaisons entre un atome d’hydrogène et un autre atome.
►
Formule
topologique.
- La chaîne carbonée est représentée sous forme de ligne brisée.
- Les atomes autres que de carbone C et d’hydrogène H sont représentés de manière explicite ainsi que les atomes d’hydrogène H qu’ils portent.
►
Les isomères de
constitution :
- Les isomères de constitution sont des molécules qui ont la même formule brute mais qui différent par l’enchaînement de leurs atomes.
- Parmi les isomères de constitution, on distingue :
- Les isomères de chaîne : les chaînes carbonées sont différentes.
- Les isomères de position : la position du groupe fonctionnel ou de la double liaison sont différentes.
- Les isomères de fonction : les groupes fonctionnels sont différents.
►
L’isomérie Z et E ou stéréo-isomérie.
- Si, dans un alcène de formule générale CHX=CHY, les deux atomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C=C, le stéréo-isomère est Z, dans le cas contraire, il est E.
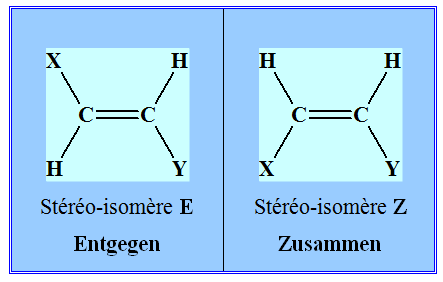
-
La molécule de 1,1 – dibromoéthène,
représentée ci-dessous, ne présente pas d’isomérie
Z /
E.
-
La molécule de but-2-ène, représentée
ci-dessous, est celle de l’isomère
E.
-
La molécule de formule
semi-développée,
CH3–CH=CH–CH3,
représente deux isomères Z /
E.
 et
et
►
L’atome d’oxygène :

-
L’atome d’oxygène possède 6 électrons
sur sa couche électronique externe, il possède 6 électrons de
valence.
-
Il manque deux électrons 2 électrons
à sa couche électronique externe pour acquérir une structure stable
(Octet).
-
L’atome d’oxygène forme 2 liaisons
covalentes.
►
Représentation de
LEWIS.
-
La représentation de
LEWIS
précise l’enchaînement des atomes et la position des doublets liants
et non liants.
-
Dans la représentation de
LEWIS
d’une molécule :
-
Le symbole de l’élément représente le
noyau de l’atome et les électrons internes,
-
Chaque doublet d’électrons externes
est figuré par un tiret.
-
On distingue les doublets liants et
les doublets non liants :
-
Un doublet liant est représenté par
un tiret entre les symboles de deux atomes,
-
Un doublet non liant est représenté
par un tiret situé autour du symbole d’un atome auquel il
appartient.
►
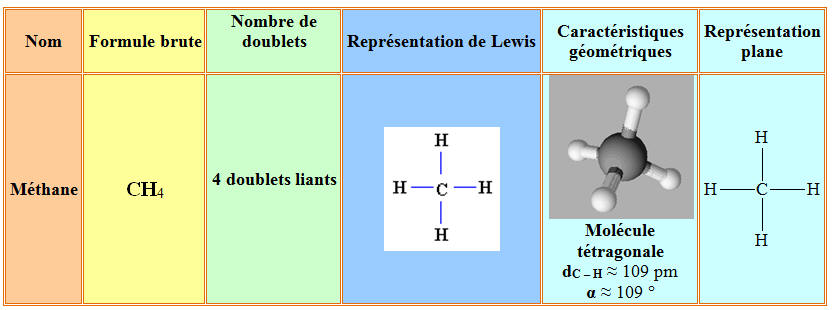
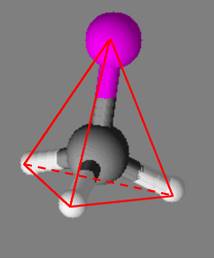
Molécule de
méthane :
-
Dans la molécule de méthane
CH4,
l’atome de carbone est au centre d’un tétraèdre dont les atomes
d’hydrogène sont les sommets.
►
La molécule d’eau :
►
Isomérie Z / E :
(voir au-dessus)
|
|