|
Chim. N° 03 |
Des atomes aux molécules. Exercices. |
|
|
Mots clés : Molécules, gaz nobles, gaz rares, des atomes aux molécules, formation des molécules, stabilité chimiques des gaz nobles, liaison covalente, règles du Duet, règle de l'octet, duet, octet, représentation de Lewis, Lewis, géométrie de molécules, doublets d'électrons, doublets d'électrons liants, doublets d'électrons non liants, méthane, ammoniac, eau, isomérie, Z, isomérie E, zusammen, entgegen, stéréo-isomérie, photo-isomérisation, exercices, QCM, ... |
|
|
I- Exercice 6 page 106. Prévoir le nombre de doublets liants.
|
On donne ci-dessous la formule électronique de certains atomes dans leur état fondamental : a)- Hélium : K2 ; b)- Carbone C : K2L4 ; c)- Fluor : K2L7 ; d)- Néon : K2L8 ; e)- Silicium : K2L8 M4 ; f)- Argon : K2L8 M8. Déterminer le nombre de liaisons covalentes que ces atomes peuvent établir. |
|
- Nombre de liaisons covalentes que ces atomes peuvent établir :
|
II- Exercice 10 page 106. Placer des doublets non liants.
|
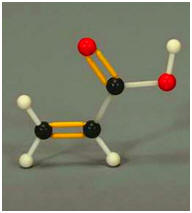
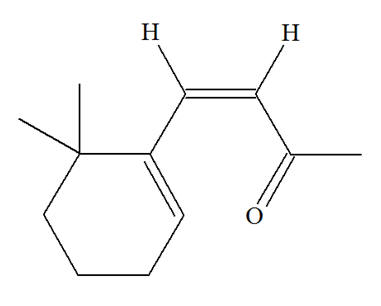
Les acrylates, esters dérivés de l’acide acrylique, sont utilisés dans les peintures acryliques. Ils sont particulièrement visqueux, adhérents et élastiques. Le modèle moléculaire de l’acide acrylique est donné ci-dessous :
1)- Écrire la formule développée de la molécule. 2)- Déterminer la formule électronique des atomes d’hydrogène (Z = 1), de carbone (Z = 6) et d’oxygène (Z = 8). 3)- Pour chaque atome, vérifier s’il respecte la règle de l’octet puis compter le nombre d’électrons éventuellement manquants. 4)- Apparier les électrons non liants en doublets. Les placer sur les atomes en s’assurant que ces derniers respectent la règle du duet ou de l’octet. |
|
5)- Formule développée de la molécule :
6)- Formule électronique de chaque atome :
7)- Règles de l’octet et nombre d’électrons manquants :
8)- Vérification : 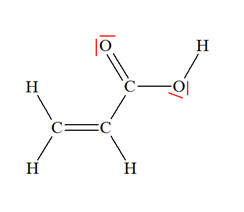
- Chaque atome d’hydrogène H respecte la règle du Duet : - Il forme une seule liaison simple (un doublet liant). Il ne possède aucun doublet non liant. - Chaque atome de carbone C respecte la règle de l’Octet : - Il forme 4 liaisons simples (4 doublets liants). - Il ne possède aucun doublet non liant. - Chaque atome d’oxygène O respecte la règle de l’Octet : - Il forme 2 liaisons simples ou une double liaison. - Chaque atome possède donc : - 2 doublets liants et 2 doublets non liants. |
III- Exercice 11 page 106. Établir des représentations de Lewis.
|
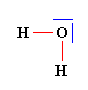
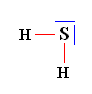
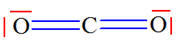
L’eau, le sulfure de dihydrogène H2S, le chlorure d’hydrogène HCl et le dioxyde de carbone CO2 sont naturellement présents dans les gaz volcaniques. Établir la représentation de Lewis de ces quatre molécules connaissant les numéros atomiques des éléments : H
(Z = 1) ; C (Z = 6) ; O
(Z = 8) ; S ( Z = 16) ; Cl
( Z = 17). |
|
Étude de chaque atome :
Représentation de Lewis de chaque molécule :
|
IV- Exercice 14 page 107. Identifier un isomère.
|
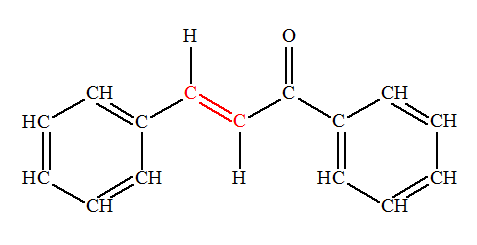
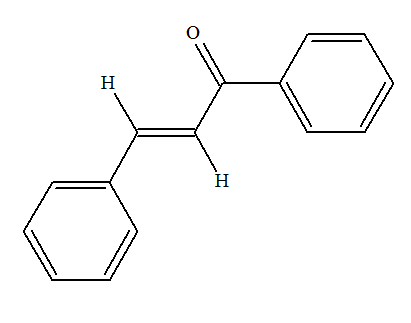
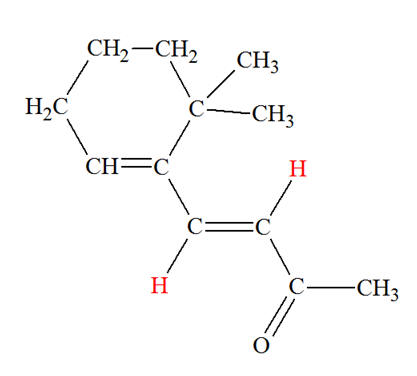
Les chalcones sont des colorants jaunes. Ce sont des intermédiaires réactionnels lors de la biosynthèse des anthocyanes responsables des couleurs bleu, rouge, mauve, rose et orange des pommes, du miel, du raisin, etc. Dans la molécule de chalcone représentée ci-dessous la liaison C = C coloriée en rouge présente-t-elle une isomérie Z ou E ?
|
|
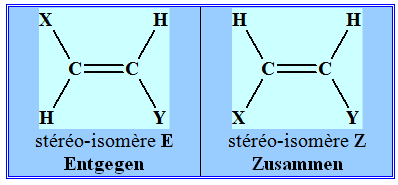
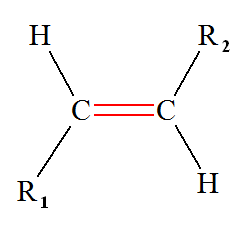
Isomérie Z ou E : - Si, dans un alcène de formule générale CHX = CHY, les deux atomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C = C, le stéréo-isomère est Z, dans le cas contraire, il est E.
- Dans le cas présent, les deux atomes d’hydrogène ne sont pas dans le même demi-plan par rapport à l’axe de la double liaison C = C, le stéréo-isomère est E. - Formule topologique :
- Nom : (2E)-1,3-diphénylprop-2-en-1-one |
V- Exercice 17 page 107. Un colorant orangé.
|
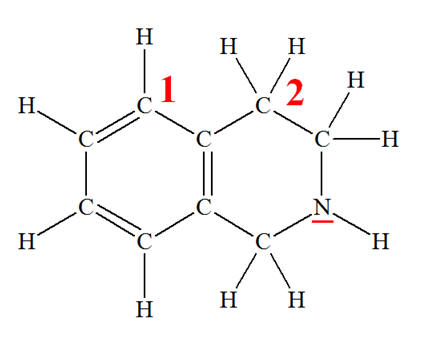
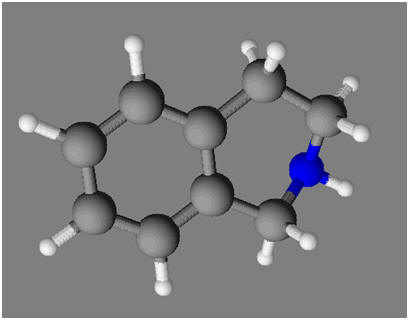
Les pigments isoindoline jaune-orangé, utilisés en peinture, sont des dérivés de l’isoindoline. 1)- Écrire la formule électronique des atomes d’hydrogène (Z = 1), de carbone (Z = 6) et d’azote (Z = 7). 2)- Établir la représentation de Lewis de la molécule à partir du modèle moléculaire de l’isoindoline représenté ci-dessous. 3)- Justifier la géométrie de la molécule autour des atomes de carbone 1 et 2, ainsi qu’autour de l’atome d’azote : |
|
4)- Formule électronique des différents atomes :
5)- Représentation de Lewis de la molécule :
6)- Géométrie de la molécule autour des atomes de carbone 1 et 2 : - Le carbone 1 possède une double liaison et 2 liaisons simples. Il possède trois voisins : - La répulsion des doublets impose une structure trigonale autour de cet atome de carbone. - Les atomes sont situés dans un même plan et l’angle formé entre deux liaisons est voisin de 120 ° - Le carbone 2 possède 4 liaisons simples : - La répulsion des doublets impose une disposition tétraédrique pour quatre doublets se repoussant dans la molécule autour de cet atome de carbone. - L’atome d’azote possède 3 liaisons simples et un doublet non liant. - La répulsion des doublets impose une disposition tétraédrique pour quatre doublets se repoussant dans la molécule autour de l’atome d’azote. - La molécule est pyramidale autour de l’atome d’azote.
|
VI- Exercice 21 page 109. Des odeurs végétales.
|
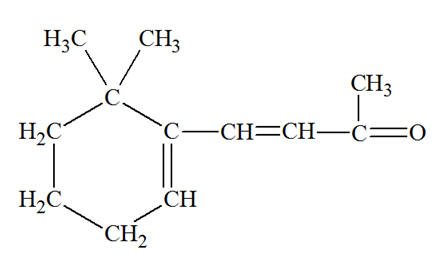
La β–ionone, présente dans certaines plantes, a une odeur de framboise. La formule semi-développée de la β–ionone est la suivante :
1)- β–ionone est, en fait l’isomère E. La représenter. 2)- Que peut-on dire des doubles liaisons de la β–ionone ? 3)- La molécule de linalol, présente dans la lavande et participant à son odeur caractéristique, est représentée ci-dessous : - Présente-t-elle une isomérie Z / E ? Justifier. |
|
4)- Isomère E : - Si, dans un alcène de formule générale CHX = CHY, les deux atomes d’hydrogène sont dans le même demi-plan par rapport à l’axe de la double liaison C = C, le stéréo-isomère est Z, dans le cas contraire, il est E.
5)- Les doubles liaisons de la β–ionone : - Formule topologique plus parlante : - Isomère E :
- Isomère Z :
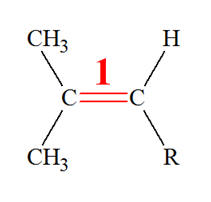
- Les doubles liaisons sont conjuguées. - Il y a alternances de doubles et simples liaisons. 6)- La molécule de linalol : - Cette molécule possède deux doubles liaisons. - Pour une étude simplifiée, on va numéroter chaque double liaison. - La double liaison 1 est du type :
-
Ce n’est pas un alcène de formule générale
CHX = CHY, elle ne possède pas l’isomérie Z / E.
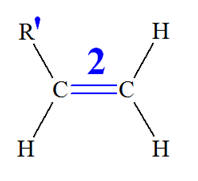
- Il y a deux groupements méthyles – CH3 sur le même atome de carbone. - La double liaison 2 est du type :
-
Ce n’est pas un alcène de formule générale
CHX = CHY, elle ne possède pas l’isomérie Z / E. - Il y a deux atomes d’hydrogène sur le même atome de carbone. |
VII- Exercice 23 page 109. La vitamine A.
|
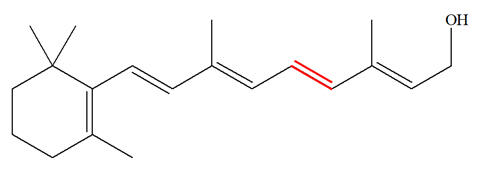
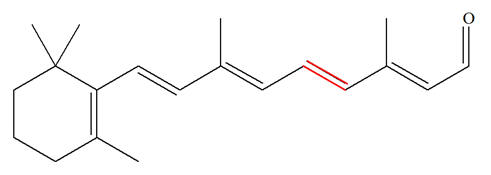
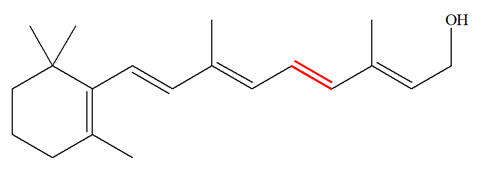
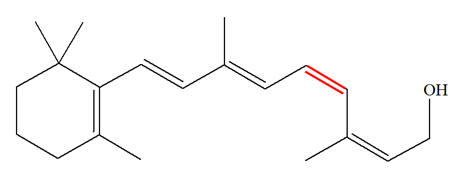
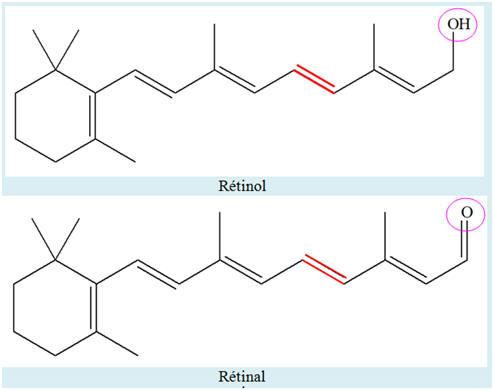
La vitamine A, appelée aussi rétinol, est une vitamine liposoluble présente dans de nombreux aliments. La carence en vitamine A (CVA) est un problème de santé publique dans plus de 118 pays et touche plus de 200 millions d’enfants. Près de la moitié des enfants aveugles dans les pays en développement le sont à cause d’une carence en vitamine A. Celle-ci joue un rôle important dans le mécanisme de la vision. L’une des premières étapes du processus de la vision est l’isomérisation photochimique de l’une des doubles liaisons covalentes (colorée en rouge ci-dessous) de la molécule de rétinal issu de celle de la vitamine A. La formule topologique de la vitamine A s’écrit : Vitamine A : Rétinol :
Rétinal :
1)- Définitions et aliments : a)- Rechercher la définition des mots ou expression en italique dans le texte. b)- Rechercher des aliments contenant de la vitamine A ainsi que les conséquences sur notre organisme d’une carence en vitamine A. 2)- Les doubles liaisons de la vitamine A sont-elles conjuguées ? 3)- L’isomère représenté est-il pour la double liaison rouge, l’isomère Z ou l’isomère E ? Représenter l’autre isomère. 4)- Comparer la formule de la molécule de vitamine A à celle du rétinal. Quels groupes caractéristiques les distinguent-elles ? |
|
5)- Définitions et aliments : a)- Définitions : - Espèces liposolubles : espèces chimiques qui sont solubles dans les lipides, c’est-à-dire les graisses. - Ceci est dû à la présence de la chaîne carbonée suffisamment longue qui est lipophile et hydrophobe. - Carence : absence ou apport insuffisant d'une ou de plusieurs substances nécessaires à la croissance et à l'équilibre d'un organisme animal ou végétal. - On parle d’avitaminose en cas de carence en vitamine : - Carence en vitamine B1 : Béribéri. - Carence en vitamine C : Scorbut. - Carence en vitamine D : Rachitisme - Isomérisation photochimique : - Pour passer d’un isomère à l’autre, il faut rompre la double liaison C = C. - Pour réaliser cela, il faut fournir de l’énergie. Ceci peut être réalisé grâce à une radiation électromagnétique convenable. - En éclairant convenablement un isomère Z (ou E), il est parfois possible de rompre la double liaison et d’obtenir l’isomère E (ou Z). - C’est une photo-isomérisation ou isomérisation photochimique, c’est-à-dire une isomérisation sous l’action de la lumière. b)- Les aliments contenant de la vitamine A et les conséquences sur notre organisme d’une carence en vitamine A - Aliments contenant de la vitamine A : - Huile de foie de morue ; - Foie de veau ; - Carottes ; - Beurre, lait, … -
Les conséquences sur notre organisme d’une
carence en vitamine
A : - La carence en vitamine A est la première cause de cécité, - Elle est responsable d’une mortalité infantile élevée après infection principalement par la rougeole. - Elle peut provoquer une mauvaise vision de nuit, une sécheresse de la peau, une sensibilité accrue aux infections virales et bactériennes. 6)- Doubles liaisons conjuguées : -
Un système de doubles liaisons est conjugué
s’il se présente sous une alternance ininterrompue
de simples et de doubles liaisons. - C’est le cas dans la molécule de rétinol qui présente 5 doubles liaisons conjuguées.
- Le rétinal présente 6 doubles liaisons conjuguées.
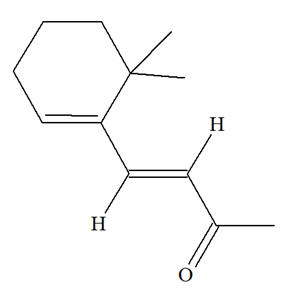
7)- Isomères Z ou E :
- L’isomère représenté, pour la double liaison rouge, est E. - Pour simplifier l’étude, on peut représenter la formule développée de la partie concernée :
- Les deux atomes d’hydrogène sont bien situés de part et d’autre de la double liaison. - Représentation de l’isomère Z :
8)- Comparaison du rétinal et du rétinol :
- Le rétinal est l'une des trois formes de la vitamine A. - C’est un aldéhyde capable d´absorber la lumière et qui présente une couleur orangée. -
Il possède le groupe caractéristique : - Le rétinol est un alcool capable d’absorber la lumière qui présente une couleur jaune. - Il possède le groupe caractéristique : – OH groupe hydroxyle |
|
|



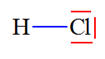
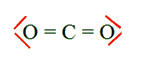

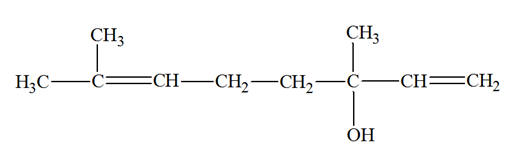
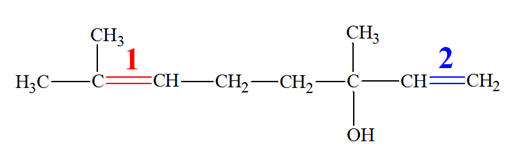
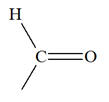 groupe carbonyle
groupe carbonyle