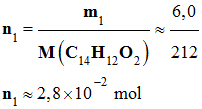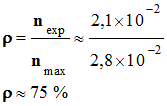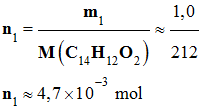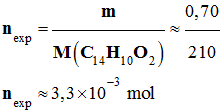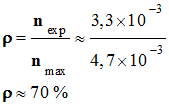|
Chap. N° 17 |
Une chimie du développement durable. Exercices. |
|
|
|
I-
Exercice 5 page 452 : comprendre les enjeux de la chimie
durable.
|
En plus de s’alimenter sainement, de disposer d’eau potable ou de réduire les pollutions, l’homme doit aussi
prendre soin de sa santé. Cela peut passer par l’usage de médicaments. Les chercheurs extraient de la nature des molécules thérapeutiques, les copient (plus des trois-quarts sont bio-inspirées) ou en synthétisent de nouvelles toujours plus efficaces, avec des procédés
de moins en moins polluants. Les industriels les produisent
à grande échelle lorsqu’elles sont rentables
économiquement. Si dans des pays développés la mortalité liée aux maladies infectieuses a « pratiquement » disparu, il n’en est pas de même dans les autres pays. Et, malheureusement, même si les traitements existent, les coûts de production élevés et l’insolvabilité des populations expliquent
la difficulté des pays en développement à accéder
aux soins. 1)- Que signifie le terme en italique ? 2)- Quels sont les leviers sur lesquels il faut
agir pour améliorer la santé des populations ? 3)- Quels rôles la chimie peut-elle jouer ? 4)- Expliquer, à l’aide des trois piliers du
développement durable, les enjeux de l’accès aux
soins. |
|
1)- Bio-inspirées : -
C’est le concept de la chimie douce
qui a pour ambition de synthétiser des
matériaux en s’inspirant du vivant (animaux et
végétaux). 2)- Leviers sur lesquels il faut agir pour
améliorer la santé des populations : - Il faut améliorer les médicaments, il faut que les populations aient accès à l’eau potable, qu’elles puissent se nourrir convenablement. Il faut aussi limiter au maximum la
pollution. 3)- Rôles que la chimie peut jouer : -
La chimie peut fabriquer les
médicaments à grande échelle, mais aussi proposer
les procédés plus efficaces et moins polluants. 4)- Les enjeux de l’accès aux soins : -
Les trois piliers : social,
environnemental et économique - La chimie durable s’inscrit dans une logique de développement durable. Sa mise en œuvre industrielle veille à l’équilibre social, environnemental et économique : -
Économiser et partager les ressources
de manière équitable -
Utiliser des technologies qui polluent
moins et consomment moins d’énergie. -
Développer des procédés suffisamment
efficaces et rentables. -
Social : permettre l’accès aux soins à
toutes les populations. -
Environnemental : privilégier les
ressources naturelles pour fabriquer les
médicaments, utiliser le plus possibles les procédés
qui limitent la pollution. -
Économique : permettre l’essor de
nouvelles technologies économiquement rentables. |
II-
Exercice 7 page 452 : utiliser des solvants alternatifs.
|
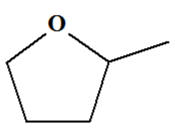
Le 2-méthyltétrahydrofurane (MeTHF), produit à partir du sucre de canne, est un agrosolvant alternatif au tétrahydrofurane THF, pétrosolvant. Il peut être utilisé dans de nombreuses réactions. Non miscible à l’eau, contrairement au THF, sa capacité d’extraction pour les composés polaires est meilleure. En outre, son isolement et son recyclage sont plus faciles. Le
MeTHF réduit les étapes d’extraction et le volume de
solvant utilisé. Il améliore les rendements. 1)- Le MeTHF : a)-
Pourquoi qualifie-t-on de MeTHF
d’agrosolvant ? b)-
Qu’est-ce qu’un prétrosolvant ? 2)- Le tableau suivant mentionne les dangers
associés au THF et au MeTHF. Commenter.
3)- Quels sont, parmi les principes de la chimie
verte, ceux qui sont respectés ? |
|
1)- Le MeTHF : a)- MeTHF : agrosolvant :-
Solvant issu d’agroressources
(ici la canne à sucre). b)-
Pétrosolvant : -
Un Pétrosolvant est un solvant issu du
pétrole. 2)- Commentaires :
-
Le MeTHF n’irrite pas les voies
respiratoires à l’inverse du THF. - Mais les deux produits présentent des risques analogues - (inflammables et irritation des
yeux). 3)- Les principes : ►
La chimie verte est fondée sur 12
principes : -
1. Limiter la pollution à la source, -
2. Économiser les atomes, -
3. Travailler avec des conditions
opératoires sûres, -
4. Concevoir des produits sûrs, -
5. Rechercher des solvants
alternatifs, -
6. Économiser l’énergie, -
7. Privilégier les ressources
renouvelables, -
8. Réduire les déchets, -
9. Préférer les réactions catalysées, -
10. Concevoir les produits
dégradables, -
11. Analyser en temps réel pour
prévenir la pollution, -
12. Réduire les risques accidents. - La sécurité est légèrement améliorée si on utilise le MeTHF à la place du THF, de plus , le MeTHF réduit les étapes d’extraction: (principe
N° 4 concevoir des produits sûrs et principe N° 12
réduire les risques d’accidents). - Si on utilise le MeTHF à la place du THF, le volume de solvant utilisé est réduit et on utilise une ressource renouvelable (principes
N° 5, 7 et 8). |
III- Exercice 8 page 452 : limiter les sources de
pollution.
|
Lorsque les
pommes de terre atteignent un certain stade de
développement, elles émettent une substance baptisée
solanoéclepine A. Dans le sol, les larves de nématodes réagissent à ce signal pour dévorer les tubercules. Habituellement, ces insectes parasites
sont combattus avec des pesticides chimiques. Le professeur Henk HEIMSTRA de l’université d’Amsterdam développe un procédé alternatif : pulvériser la solanoéclepine de synthèse avant la plantation de pommes de terre, afin de réveiller prématurément les larves de nématodes. Ne trouvant rien à manger, elles meurent
de faim. La plantation peut ensuite être effectuée. 1)- Citer les dangers liés à l’usage des
pesticides. 2)- Pourquoi le procédé alternatif utilisé se
place-t-il dans le cadre de la chimie verte ? |
|
1)- Dangers liés à l’usage des pesticides : -
L’utilisation des pesticides dans les
espaces verts, dans les jardins présente des risques
importants pour notre santé et notre environnement. -
L’épidémiologie nous montre ainsi que
les personnes exposées aux pesticides ont plus de
risque de développer de nombreuses maladies que les
autres : -
Risques de cancer, malformations
congénitales, infertilités, problèmes neurologiques,
système immunitaire affaibli. -
Dégradation de la qualité des eaux 2)- Procédé dans le cadre de la chimie verte : -
Ce procédé respecte les principes de
la chimie verte N° 1, 3,8 et 10. -
1. Limiter la pollution à la source, -
3. Travailler avec des conditions
opératoires sûres, -
8. Réduire les déchets, -
10. Concevoir les produits
dégradables, |
IV-
Exercice 9 page 453 : réduire l’émission de gaz à effet
de serre.
|
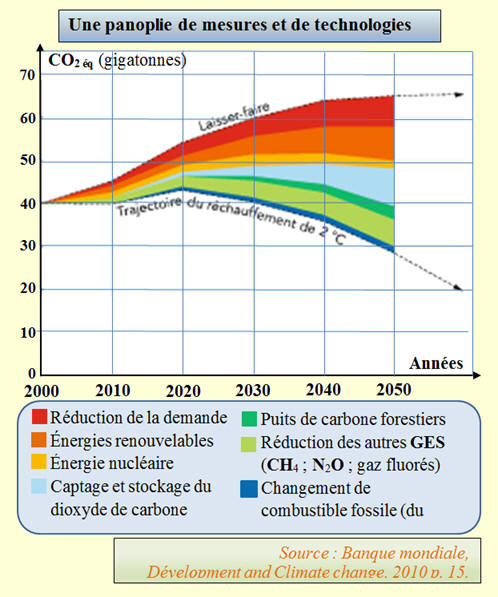
Les experts du GIEC s’accordent sur la nécessité de maintenir la hausse de la température de la planète en dessous de + 2 °C par rapport à l’ère pré-industrielle (1850-1899). La réduction des émissions de gaz à effet de serre (GES) implique des mesures énergétiques, industrielles, etc., mais aussi un changement de
notre mode de vie comme l’indique le graphique
suivant. 1)- a)- Qu’est-ce que le GIEC ?b)- Sur le graphique, la masse des GES émis est exprimée en CO2 éq. Qu’est-ce que cela signifie ?2)- Quelles semblent être les mesures les plus
efficaces pour réduire l’émission de GES. 3)- a)- Que sont les puits de carbone forestiers ?b)- En 2050, de quelle masse pourrait-on réduire les émissions de GES par captage-stockage du dioxyde de carbone ? |
|
1)- Le GIEC : -
Groupe d’experts intergouvernemental
sur l’évolution du climat. - Le Groupe d’experts intergouvernemental sur l’évolution du climat (GIEC) a été créé en 1988 par deux institutions des Nations unies : l’Organisation météorologique mondiale (OMM)
et le Programme des Nations unies pour
l’environnement (PNUE). - Le GIEC a pour mandat d’évaluer, sans parti pris et de manière méthodique et objective, l’information scientifique,
technique et socio-économique
disponible en rapport avec la question du changement
du climat. 2)- CO2 éq : - Le CO2 éq désigne le potentiel de réchauffement global (PRG) d'un gaz à effet de serre (GES), calculé par
équivalence avec une quantité de CO2 qui
aurait le même PRG. - La durée de vie du dioxyde de carbone dans l'atmosphère est estimée à environ 100 ans. - Son
PRG vaut exactement 1 puisque ce gaz est l’étalon de
base. -
Le tableau ci-dessous résume les
durées de vie et PRG des GES les plus courants.
3)- a)-
Les puits de carbone forestiers : - Un puits de carbone ou puits CO2 est un réservoir, naturel ou artificiel, de carbone qui absorbe le carbone de l'atmosphère et donc
contribue à diminuer la quantité de CO2
atmosphérique. -
Les puits de carbone forestiers
: les forêts permettent une séquestration optimale
et naturelle du dioxyde de carbone.
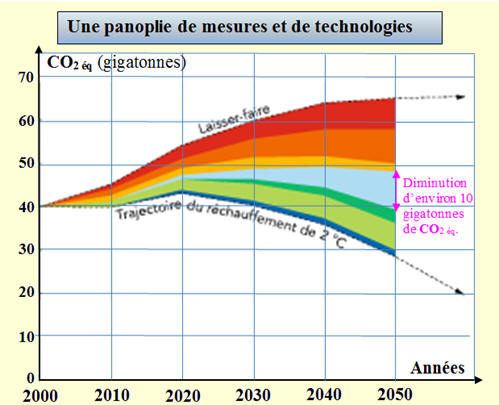
b)-
Réduction des émissions de GES par
captage-stockage du dioxyde de carbone : -
Exploitation graphique : -
La diminution de CO2 éq
est de l’ordre de 10 gigatonnes. |
|||||||||||||||||||||||||||||||||||
V-
Exercice 11 page 453 : recycler les déchets.
|
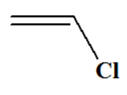
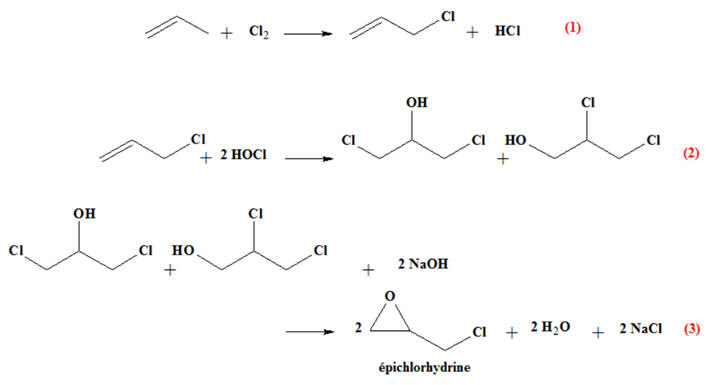
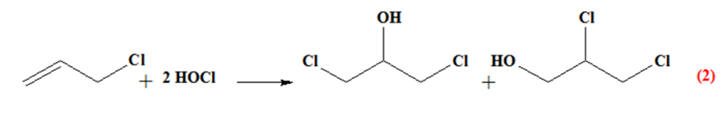
CH2
= CH – Cl Industriellement, le chlorure
de vinyle est obtenu par chloration de l’éthylène
(éthène) selon les réactions d’équations :
En présence de dioxygène et de
chlorure d’hydrogène, une autre réaction peut se
produire :
1)- Quel est le rôle des chlorures de fer et de
cuivre ? 2)- a)-
Quel intérêt les industriels ont-ils à mettre
en œuvre, en plus des réactions (1) et (2), la
réaction (3) ? b)-
Pourquoi cette démarche s’inscrit-elle dans
le cadre d’une chimie durable ? |
|
1)- Rôle des chlorures de fer et de cuivre : -
Les chlorures de fer et de cuivre sont
des catalyseurs. 2)- a)-
Intérêt des industriels à mettre en
œuvre, en plus des réactions (1) et (2), la réaction
(3) : -
Ceci permet d’utiliser le chlorure
d’hydrogène qui est un produit indésirable de la
réaction (2). -
La réaction (3) entraîne une
augmentation du rendement global. b)-
La démarche s’inscrit dans le cadre d’une
chimie durable : -
Les principes de la chimie verte
respectées sont : -
Principe N°1 : Limiter la pollution à
la source. -
Principe N°2 : Économiser les atomes. -
Principe N°6 : Économiser l’énergie. -
Principe N°8 : Réduire les déchets. |
VI-
Exercice 12 page 454 : privilégier les ressources
naturelles.
|
Le polychlorure
de vinyle est largement utilisé comme revêtements
des sols, emballages, canalisations d’eau, etc. Il est synthétisé à partir du chlorure de vinyle CH2 = CH – Cl, lui-même obtenu par chloration de l’éthène (éthylène) CH2 =
CH2 par le dichlore Cl2. L’éthène peut être obtenu soit
à partir du pétrole, soit par déshydratation du
bioéthanol C2H5OH
issu de la canne à sucre.
Le PVC biosourcé, nommé
bioPVC, et celui obtenu à partir du pétrole ne sont
pas biodégradables. Le groupe chimique belge SOLVAY a implanté au Brésil, une usine de production sur des terres où la culture de la canne à sucre, comme
matière première, n’entre pas en compétition avec
celle à usage alimentaire et crée plus d’emplois que
d’autres cultures. 1)- Qu’est-ce qu’une matière biosourcée ?
Est-elle nécessairement biodégradable ? 2)- a)-
Les propriétés chimiques et physiques du PVC
biosourcé et de celui fabriqué à partir du pétrole
sont-elles identiques ? b)-
Que peut-on penser de la phrase en italique ?
Quelle solution alternative au PVC pourrait-on
envisager ? 3)- La balance GES de la production d’éthanol à
partir de la canne à sucre et du pétrole est donnée
ci-après : Émission totale de dioxyde de
carbone pour la production de PVC, sur l’ensemble du
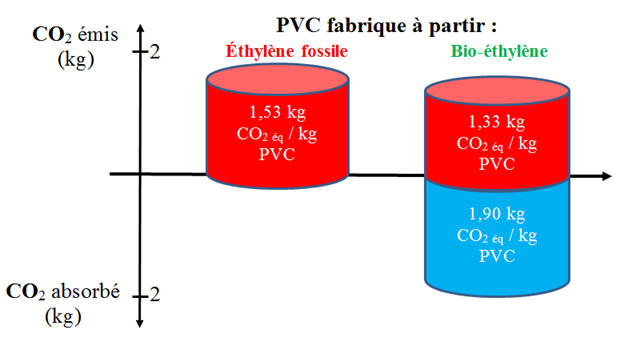
procédé (électrolyse, transport, etc.). a)-
Expliquer la présence du cylindre bleu, puis
commenter le graphique. b)-
Montrer, à l’aide d’exemples, que le procédé
bioPVC s’inscrit dans une perspective de chimie
durable. 4)- La chloration de l’éthène conduit au 1,2-dichloroéthane. Chauffé à haute température et sous pression, ce dernier produit le chlorure de
vinyle et un sous-produit A. a)-
Écrire l’équation de la chloration de
l’éthène par le dichlore. b)-
À quelle famille de réaction appartient cette
étape de chloration ? c)-
Identifier A. Constitue-t-il
nécessairement un déchet ? |
|
1)- Matière biosourcée et biodégradabilité : -
Matière biosourcée
: une matière issue de la biomasse végétale.
-
Un
matériau plastique biosourcé est obtenu à partir de
ressources renouvelables. - Le terme « biosourcé » est donc relatif à l’origine de la matière première et il est important de noter qu’un
plastique biosourcé n’est pas nécessairement
biodégradable ou compostable. -
De même,
un plastique
biodégradable n’est pas nécessairement issu de
ressources renouvelables. 2)- a)-
Propriétés chimiques et physiques du PVC
biosourcé et de celui fabriqué à partir du pétrole : -
Les propriétés chimiques et physiques
du PVC biosourcé et de celui fabriqué à partir du
pétrole sont identiques. b)-
Phrase en italique :
-
Le PVC biosourcé, nommé bioPVC, et
celui obtenu à partir du pétrole ne sont pas
biodégradables. -
Étant non biodégradable, le PVC va
agir sur l’environnement. -
Il faut envisager de fabriquer des
matières plastiques biodégradables. 3)- a)-
Le graphique : -
La canne à sucre absorbe du CO2
pour la photosynthèse. -
La balance est favorable au PVC
biosourcé (le procédé absorbe plus de dioxyde de
carbone qu’il n’en émet). b)-
La chimie durable : -
Les trois piliers : social,
environnemental et économique - La chimie durable s’inscrit dans une logique de développement durable. Sa mise en œuvre
industrielle veille à l’équilibre social,
environnemental et économique : -
Économiser et partager les ressources
de manière équitable -
Utiliser des technologies qui polluent
moins et consomment moins d’énergie. -
Développer des procédés suffisamment
efficaces et rentables. -
Social : permettre l’accès aux soins à
toutes les populations. - Environnemental : privilégier les ressources naturelles pour fabriquer les médicaments, utiliser le plus possibles les procédés
qui limitent la pollution. -
Économique : permettre l’essor de
nouvelles technologies économiquement rentables. -
Dans le cadre de la production de
bioPVC, les trois piliers de la chimie durable sont
concernés : -
Environnement : balance GES favorable. -
Social : pas de compétition avec la
nourriture. -
Économique : création d’emplois. 4)- a)-
Équation de la chloration de l’éthène par le
dichlore : -
Première étape : Équation de
chloration de l’éthène
-
Deuxième étape : Craquage thermique :
b)-
Réaction de chloration : -
Étape (1) : chloration de l’éthène :
réaction d’addition -
Étape (2) : Craquage catalytique :
réaction d’élimination c)-
Identification de A : -
Lors de l’étape (2) : Craquage
catalytique : réaction d’élimination -
Le produit A est du chlorure
d’hydrogène. -
Il peut être utilisé
industriellement : on peut recycler le chlorure
d’hydrogène obtenu. -
En présence de dioxygène et de
chlorure d’hydrogène, une autre réaction peut se
produire avec l’éthène :
-
Cette réaction permet d’utiliser le
chlorure d’hydrogène obtenu lors de l’étape (2). |
VII- Exercice 13 page 454 : capter le dioxyde de carbone.
|
La combustion en boucle chimique (ou chimical looping combustion CLC) est une technique de traitement en oxycombustion qui convertit initialement les combustibles fossiles en dioxyde de carbone et vapeur d’eau, facilement
séparable par refroidissement. Aucune autre espèce
carbonée n’est produite, contrairement à une
combustion classique. Le procédé consiste à oxyder à l’air un métal réducteur pour le réduire ensuite en présence d’un combustible : Lors de la première étape, la température atteinte (autour de 1000 °C) ne permet pas la formation d’oxydes d’azote NOx gaz à effet de serre indirect. L’air chaud dégagé peut servir à la production
d’énergie électrique par l’intermédiaire d’une
turbine à gaz. L’énergie thermique, produite
lors de la deuxième étape, est également récupérée. L’efficacité d’une centrale fonctionnant en CLC est très élevée. 1)- Pourquoi qualifie-t-on ce procédé
d’oxycombustion ? 2)- a)-
En notant M le métal et MO son
oxyde, écrire l’équation d’oxydation du métal M
par le dioxygène. b)-
Écrire l’équation de la réduction de l’oxyde
métallique MO par le méthane CH4
sachant que le métal M est régénéré. c)-
Montrer que la somme de ces deux équations
est équivalente à une équation de la combustion du
méthane dans le dioxygène. d)- Lors d’une combustion classique, quelles autres espèces carbonées peuvent être produites ? Justifier alors l’intérêt de l’oxycombustion. 3)- Comment le dioxyde de carbone est-il
récupéré ? 4)- a)-
D’où pourraient provenir les oxydes d’azote
NOx dont il est question dans le
texte ? b)-
Pourquoi sont-ils qualifiés de
gaz à effet de serre
indirect ? 5)- Dans le cadre de la chimie verte, expliquer
pourquoi cette technique est un gain en termes
d’énergie. |
|
1)- Oxycombustion : -
Le préfixe « Oxy » est utilisé pour
oxydation. La réaction est une oxydation. 2)- a)-
Équation d’oxydation du métal M par le
dioxygène :
b)-
Équation de la réduction de l’oxyde
métallique MO par le méthane CH4 :
c)-
Bilan des deux réactions :
-
Le bilan de la réaction correspond à
la combustion complète du méthane dans le dioxygène. d)-
Autres espèces carbonées qui peuvent être
produites : - Si la combustion est incomplète, on peut avoir la formation de monoxyde de carbone CO (g) et de carbone C (s)au cours de la
réaction. - Ceci n’est pas possible avec une oxycombustion. - Avec une oxycombustion, il y a moins
de pollution. 3)- Récupération du dioxyde de carbone : - Il est récupéré par refroidissement. - Le dioxyde de carbone et la vapeur d’eau, sont
facilement séparables par refroidissement. 4)- a)-
Provenance des oxydes d’azote NOx : -
Ils proviennent du diazote N2
(g) de l’air. b)-
Gaz à effet de serre indirect : - Les gaz à effet de serre indirect, tels que le monoxyde de carbone (CO), les oxydes d’azote (NOx) et les composés organiques volatils (COV) autres que le méthane, absorbent faiblement les IR, mais
favorisent la formation de gaz à effet de serre
comme le méthane (CH4). -
Ce sont des gaz responsables de la
formation de gaz à effet de serre. 5)- Gain en termes d’énergie : -
Les principes respectés : -
Principe N°1 : Limiter la pollution à
la source. -
Principe N°6 : Économiser l’énergie. -
Principe N°8 : Réduire les déchets. -
Dans le texte de l’énoncé de
l’exercice : - L’air chaud dégagé peut servir à la production d’énergie électrique par l’intermédiaire
d’une turbine à gaz. -
L’énergie thermique, produite lors de
deuxième étape, est également récupérée. -
L’efficacité d’une centrale
fonctionnant en CLC est très élevée. |
||||||||||||||||||||||||||||||
VIII- Exercice 15 page 455 : valoriser les déchets.
|
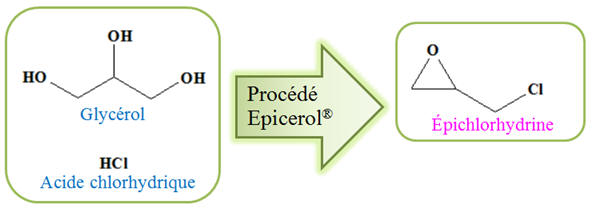
L’épichlorhydrine est utilisée majoritairement dans
la production de résines époxydes à la base de
peintures, d’adhésifs, etc. Cette molécule peut être
synthétisée à partir du propène issu du vapocraquage
du pétrole selon les réactions d’équations : L’industrie oléochimique produit des quantités surabondantes de glycérol : Son coût de revient est relativement faible.
Molécule
d’épichlorhydrine en 3D Aujourd’hui, grâce à la technologie Epicerol®, brevetée par le groupe chimique belge SOLVAY, l’épichlorhydrine peut
être fabriquée à partir du glycérol biosourcé :
Les dangers associés à
l’épichlorhydrine :
1)- Pourquoi cherche-t-on à remplacer le procédé
de synthèse à partir du propène ? 2)- a)-
Pourquoi le procédé Epicerol®
s’inscrit dans une démarche de chimie durable ? b)-
En s’aidant du tableau des dangers associés à
l’épichlorhydrine, doit-on nuancer la réponse à la
question 2)- a)- ? 3)- À quelle famille de réactions appartient la
réaction (2) ? |
|
1)- Procédé de synthèse à partir du propène : -
Le propène est issu du vapocraquage du
pétrole. - Il est plus cher que le glycérol qui est un sous-produit de la saponification et il
est issu de matières premières fossiles épuisables. 2)- a)-
Démarche de chimie durable pour le procédé
Epicerol® : -
Les trois piliers : social,
environnemental et économique - La chimie durable s’inscrit dans une logique de développement durable. Sa mise en œuvre
industrielle veille à l’équilibre social,
environnemental et économique. ► Le procédé utilise du glycérol renouvelable à la place de propène d’origine fossile. Il contribue à l’économie de ressources
fossiles : -
Ceci est en accord avec le principe N°
7 de la chimie durable : -
Principe N° 7 : Privilégier les
ressources renouvelables. ► Le procédé présente une meilleure
économie du nombre de molécules utilisées : -
Ceci est en accord avec le principe N°
2 : Économiser les atomes. ► La production de sous-produits et
résidus est réduite : -
Ceci est en accord avec le principe N°
8 : Réduire les déchets. ► Il économise l’énergie : -
Ceci est en accord avec le principe N°
6 : Économiser l’énergie b)-
Dangers associés à l’épichlorhydrine : -
Le principe N° 4 n’est pas respecté :
Concevoir des produits sûrs. -
L’épichlorhydrine est un produit
toxique. 3)- La réaction (2) : -
La réaction (2) est une réaction
d’addition. - Dans une réaction d’addition, des atomes, ou groupes d’atomes, sont ajoutés aux atomes
d’une liaison multiple. |
IX-
Exercice 16 page 456 : limiter l’usage des solvants.
|
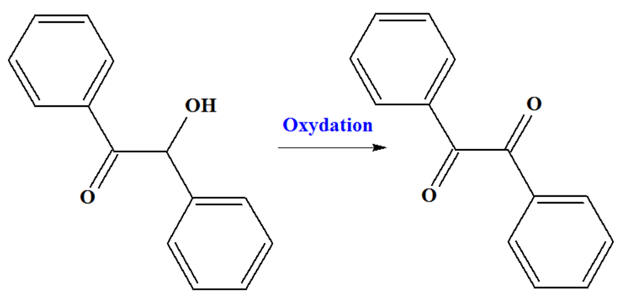
Le benzile est utilisé comme réactif en synthèse organique. Il est préparé par
oxydation de la benzoïne : ►
Protocole 1 :
45 mL d’acide nitrique concentré HNO3,
30 mL d’acide acétique pur utilisé comme solvant. - Un dégagement de dioxyde d’azote NO2 a lieu. Ce gaz est piégé par un système approprié. Une fois la réaction terminée, on ajoute 150 mL
d’eau froide. -
Un précipité jaune se forme. -
Après filtration et purification, on
obtient 4,5 g de benzile. ► Protocole 2 :
4 g de poudre d’argile, 0,5 g de
dioxyde de manganèse MnO2. - Après chauffage du mélange solide au four micro-ondes pendant 2 min, le benzile est
extrait à l’éthanol. -
Après évaporation et purification, on
obtient 0,7 g de cristaux jaunâtres de benzile. 1)- Justifier l’utilisation du chauffage à reflux dans le protocole1 et la nécessité de
mélanger intimement les réactifs dans le protocole
2. 2)- a)-
Quels sont les oxydants dans chaque
synthèse ? b)-
Écrire la demi-équation de l’oxydation de la
benzoïne en benzile. 3)- Commenter le tableau suivant :
4)- Dans les deux cas, le réactif limitant est la benzoïne. Calculer le rendement de chacune des
réactions. 5)- Pourquoi le protocole 2 s’inscrit-il dans le
cadre d’une chimie verte et non le protocole1 ? |
|
1)- Utilisation du chauffage à reflux dans le
protocole1 et mélange intime pour le protocole 2 : ► Utilisation du chauffage à reflux dans
le protocole1 : -
On obtient un mélange homogène dont
l’acide acétique est le solvant. -
On peut porter le mélange réactionnel
à ébullition sans perte de matière grâce à ce
dispositif. - Le fait de travailler à température élevée (pratiquement la température d’ébullition du solvant) permet d’augmenter la vitesse de la
réaction chimique. ► Mélange intime pour le protocole 2 : - On est en présence de réactifs à l’état solide finement divisés (poudre). - On les mélange intimement pour accroître la surface de contact entre les différents réactifs. Ainsi on
augmente la vitesse de la réaction chimique. 2)- a)-
Les oxydants dans chaque synthèse : - Protocole 1 : l’oxydant est le l’acide nitrique concentré HNO3. - Au cours
de la réaction, il se forme du dioxyde d’azote
(vapeurs rousses) NO2 (g). -
Protocole 2 : L’oxydant est le dioxyde
de manganèse MnO2. b)-
Demi-équation de l’oxydation de la benzoïne
en benzile : 3)- Commentaires du tableau : -
Les réactifs et produits du protocole
1 sont plus dangereux que ceux du protocole 2. 4)- Rendement de chacune des réactions : ►
Protocole 1 : - Le réactif limitant est la benzoïne. - En conséquence, le rendement se calcule à partir de
ce réactif. -
Masse molaire de la benzoïne : M
(C14H12O2)
= 212 g / mol -
Quantité de matière de benzoïne : -
-
Quantité de matière maximale de
benzile attendu nmax: -
nmax = n1
≈ 4,7
x 10–3 mol -
Quantité de matière de benzile que
l’on a effectivement obtenu : -
-
Rendement du protocole 1 : - Le rendement d’une synthèse, noté ρ, est égal au quotient de la quantité de produit obtenu nexp, par la quantité
maximale de produit attendu nmax.
-
►
Protocole 2 : -
-
Quantité de matière maximale de
benzile attendu nmax: -
nmax = n1
≈ 2,8
x 10–2 mol -
Quantité de matière de benzile que
l’on a effectivement obtenu : -
-
Rendement du protocole 2 : -
5)- Protocoles et chimie verte : -
Le protocole 2 utilise moins d’énergie
que le protocole 1 : - Protocole 1 : - Chauffage à reflux à 100
°C, pendant une heure et demie. - Protocole 2 : - Chauffage du mélange
solide au four micro-ondes pendant 2 min. -
Le rendement est sensiblement le même
pour les deux protocoles. -
Le principe N° 06 est respecté pour le
protocole 2. -
Principe N° 06 : Économiser l’énergie. -
Les réactifs sont moins dangereux pour
le protocole 2 que pour le protocole 1. -
Le principe N° 12 est respecté pour le
protocole 2. -
Principe N° 12 : Réduire les risques
accidents. -
Pour le protocole 2, on n’utilise pas
de solvant. -
Le principe N° 08 est respecté :
Réduire les déchets. |
|
|