|
|
Sens d'évolution spontanée d'un système chimique |
|
|
|
|
|
I- La transformation non totale.
2)- Notion d’équilibre dynamique. |
|
II- L’évolution spontanée d’un système.
b)-
Cas d’une réaction où le solvant intervient :
|
|
III- Transfert spontanée d’électrons. 1)- Réaction d’oxydo-réduction. 3)- Fonctionnement d’une pile. |
|
QCM r
La transformation non totale. L’évolution spontanée d’un système Le transfert spontanée d’électrons. |
|
Préparation à l'ECE :
L’apparition du sulfure
d’argent Ag2S
(s) 1)- Exercice
05 page 144 : Déterminer un taux d’avancement final. 2)- Exercice
07 page 145 : Exprimer un quotient de réaction. 3)- Exercice
09 page 145 : Prévoir un sens d’évolution spontanée. 4)- Exercice
10 page 145 : Évaluer une constante d’équilibre : 5)-
Exercice 13 page 146 : Identifier la polarité d’une pile. 6)- Exercice
17 page 146 : Identifier des oxydants et des réducteurs. 7)- Exercice
18 page 146 : Identifier des oxydants et des réducteurs. 8)- Exercice
21 page 147 : La pluie d’or. 9)- Exercice
26 page 149 : Des piles « rechargeables ». 10)- DS N°
01 : Solubiliser l’aspirine (35 min) : exercice 27 page 150. 11)- DS N°
02 : Choisir une pile bouton (15 min) : exercice 28 page 151. |
|
|
I- La transformation non totale.
►
L’avancement maximal : xmax.
-
Définition :
-
L’avancement maximal
xmax
correspond à la plus petite valeur de l’avancement pour laquelle la quantité
finale de l’un au moins des réactifs est nulle.
-
Ce réactif est alors appelé : réactif
limitant.
-
Recherche dans le cas précédent.
-
Comment peut-on
déterminer la valeur de l’avancement maximal xmax
d’une réaction chimique ?
►
Exemple : réaction
entre les ions thiosulfate et le diiode.
|
- On verse un volume V2 = 40 mL d’une solution aqueuse de thiosulfate de sodium {2 Na+ (aq) + S2O32– (aq)} de concentration C2 = 1,0 × 10–2 mol / L dans un bécher. -
Cette solution est incolore. |

|
- on ajoute lentement, tout en agitant, un volume V1 = 10 mL d’une solution aqueuse de diiode I2 (aq) de couleur jaune-orangé, de concentration C1 = 1,0 × 10–2 mol / L, à l’aide d’une burette
graduée. |

-
Schéma :
► Observations :
-
Au fur et à mesure, de l’ajout de la
solution, on observe la décoloration de la solution aqueuse de diiode.
-
Lorsque toute la solution de diiode a
été versée, la solution finale est incolore.
-
Au cours de la réaction, il se forme
des ions iodure I–
(aq) et des ions tétrathionate S4O62–
(aq) qui sont incolores.
-
Les ions sodium
Na+
(aq), qui sont incolores, ne participent pas à la réaction, ce sont des ions
spectateurs.
-
En fin de réaction, tout le diiode a
disparu puisque le mélange réactionnel est incolore.
-
La réaction est totale.
-
Équation bilan de la réaction :
|
2 S2O32–
(aq)
|
|
(I2
(aq) +
2
e – |
|
I2
(aq) +
2
S2O32– (aq) → 2
I– (aq) + S4O62– (aq) |
-
Quantité de matière :
|
Expérience 1 : |
Solution
de diiode |
Solution de
thiosulfate
de sodium |
|
Volume |
V1
= 10 mL |
V2
= 40 mL |
|
Concentration |
C1
= 1,0 × 10–
2 mol / L |
C2
= 1,0 × 10–
2 mol / L |
|
Quantité de
matière |
n1
= C1 × V1
n1
≈ 1,0 × 10–
4 mol
n1
≈ 0,10 mmol |
n2
= C2 × V2
n2
≈ 4,0 × 10–
4 mol
n2
≈ 0,40 mmol |
-
Tableau d’avancement :
|
Équation |
I2 (aq) |
+ 2 S2O32–
(aq) |
→ |
2
I– (aq) |
+
S4O62–
(aq) |
|
|
État du
système |
Avancement |
n (I2)
|
n (S2O32–) |
|
n (I–) |
n
(S4O62–) |
|
État initial
(mmol) |
x =
0 |
n1
= 0,10 |
n2
= 0,40 |
0 |
0 |
|
|
État
intermédiaire |
0 ≤ x ≤ xf |
0,10 – x |
0,40 – 2 x |
2
x |
x |
|
|
État final
(mmol) |
x = xf |
0,10 – xf |
0,40 – 2 xf |
|
2
xf |
xf |
|
État maximal
(mmol) |
x = xmax |
0,10 – xmax |
0,40 – 2 xmax |
|
2
xmax |
xmax |
-
La grandeur
xf
représente l’avancement final.
-
La grandeur
xmax
représente l’avancement maximal.
-
On remarque que l’avancement
x est égal à la
quantité de matière de diiode consommée.
-
On peut écrire :
n (I2)
= n1
– x
-
Au début de la réaction, l’avancement
x = 0, puis
l’avancement x
augmente au cours de la réaction pour atteindre la valeur
xf
lorsque l’état final est atteint.
-
Puis on compare les valeurs de
xf
et xmax.
►
Recherche de l’avancement maximal
xmax
de la réaction :
-
Comme, on est en présence de deux
réactifs, on peut émettre deux hypothèses.
|
-
Hypothèse 1 :
On considère que le réactif limitant est le diiode
I2 (aq) : -
0,10
– xmax1
= 0 => xmax1
= 0,10 mmol -
Hypothèse 2 :
On considère que le réactif limitant est l’ion thiosulfate
S2O32– (aq) : -
0,40
– 2 xmax2
= 0 => xmax2
= 0,20 mmol |
|
-
L’avancement maximal est égal à la plus
petite des deux valeurs :
-
Car on ne peut pas consommer plus de
réactif qu’il n’y en a au départ -
On ne peut pas consommer 0,20 mmol de
diiode car au départ, on en a 0,10 mmol. -
xmax
= xmax1
= 0,10 mmol ≤ xmax2 |
-
En conséquence :
-
Le
réactif limitant est le diiode
I2 (aq),
il a été totalement consommé.
-
Ceci est en accord avec les
observations expérimentales.
-
Le
réactif en excès est l’ion thiosulfate
S2O32– (aq),
il n’a pas totalement réagi.
-
Il reste des ions thiosulfate en fin de
réaction.
-
Une transformation est dite
totale si
l’avancement final xf
de la réaction est égal à son avancement maximal
xmax.
-
Une transformation est dite
non totale si
l’avancement final xf
de la réaction est inférieur à son avancement maximal
xmax.
|
Transformations totales et non totales : Comparaison entre xf et xmax : -
Si xf =
xmax , alors la transformation est totale. -
Si xf <
xmax , alors la transformation est non totale. |
-
L’avancement final permet de réaliser
le bilan de matière, c’est-à-dire de calculer les quantités de matière de toutes
les espèces chimique à l’état final.
-
Dans le cas présent, la réaction entre
le diiode I2 (aq)
et les ions thiosulfate S2O32–
(aq) est une transformation totale :
-
xf
= xmax.
-
On peut maintenant compléter le tableau
d’avancement de la réaction.
|
Équation |
I2 (aq) |
+ 2 S2O32–
(aq) |
→ |
2
I– (aq) |
+
S4O62– (aq) |
|
|
État du
système |
Avancement |
mmol |
mmol |
|
mmol |
mmol |
|
État initial
(mmol) |
x =
0 |
n1
= 0,10 |
n2
= 0,40 |
0 |
0 |
|
|
État
intermédiaire |
x |
0,10 – x |
0,40 – 2 x |
2
x |
x |
|
|
État final
(mmol) |
x = xf
= xmax |
0,10 – xmax |
0,40 – 2 xmax |
|
2
xmax |
xmax |
|
0,10
|
0 |
0,20 |
|
0,20 |
0,10 |
|
-
On connait ainsi l’état final du
système et le bilan de matière.
b)-
Transformation non totale.
-
Comparer l’avancement final
xf
et l’avancement maximal xmax
permet de distinguer les transformations totales et non totales.
-
Pour une transformation non totale, il
faut connaître la valeur de l’avancement final
xf
pour effectuer le bilan de matière à l’état final.
-
Dans le cas d’une transformation non
totale :
-
À l’état final :
-
Les quantités des espèces ne varient
plus ;
-
Tous les réactifs et les produits
coexistent.
-
On est en présence d’un
équilibre chimique.
-
Lors d’une réaction non totale :
-
Les
réactifs réagissent entre eux pour donner les
produits ;
-
Simultanément :
-
Les
produits réagissent pour donner les
réactifs.
-
Une réaction non totale est modélisée
par deux réactions opposées l’une de l’autre.
-
L’équation de la réaction s’écrit alors
avec une double flèche
![]() qui traduit le fait que deux réactions, inverses l’une de
l’autre, peuvent se produire simultanément dans le système.
qui traduit le fait que deux réactions, inverses l’une de
l’autre, peuvent se produire simultanément dans le système.
-
L’équation s’écrit alors :
a
A + b
B
![]() c
C + d D
c
C + d D
►
Exemple : Réaction entre l’acide
éthanoïque et l’eau :
|
CH3COOH
(aq) |
|
|
|
CH3COO
– (aq) |
+ |
H+ |
(1) |
|
H2O
(ℓ) |
+ |
H+ |
|
H3O+ (aq) |
|
|
(2) |
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O+ (aq) |
(1) + (2) |
2)- Notion d’équilibre dynamique.
►
Échelle microscopique :
-
Lorsque l’état d’équilibre est
atteint :
-
Les nombres moyens de chocs efficaces,
par unité de temps, entre les espèces réactives d’une part et entre les espèces
produites d’autre part sont égaux.
►
Échelle macroscopique :
-
La vitesse d’apparition de toute espèce
chimique intervenant dans l’équation de la réaction est égale à sa vitesse de
disparition.
-
On est en présence d’un
équilibre chimique dynamique.
-
Le milieu réactionnel est le siège
d’une activité chimique permanente à l’échelle microscopique.
-
À l’échelle macroscopique les effets de
cette activité se compensent globalement.
-
Le taux d’avancement final d’une
réaction, noté τ
(tau), est le quotient de l’avancement final par l’avancement maximal :
|
|
|
|
τ
(tau) |
Taux d’avancement
final (sans unité) |
|
xf |
Avancement final (mol) |
|
xmax |
Avancement maximal
(mol) |
|
-
Si τ = 0, la réaction n’a pas lieu. -
Pour une réaction totale :
τ = 1 car
xf
= xmax -
Pour une réaction non totale : 0
< τ < 1 car
xf
< xmax -
On peut exprimer cette grandeur en
pourcentage. |
a)-
Réaction entre l’acide éthanoïque et l’eau :
-
Dans une fiole jaugée de volume
V = 500,0 mL,
partiellement remplie d’eau distillée,
-
On verse avec précaution
Vapp
= 2,86 mL (ou mapp
= 3,00 g) d’acide éthanoïque ou acétique.
-
On mélange, puis on complète avec de
l’eau distillée jusqu’au trait de jauge et on homogénéise.
-
L’eau, le solvant, est en large excès.
-
On verse un volume
V1
= 40 mL de la solution obtenue dans un bécher et on mesure le
pH de cette
solution.
-
Le pH-mètre
indique : pH
= 2,90.
-
L’équation de la réaction est la
suivante :
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O
+ (aq) |
-
Données
:
-
Masse molaire de l’acide éthanoïque :
-
M
= 60,05 g . mol–1 densité
; d =
1,05 ;
-
Masse volumique de l’eau :
ρ0
= 1,00 g . mL–1.
-
Déterminer la valeur de la
concentration C1
en acide éthanoïque de la solution obtenue.
-
Reproduire et compléter le tableau
d’avancement de la réaction.
|
Équation
|
CH3COOH
(aq) |
+ H2O (ℓ) |
|
CH3COO–
(aq) |
+ H3O+ (aq) |
|
|
état
|
Avancement
x
(mol) |
|
|
|
|
|
|
État initial
(mol) |
0 |
C1
. V1
|
Solvant
|
|
0 |
0 |
|
Au cours de la
transformation
|
x |
…… |
Solvant |
…… |
…… |
|
|
Avancement
final
|
xf
|
…… |
Solvant |
…… |
…… |
|
|
Avancement
maximal
|
xmax
|
…… |
Solvant |
|
…… |
…… |
-
Déterminer la valeur de l’avancement
maximal xmax
de la réaction.
-
Déterminer la valeur de l’avancement
final xf
à partir de la valeur du pH
de la solution.
-
Comparer
xmax
et xf,
puis conclure.
-
En déduire la valeur du taux
d’avancement τ
de la réaction entre l’acide éthanoïque pur et l’eau.
►
Valeur de la concentration
C1
en acide éthanoïque de la solution obtenue :
-
Quantité de matière initiale d’acide
éthanoïque :
-
C’est la quantité de matière d’acide
éthanoïque apporté.
-
Masse d’acide éthanoïque utilisé :
-
m =
ρ .
V
-
Or, on connaît la densité de l’acide
éthanoïque :
-
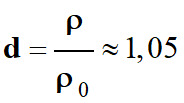
-
relation
:
-
m =
ρ0
. d .V
-
Quantité de matière correspondante :
-
C’est la quantité de matière initiale
d’acide éthanoïque :
-
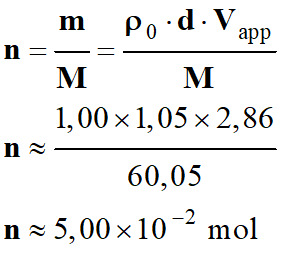
-
Valeur de la concentration
C1
-
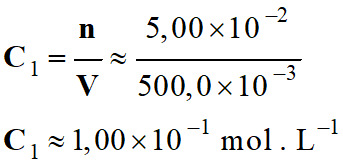
►
Tableau d’avancement de la réaction :
|
Équation |
CH3COOH
(aq)
|
+ H2O (ℓ) |
|
CH3COO–
(aq)
|
+ H3O+
(aq) |
|
|
état |
Avancement
x
(mol) |
n (CH3COOH)
|
|
|
n
(CH3COO–) |
n
(H3O+) |
|
État initial
(mol) |
0 |
n1 = C1
. V1
n1
≈ 4,0 x 10–3 mol |
Solvant |
|
0 |
0 |
|
Au cours de la
transformation |
x |
C1 . V1
– x |
Solvant |
x |
x |
|
|
Avancement
final |
xf |
C1 . V1
– xf |
Solvant |
xf |
xf |
|
|
Avancement
maximal |
xmax
|
C1 . V1
– xmax |
Solvant |
|
xmax |
xmax |
►
Valeur de l’avancement maximal
xmax
de la réaction :
-
L’avancement maximal
xmax
serait atteint si l’acide éthanoïque était totalement consommé.
-
Dans ce cas :
-
C1
. V1
– xmax
= 0
-
xmax
= C1
. V1
-
xmax
≈ 4,0 × 10–3 mol
►
Valeur de l’avancement final
xf
de la réaction :
-
On calcule la valeur de
xf
à partir de la valeur du pH
de la solution :
-
D’après de tableau d’avancement de la
réaction, on peut écrire que :
-
xf
= nf
(H3O
+)
-
D’autre part :
pH = 2,90 qui est
équivalent à [H3O
+]f
= C0
× 10–
pH mol . L–1
-
Avec C0 :
-
Concentration standard :
C0 =
1,0 mol . L–1
-
xf
= nf
(H3O
+) =
[H3O
+]f
. V1
-
xf
≈ 1,0 × 10–
2,9 ×
40 × 10–3
-
xf
≈ 5,0 × 10–5 mol
-
On constate que
xf
< xmax
-
La réaction, entre l’acide éthanoïque et
l’eau, est instantanée, mais n’est pas totale.
-
Le réactif limitant n’ayant pas
totalement réagi, les réactifs et les produits coexistent dans le mélange
réactionnel à l’état final.
-
On peut compléter le tableau
d’avancement de la réaction :
|
Équation |
CH3COOH
(aq)
|
+ H2O
(ℓ) |
|
CH3COO–
(aq)
|
+ H3O+ (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(CH3COOH) |
|
|
n
(CH3COO–) |
n (H3O+)
|
|
État initial
(mol) |
0 |
n1
= C1
. V1
n1
≈ 4,0
x
10–3 mol |
Solvant
|
|
0 |
0 |
|
Au cours de la
transformation
|
x |
C1
. V1
– x |
Solvant |
x |
x |
|
|
Avancement
final |
xf
|
3,95 × 10–3 |
Solvant |
5,0 × 10–5 |
5,0 × 10–5 |
|
|
Avancement
maximal
|
xmax
|
0 |
Solvant |
|
4,0
× 10–3 |
4,0
× 10–3 |
►
Valeur du taux d’avancement
τ de la réaction
entre l’acide éthanoïque pur et l’eau :
-
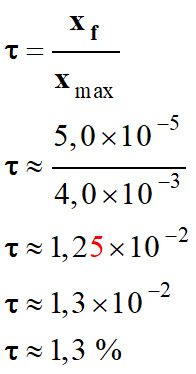
II- L’évolution spontanée d’un système.
a)-
Système ne comportant que des espèces
dissoutes.
-
Considérons la réaction chimique non
totale suivante :
a
. A
(aq) +
b
.
B
(aq)
![]() c
. C
(aq) +
d
.
D
(aq)
c
. C
(aq) +
d
.
D
(aq)
-
Par définition, le quotient de réaction
Qr
de cette réaction s’écrit :
|
|
|
|
Qr
|
Quotient de réaction (sans unité) |
|
[C]
et [D] |
Concentration des produits (mol . L–1) |
|
[A]
et
[B] |
Concentration des réactifs (mol . L–1) |
|
C0 |
Concentration standard : C0 =
1,0 mol . L–1 |
►
Remarque :
-
Pour simplifier l’expression, on omet
de mettre la concentration standard C0.

-
Mais, il ne faut pas oublier que le
quotient de réaction
est une grandeur sans unité
qui caractérise un système chimique dans un état donné :
►
Exemple : Quotient de réaction de la
réaction suivante :
I2
(aq) + 2 S2O32–
(aq) → 2 I–
(aq) + S4O62–
(aq)
-
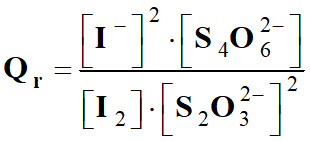
b)-
Cas d’une réaction où le solvant intervient :
- Par convention, l’eau, solvant, n’intervient pas dans l’écriture de l’expression de Qr (même s’il intervient dans l’équation de la réaction)
►
Exemple : réaction entre l’acide
éthanoïque et l’eau :
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO– (aq) |
+ |
H3O+ (aq) |
-
Dans cette réaction, l’eau est le
solvant.
-

c)-
Cas d’une réaction avec des espèces solides :
-
Les espèces chimiques solides
n’apparaissent pas dans l’expression du quotient de réaction.
►
Exemple : écrire le quotient de
réaction de la réaction suivante :
|
Cu (s) |
+ |
2 Ag+
(aq) |
|
Cu2+
(aq) |
+ |
2
Ag (s) |
- 
d)-
Quotient de réaction et sens d’écriture de la
réaction.
|
-
On étudie la réaction entre l’acide
éthanoïque CH3COOH
(aq)
et l’ammoniac NH3
(aq)
en solution aqueuse. - Puis la réaction entre l’éthanoate de sodium (Na+ (aq) + CH3COO–) et le chlorure d’ammonium (NH4+ (aq) + Cℓ–) en solution aqueuse (les ions sodium et chlorure sont spectateurs). -
Écrire les équations des réactions et
donner l’expression des quotients de réactions. -
Quelle remarque peut-on faire ? |
-
Réaction entre l’acide éthanoïque et
l’ammoniac :
|
CH3COOH
(aq) |
+ |
NH3
(aq) |
|
CH3COO
–
(aq) |
+ |
NH4
+ (aq) |
|
Réaction (1) |
|
|||||
-
Réaction entre l’ion éthanoate et l’ion
ammonium :
|
CH3COO
–
(aq) |
+ |
NH4
+ (aq) |
|
CH3COOH
(aq) |
+ |
NH3
(aq) |
|
Réaction (2) |
|
|||||
-
On remarque que :
-
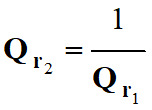
-
L’expression du quotient de réaction
dépend du sens d’écriture de l’équation de la réaction.
-
Les quotients des réactions inverses
sont inverse l’un de l’autre.
-
Dans l’état d’équilibre d’un système,
le quotient de réaction Qr,éq
prend une valeur qui ne dépend pas de l’état initial.
-
La valeur de
Qr,éq
est indépendante de la composition initiale.
-
Cette valeur ne dépend que de la
température.
-
Elle est appelée constante d’équilibre
et on la note K.
K = Qr,éq
-
La valeur de la constante d’équilibre
nous renseigne sur la nature de la réaction chimique.
-
Si K
≥ 104 la
transformation chimique est quasi-totale (on dit aussi totale).
-
Si K
≈ 1 la transformation chimique est équilibrée.
-
Si K ≤ 10–4
la transformation chimique est très limitée.
-
Si la disparition d’un réactif
intervient alors que la valeur du quotient de réaction
Qr,
n’a pas atteint la valeur de K,
la réaction est totale.
►
Exemple : Réaction
entre l’acide éthanoïque et l’eau :
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
–
(aq) |
+ |
H3O
+ (aq) |
-
À l’équilibre
chimique, on peut écrire :

-
Valeur de la constante
d’équilibre K :
-
Tableau d’avancement :
|
Équation |
CH3COOH
(aq)
|
+ H2O
(ℓ) |
|
CH3COO–
(aq)
|
+ H3O+ (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(CH3COOH) |
|
|
n
(CH3COO–) |
n (H3O+)
|
|
État initial
(mol) |
0 |
n1
= C1
. V1
n1
≈ 4,0
x
10–3 mol |
Solvant
|
|
0 |
0 |
|
Au cours de la
transformation
|
x |
C1
. V1
– x |
Solvant |
x |
x |
|
|
Avancement
final |
xf
|
3,95 × 10–3 |
Solvant |
5,0 × 10–5 |
5,0 × 10–5 |
|
|
Avancement
maximal
|
xmax
|
0 |
Solvant |
|
4,0
× 10–3 |
4,0
× 10–3 |
-
néq (CH3COOH) ≈ 3,95 ×
10–3 mol ; néq (CH3COO–) ≈
5,0 × 10–5 mol
-
néq (H3O+) ≈
5,0 × 10–5 mol
-
Volume de la solution : V1 = 40 mL
-
Concentration en ions éthanoate :
-

-
Concentration en ions oxonium :
-

-
Concentration en acide éthanoïque :
-
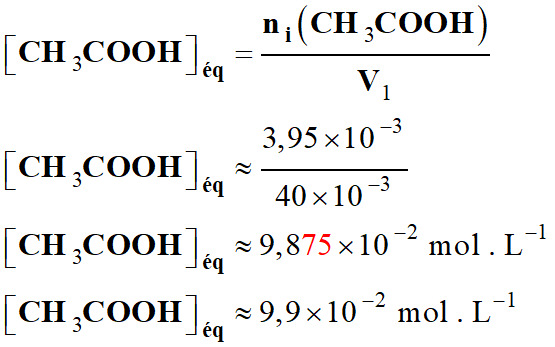
-
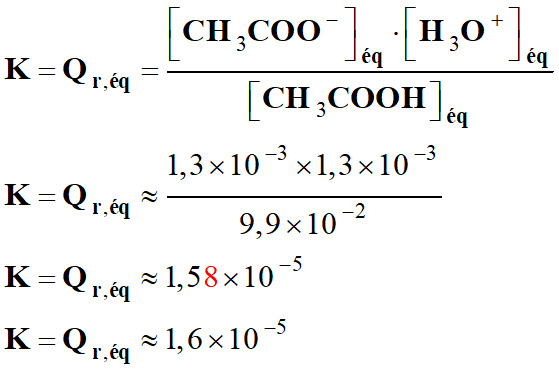
-
Avec les valeurs arrondies, on trouve :
-
K = Qr,éq ≈ 1,7 × 10–5
- La réaction entre l'acide éthanoïque et l'eau est limitée : K < 10–4
3)- Prévision du sens de l’évolution spontanée.
►
Système chimique hors d’équilibre :
-
Tout système chimique, hors
d’équilibre, évolue spontanément vers un état d’équilibre.
-
À une température donnée, la
comparaison du quotient de réaction dans l’état initial,
Qr,i
à la constante d’équilibre K
permet de prévoir le sens d’évolution spontanée du système chimique.
-
Considérons la réaction suivante avec
la terminologie associée :
|
|
|
|
Sens direct
|
|
|
|
|
a A
(aq) |
+ |
b B
(aq) |
|
c C
(aq) |
+ |
d D
(aq) |
|
|
|
|
Sens inverse
|
|
|
|
►
Premier cas :
-
Si le quotient de réaction initial
Qr,i
est égal à la constante d’équilibre K,
-
soit
Qr,i
= K,
le système est déjà à l’équilibre.
-
Il n’évolue pas.
►
Deuxième cas :
-
Si le quotient de réaction initial
Qr,i
est inférieur à la constante d’équilibre
K,
-
soit
Qr,i
< K,
-
Le système chimique évolue spontanément
vers un état d’équilibre.
-
Il évolue dans le
sens direct
de l’écriture de l’équation de la réaction.
►
Troisième cas :
-
Si le quotient de réaction initial
Qr,i
est supérieur à la constante d’équilibre
K,
-
soit
Qr,i
> K,
le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.

►
Remarque :
-
Ce critère d’évolution permet de
prévoir le sens d’évolution spontanée du système connaissant sa composition
initiale.
-
Ce critère ne tient pas compte de
l’aspect cinétique de la réaction.
III- Transfert spontanée d’électrons.
1)- Réaction d’oxydo-réduction.
-
Une transformation spontanée modélisée
par une réaction d’oxydoréduction s’accompagne d’un transfert d’électrons :
-
Direct
si l’oxydant et le réducteur sont en contact ;
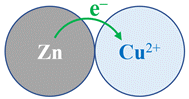
-
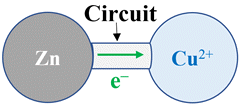
Par un
circuit extérieur
si les réactifs ne sont pas en contact. Le système se comporte comme un
générateur ou une pile.
► Exemples :
![]() Lame de zinc plongée dans une solution de sulfate de cuivre II
Lame de zinc plongée dans une solution de sulfate de cuivre II

-
Il se produit la réaction suivante :
|
Cu
2+
(aq) +
Zn
(s)
→
Cu (s)
+
Zn 2+
(aq) |
-
On observe :
-
Que la lame de zinc se recouvre d’un
dépôt rougeâtre de cuivre métal Cu
(s).
-
Que la solution initialement bleue se
décolore lentement.
-
Lors de cette réaction, les ions cuivre
II Cu2+
(aq) sont réduits en cuivre métal
Cu (s)
-
Et le zinc métal
Zn (s) est oxydé en
ions zinc II Zn2+
(aq).
-
Le transfert d’électrons se fait
directement par
contact entre les réactifs :
-
Le cuivre métal
Cu (s) et les ions
zinc II Zn2+
(aq).
► Cas de la pile
Zn – Cu :
-
Dans le cas de la pile zinc – cuivre,
les électrons se déplacent de l’électrode de zinc vers l’électrode de cuivre, à
l’extérieur de la pile, grâce au circuit électrique.
-
Il s’est produit un échange d’électrons
de façon indirecte
par l’intermédiaire du circuit électrique.
![]() Lame de cuivre plongée dans une
solution de nitrate d’argent.
Lame de cuivre plongée dans une
solution de nitrate d’argent.
|
- Au bout de quelques minutes (20 min environ)
- Au cours de la réaction, il se forme un dépôt gris argenté d’argent métal Ag (s). - La solution prend une teinte bleue. - Le test à la soude avec la solution, donne la formation d’un précipité bleu.
- Il se forme des ions cuivre II, Cu 2+ (aq) au cours de la réaction. |
-
Il se produit la réaction suivante :
|
Cu
(s) + 2
Ag+
(aq)
→
Cu2+
(aq)
+
2
Ag
(s) |
-
Le transfert d’électrons se fait
directement par
contact entre les réactifs le cuivre métal Cu
(s) et les ions argent
Ag+
(aq).
►
Cas de la pile
Cu – Ag :
-
Dans le cas de la pile cuivre – argent,
les électrons se déplacent de l’électrode de cuivre vers l’électrode d’argent, à
l’extérieur de la pile, grâce au circuit électrique.
-
Il s’est produit un échange d’électrons
de façon indirecte
par l’intermédiaire du circuit électrique.
|
-
Une pile est constituée de deux
compartiments distincts, appelés demi-piles. -
Chaque compartiment contient un couple
oxydant-réducteur du type Mn+
(aq) / M
(s). -
Les deux compartiments sont reliés par
un pont salin. -
La plaque métallique
M (s) est appelée
électrode. -
Les transferts d’électrons se
produisent à la surface de l’électrode. -
Une pile convertit de l’énergie
chimique en énergie électrique. |
►
Schéma d’une pile :
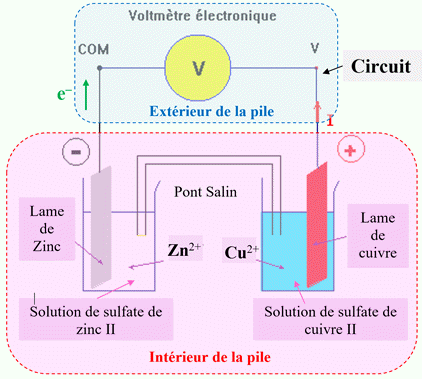
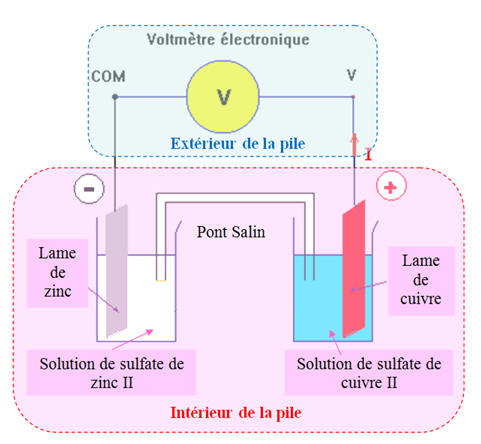
3)- Fonctionnement d’une pile.
►
Exemple : pile Zinc – cuivre :
-
Mesure de la tension :
-
Schéma équivalent :
-
Mesure de la tension aux bornes de la
pile avec un voltmètre électronique :
-
Elle permet de déterminer la polarité
de la pile.
-
La tension mesurée est appelée :
tension à vide.
-
À l’extérieur de la pile (circuit
électrique), le courant électrique est dû à un déplacement d’ensemble des
électrons qui circulent de la borne négative (anode) vers la borne positive
(cathode).
-
À l’intérieur de la pile :
-
Dans les solutions, la conduction
électrique est dû à la double migration des ions positifs et négatifs, présents
dans les différentes solutions, se déplaçant en sens inverses.
►
Remarque :
- Les électrons n’existent pas en solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque.
- Ils se
déplacent vers l’électrode de cuivre grâce au circuit électrique.
-
Le sens conventionnel du courant est
inverse de celui des électrons.
-
Schéma général d’une pile :
-
Le pôle
–
de la pile est le siège d'une
oxydation
(les électrons sont cédés),
-
On l'appelle
l'anode.
-
Le pôle
+
de la pile est le siège d'une
réduction
(les électrons sont captés),
-
On l'appelle la
cathode.
-
L’équation de la réaction de
fonctionnement de la pile est établie en combinant des deux réactions
électrochimiques aux électrodes.
►
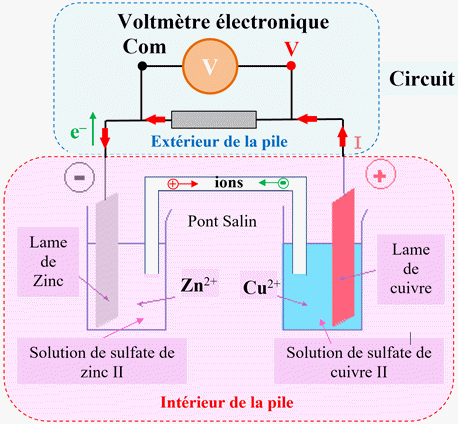
Exemple : la pile Daniell.
-
Différents schémas :


-
Une autre présentation : Mesure de la
tension à vide de la pile Daniell
-
La solution aqueuse de sulfate de
cuivre II contient des ions cuivre II, Cu2+
(aq) et des ions sulfate SO42–
(aq).
-
La solution aqueuse de sulfate de zinc
II contient des ions zinc II, Zn2+
(aq) et des ions sulfate SO42–
(aq).
-
Les réactifs sont :
-
L’anode qui est zinc
Zn (s)
-
Et les ions cuivre II,
Cu2+
(aq) (ils sont présents dans la solution aqueuse de
sulfate de cuivre II).
►
Schéma de la pile :
►
Réactions aux électrodes :
-
Les électrons, responsables du passage
du courant dans le circuit électrique (fils et électrodes), circulent de
l’électrode de zinc vers l’électrode de cuivre à l’extérieur du circuit.
-
Les électrons qui partent de
l’électrode de zinc sont libérés par la réaction suivante :
Zn
(s)
→
Zn 2+
(aq) + 2
e –
-
Les électrons qui arrivent à la borne
de cuivre sont consommés par la réaction suivante :
Cu
2+
(aq) + 2
e
– →
Cu (s)
-
Lorsque la pile débite du courant
électrique, des réactions chimiques se produisent au niveau des électrodes.
-
Le bilan des réactions chimiques
(réactions électrochimiques) qui se produisent à chacune des électrodes de la
pile donne l’équation de la réaction chimique :
-
Équation de la réaction :
|
Cu2+
(aq) +
2 e– →
Cu
(s) |
|
Zn (s)
→
Zn 2+
(aq) +
2 e– |
|
Cu2+
(aq) +
Zn
(s)
→
Cu (s)
+
Zn2+
(aq) |
-
À 25 ° C, la constante d’équilibre de
la réaction de fonctionnement associée à cette équation est
K =
1037.
-
La transformation est considérée comme
totale.
-
On est en présence d’un générateur
électrochimique qui transforme de l’énergie chimique en énergie électrique.
-
Récapitulatif :
-
Le pont salin contient généralement une
solution aqueuse ionique gélifiée.
-
Dans le cas présent, on utilise une
solution aqueuse gélifiée de nitrate d’ammonium :
-
NH4+
(aq) + NO3–
(aq).
-
Le pont salin :
-
Relie les deux demi-piles.
-
Permet de fermer le circuit pour
assurer la circulation du courant.
-
Assure la neutralité électrique des
solutions.
5)- Caractéristique d’une pile.
-
Une pile qui débite un courant
électrique est un système hors d’équilibre :
-
Qr
≠ K.
-
Une pile qui ne débite plus aucun
courant est un système à l’équilibre :
-
Qr
= K
-
On dit que la pile est « usée ».
-
Une pile possède une capacité
électrique Qmax.
►
Capacité électrique d’une pile :
-
La capacité électrique d’une pile est
la charge électrique maximale Qmax
que la pile peut débiter durant sa durée de vie.
|
Qmax
= n (e–)max . NA
. e |
|
|
Qmax |
Capacité électrique de la pile
(coulomb : C) |
|
n
(e–)max |
Quantité maximale d’électrons
échangés (mol) |
|
NA |
Nombre d’Avogadro (mol–1) NA = 6,02 × 1023
mol–1 |
|
e |
Charge élémentaire (coulomb : C) e = 1,60 × 10–19 C |
►
Remarque :
-
La quantité maximale
n (e–)max
d’électrons échangés se détermine à partir de la quantité du
réactif limitant.
-
Il ne faut pas confondre la capacité
électrique d’une pile Qmax
avec le quotient de réaction Qr
d’une réaction chimique.
►
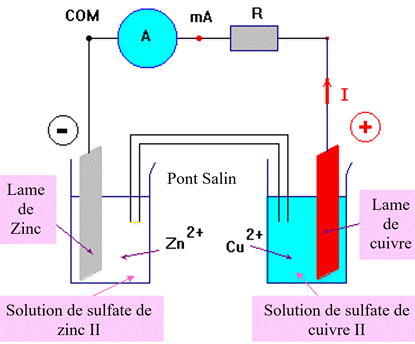
Application : Détermination de la
capacité électrique d’une pile.
-
Calculer la capacité d’une pile Daniell
sachant que :
-
ni
(Zn)
= 0,39 mol ; ni
(Zn2+)
= 0,050 mol
-
ni
(Cu)
= 0,39 mol ; ni
(Cu2+)
= 0,050 mol
-
Volume des solutions :
V = 50 mL
-
À 25 ° C, la constante d’équilibre de
la réaction de fonctionnement associée à cette équation est :
-
K
= 1037
►
Schéma du dispositif :
-
Les réactifs et les produits sont mis
en présence.
-
Équation de la réaction :
|
|
|
|
Sens direct |
|
|
|
|
Cu2+
(aq) |
+ |
Zn
(s) (aq) |
|
Cu (s) |
+ |
Zn2+
(aq) |
|
|
|
|
Sens inverse |
|
|
|
►
Sens d’évolution de la réaction :
-
On calcule le quotient de réaction dans
l’état initial :
-
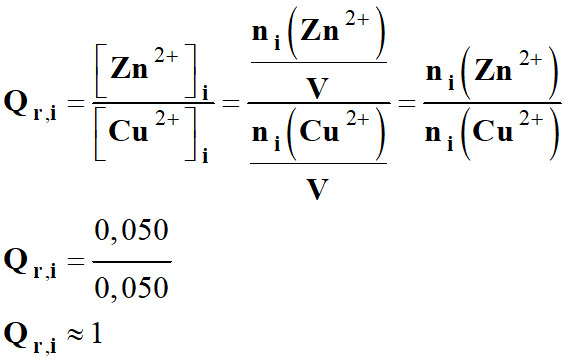
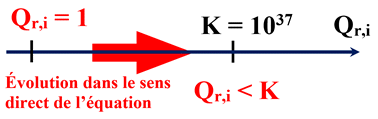
-
De plus
K >
104, la réaction est
totale.
-
En conséquence :
|
|
|
|
Sens direct |
|
|
|
|
Cu2+
(aq) |
+ |
Zn
(s) (aq) |
→ |
Cu (s) |
+ |
Zn2+
(aq) |
-
Tableau d’avancement :
|
Équation |
Cu
2+
(aq)
+ |
Zn
(s) |
→ |
Cu
(s) |
+ Zn
2+
(aq) |
|
|
État |
Avancement
x
(mol) |
|
|
|
|
|
|
État initial (mol) |
0 |
ni (Cu2+)
= 0,050 mol |
ni (Zn)
= 0,39 mol |
ni (Cu)
= 0,39 mol |
ni
(Zn2+)
= 0,050 mol |
|
|
État
Intermédiaire |
x |
ni (Cu2+) –
x |
ni (Zn) – x |
ni (Cu) + x |
ni
(Zn2+) +
x |
|
|
État final |
xf = xmax |
ni (Cu2+) – xmax =
0 |
ni (Zn) – xmax |
ni (Cu) + xmax |
ni
(Zn2+) +
xmax |
|
|
xmax
= 0,050 |
0 |
0,34 |
0,44 |
0,10 |
||
-
Comme la réaction est totale :
xf
= xmax
= 0,050 mol.
-
L’ion cuivre II,
Cu2+,
est le réactif limitant.
►
Capacité électrique d’une pile :
-
Qmax
= n (e–)max
. NA
. e
-
Maintenant, pour pouvoir déterminer la
valeur de la capacité électrique de la pile, il faut connaître le nombre maximal
d’électrons échangés.
-
Il faut utiliser la demi-équation
électronique relative aux ions cuivre II, Cu2+,
(réactif limitant) faisant intervenir les électrons :
|
Cu2+
(aq) +
2 e– → Cu (s) |
-
En conséquence :
n (e–)max
= 2 xmax
-
Qmax
= n (e–)max
. NA
. e
-
Qmax
= 2 xmax
. NA
. e
-
Qmax
= 2 × 0,050 × 6,02 × 1023
× 1,60 × 10–19 (mol
. mol–1 . C)
-
Qmax
≈ 9,6 × 103 C
6)- Les oxydants et les réducteurs usuels.
►
Les réducteurs :
-
Pour constituer une pile, on choisit le
plus souvent comme électrode des métaux très
réducteurs qui
cèdent facilement
des électrons.
-
C’est le cas des métaux dont les
éléments appartiennent aux colonnes 1 et 2 du tableau périodique.
-
Électronégativité des éléments
chimiques :
-
Tableau réduit :
-
Le dihydrogène et les métaux comme le
zinc sont aussi de bon réducteurs.
►
Exemple :
-
Le lithium est beaucoup utilisé pour la
fabrication de piles et accumulateurs.
-
Les piles fabriquées à partir de
lithium possèdent une grande capacité électrique et une tension à vide élevée.
-
Pile zinc – air :
-
Les recherches actuelles pour les
véhicules électriques tendent à utiliser des accumulateurs « Li-ion » dans
lesquels l'élément lithium est apporté sous forme ionique par le composé
LiFePO4.
-
La tension de fonctionnement de ces
accumulateurs est de l'ordre de 3,3 V.
-
Leur temps de recharge a été
considérablement diminué mais reste malgré tout encore environ de trois heures.
-
Piles alcalines :
-
Piles salines :

►
Les oxydants :
-
Un bon
oxydant : Espèce
chimique capable de capter
facilement des électrons.
-
Tableau des espèces oxydantes à
connaître :
|
Espèces oxydante |
Nom de l’espèce |
Milieu |
|
O2
(g) |
Dioxygène |
Air |
|
CℓO–
(aq) |
Ion hypochlorite |
Eau de Javel |
|
Cℓ2
(g) |
Dichlore |
|
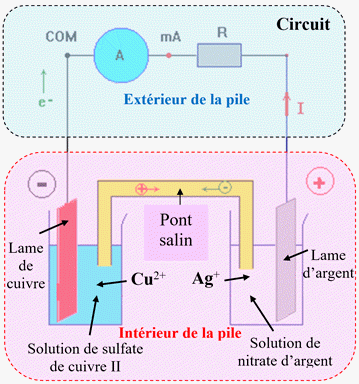
1)- Réalisation d’une pile. Étude de la pile
cuivre-argent.

-
Schéma équivalent :
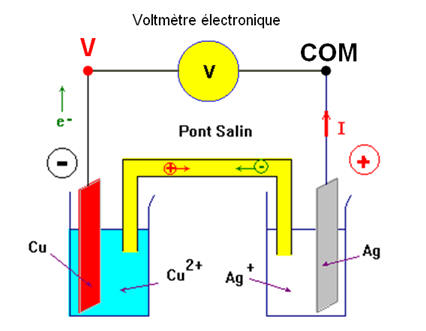
-
Le système constitué :
-
Une électrode d’argent plongée dans une
solution de nitrate d’argent
-
Une électrode de cuivre plongée dans
une solution de sulfate de cuivre II
-
Et du pont salin (le tube en U est
rempli d’une solution aqueuse gélifiée de nitrate d’ammonium
NH4+
aq +
NO3–
aq).
-
Constitue une pile.
-
UCu-Ag
≈ – 0,357 V
-
Le signe de cette tension permet de
déduire :
-
La nature des pôles de la pile et le
sens du courant à l’extérieur de la pile.
-
Dans le cas présent,
l’électrode d’argent
constitue la borne positive
de la pile et l’électrode de cuivre
la borne négative.
-
Le courant, généré par cette pile,
circule de l’électrode d’argent vers l’électrode de cuivre à l’extérieur de la
pile.
-
Les électrons, responsables du passage
de ce courant dans le circuit électrique (fils et électrodes), circulent de
l’électrode de cuivre vers l’électrode d’argent à l’extérieur du circuit.
-
À l’intérieur de la pile les porteurs
de charges sont les ions.
-
Le courant électrique à l’intérieur de
la pile est dû à la double migration des ions positifs et négatifs, présents
dans les différentes solutions, se déplaçant en sens inverses.
►
Remarque :
-
Les électrons n’existent pas en
solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque.
-
Ils se déplacent vers l’électrode de
cuivre grâce au circuit électrique.
-
Les cations se déplacent dans le sens
du courant électrique et les anions se déplacent en sens inverse de celui du
courant électrique.
-
Rôle du pont salin :
-
La solution gélifiée de nitrate
d’ammonium, présente dans le pont salin, assure la conduction électrique entre
les solutions contenues dans les deux béchers.
-
Les électrons, responsables du passage
du courant dans le circuit électrique (fils et électrodes), circulent de
l’électrode de cuivre vers l’électrode d’argent à l’extérieur du circuit.
-
Les électrons qui partent de
l’électrode de cuivre sont libérés par la réaction suivante :
Cu
(s)
→
Cu 2+
(aq) + 2
e –
-
Les électrons qui arrivent à
l’électrode d’argent sont consommés par la réaction suivante :
Ag
+
(aq) +
e
– →
Ag (s)
c)-
Polarité de la pile, réactions aux électrodes
et nom des électrodes.
-
À la
borne positive, ici l’électrode d’argent, les
électrons qui arrivent sont consommés par la réaction
Ag
+
(aq) +
e
– →
Ag (s)
-
Cette électrode est appelée la
Cathode.
-
L’argent métal
Ag (s) est formé.
-
À la
borne négative de la pile, ici l’électrode de
cuivre les électrons sont créés par la réaction
Cu
(s)
→
Cu 2+
(aq) + 2
e –
-
Cette électrode est appelée l’anode.
-
Le cuivre métal
Cu (s)
est consommé.
d)-
Réaction de fonctionnement de la pile.
-
Lorsque la pile débite du courant
électrique, des réactions chimiques se produisent au niveau des électrodes.
-
Le bilan des réactions chimiques
(réactions électrochimiques) qui se produisent à chacune des électrodes de la
pile donne l’équation de la réaction chimique :
-
Équation de la réaction :
|
2 (Ag
+
(aq) +
e
– →
Ag
(s)) |
|
Cu (s)
→
Cu 2+
(aq) +
2 e
– |
|
2
Ag +
(aq)
+
Cu
(s)
→
2
Ag
(s)
+
Cu 2+
(aq) |
-
On est en présence d’un générateur
électrochimique qui transforme de l’énergie chimique en énergie électrique.
|
QCM Réalisé avec le logiciel Questy Pour s’auto-évaluer La transformation non totale. L’évolution spontanée d’un système Le transfert spontanée d’électrons. |
|
Préparation à l'ECE :
L’apparition du sulfure
d’argent Ag2S
(s) 1)- Exercice
05 page 144 : Déterminer un taux d’avancement final. 2)- Exercice
07 page 145 : Exprimer un quotient de réaction. 3)- Exercice
09 page 145 : Prévoir un sens d’évolution spontanée. 4)- Exercice
10 page 145 : Évaluer une constante d’équilibre : 5)-
Exercice 13 page 146 : Identifier la polarité d’une pile. 6)- Exercice
17 page 146 : Identifier des oxydants et des réducteurs. 7)- Exercice
18 page 146 : Identifier des oxydants et des réducteurs. 8)- Exercice
21 page 147 : La pluie d’or. 9)- Exercice
26 page 149 : Des piles « rechargeables ». 10)- DS N°
01 : Solubiliser l’aspirine (35 min) : exercice 27 page 150. 11)- DS N°
02 : Choisir une pile bouton (15 min) : exercice 28 page 151. |
|
|