|
Synthèse de l'acide benzoïque. correction. |
|
|
Mots clés : Séance de travaux pratiques, synthèse de l'acide benzoïque, E 210, acide benzoïque , chauffage à reflux, alcool benzylique, permanganate de potassium, oxydation d'un alcool primaire, équation bilan, demi-équation électronique, tableau d'avancement, réactif limitant, avancement maximal, rendement de la réaction ; ... |
|
|
|
I- Synthèse d’un acide carboxylique : L’acide benzoïque. (Séance de travaux pratiques) |
I- Synthèse d’un acide carboxylique : L’acide benzoïque. (Séance de travaux pratiques)
1)- L’acide benzoïque :
- L’acide benzoïque C6H5–COOH est utilisé comme conservateur (E 210) dans l’industrie agroalimentaire.
- Au laboratoire, on peut préparer l’acide benzoïque à partir de l’alcool benzylique C6H5 –CH2OH.
2)- Principe de la synthèse.
- On oxyde l’alcool benzylique, alcool primaire par l’ion permanganate MnO4– (aq) en milieu basique.
- On utilise le chauffage à reflux pour accélérer la réaction.
- L’acide benzoïque est obtenu sous forme d’ions benzoate C6H5 – COO– (aq) en solution aqueuse.
- Après séparation de la phase liquide, on ajoute de l’acide chlorhydrique. L’acide benzoïque précipite et on le récupère par filtration.
3)- Données :
|
|
M g
/ mol |
densité |
θéb
°C |
Solubilité dans l’eau à 20 ° C |
Pictogrammes |
Nouveaux |
|
Alcool benzylique |
108 |
1,042 |
205 |
40 g / L |
|
|
|
Acide benzoïque |
122 |
1,32 |
249 |
2,9 g / L |
|
|
|
Permanganate de potassium |
|
|
|
|
|
|
|
Acide chlorhydrique |
|
|
|
|
|
|
4)- Manipulation :
a)- Montage et protocole.
- Chauffage à reflux. Réaliser le montage suivant et faire le schéma.
![]() Pour
synthétiser l’acide benzoïque, on suit le protocole expérimental
suivant :
Pour
synthétiser l’acide benzoïque, on suit le protocole expérimental
suivant :
![]() Dans le ballon bicol, on
introduit un volume V = 2,0
mL de d’alcool benzylique (densité
d = 1,042),
Dans le ballon bicol, on
introduit un volume V = 2,0
mL de d’alcool benzylique (densité
d = 1,042),
![]() puis 20
mL d’une solution de soude (Na+
(aq) + HO–
(aq)) et on ajoute quelques grains de pierre ponce pour réguler
l’ébullition.
puis 20
mL d’une solution de soude (Na+
(aq) + HO–
(aq)) et on ajoute quelques grains de pierre ponce pour réguler
l’ébullition.
![]() Dans l’ampoule de coulée, on
introduit 120 mL d’une solution aqueuse à 0,25 mol / L de
permanganate de potassium (K+
(aq) +
MnO4–
(aq)).
Dans l’ampoule de coulée, on
introduit 120 mL d’une solution aqueuse à 0,25 mol / L de
permanganate de potassium (K+
(aq) +
MnO4–
(aq)).
![]() On porte le mélange à
l’ébullition douce.
On porte le mélange à
l’ébullition douce.
![]() On introduit goutte à goutte la
solution oxydante tout en maintenant l’ébullition.
On introduit goutte à goutte la
solution oxydante tout en maintenant l’ébullition.
![]() Lorsque l’addition de la solution
oxydante est terminée, on prolonge l’ébullition douce pendant
une dizaine de minutes.
Lorsque l’addition de la solution
oxydante est terminée, on prolonge l’ébullition douce pendant
une dizaine de minutes.
![]() Puis on arrête le chauffage, tout
en maintenant la circulation d’eau et on laisse refroidir.
Puis on arrête le chauffage, tout
en maintenant la circulation d’eau et on laisse refroidir.
![]() On réduit l’ion permanganate en
excès par l’ajout de quelques millilitres d’éthanol par
l’ampoule de coulée jusqu’à disparition de la teinte violette.
On réduit l’ion permanganate en
excès par l’ajout de quelques millilitres d’éthanol par
l’ampoule de coulée jusqu’à disparition de la teinte violette.
![]() On refroidit le ballon dans un
bain d’eau froide.
On refroidit le ballon dans un
bain d’eau froide.
![]() On filtre sur Büchner le mélange
obtenu.
On filtre sur Büchner le mélange
obtenu.
![]() On verse le filtrat dans un
erlenmeyer placé dans un cristallisoir qui contient de la glace
pilée.
On verse le filtrat dans un
erlenmeyer placé dans un cristallisoir qui contient de la glace
pilée.
![]() On ajoute délicatement une
solution aqueuse d’acide chlorhydrique de concentration
C = 2,0
mol /L.
On ajoute délicatement une
solution aqueuse d’acide chlorhydrique de concentration
C = 2,0
mol /L.
![]() Il se forme un précipité blanc
d’acide benzoïque.
Il se forme un précipité blanc
d’acide benzoïque.
![]() Une fois le mélange bien
refroidit, on sur Büchner.
Une fois le mélange bien
refroidit, on sur Büchner.
![]() On sèche bien le solide obtenu
que l’on place dans un verre de montre.
On sèche bien le solide obtenu
que l’on place dans un verre de montre.
![]() On pèse le solide une fois sec :
On pèse le solide une fois sec :
![]() Donner la masse
mexp
d’acide benzoïque récupéré :
mexp
= 1,9 g
Donner la masse
mexp
d’acide benzoïque récupéré :
mexp
= 1,9 g
1)- Le chauffage à reflux : Quelles sont les caractéristiques du chauffage à reflux ?
- Ce montage permet de maintenir le milieu réactionnel à une température constante, en l'occurrence pratiquement la température d'ébullition du solvant.
- Les vapeurs sont condensées dans le réfrigérant et retournent à l'état liquide dans le ballon.
- Les réactifs et les produits restent dans le milieu réactionnel.
- Il permet d’accélérer la réaction sans perte de matière.
2)- Écrire les demi-équations électroniques et l’équation de la réaction :
|
4
(
MnO4–
(aq) +
2 H2O
(ℓ)
+
3
e
–
=
MnO2
(s)
+
4
HO–
(aq)
) |
|
3
(
C6H5 –CH2OH
(ℓ)
+
5
HO–
(aq)
=
C6H5–COO–
(aq)
+
4
e
–
+
4
H2O
(ℓ)
) |
|
3
C6H5 –CH2OH
(ℓ)
+ 4 MnO4–
(aq) →
3
C6H5–COO–
(aq)
+ 4 MnO2
(s) +
HO–
(aq) + 4
H2O
(ℓ)
|
3)- Écrire l’équation de la réaction entre l’ion benzoate et l’ion hydrogène :
► Équation de la réaction entre l’ion benzoate et l’ion hydrogène :
|
C6H5 – COO–
(aq) + H+
(aq) →
C6H5 – COOH
(s) |
4)- Donner le tableau d’avancement de la réaction :
- Calculer les quantités de matière initiales de chaque réactif.
- En déduire le réactif limitant et l’avancement maximal xmax .
- Calculer la quantité de matière d’ions benzoate obtenue : c’est la quantité maximale d’ions benzoate attendue.
- En déduire la quantité de matière d’acide benzoïque obtenue : c’est la quantité maximale d’acide benzoïque attendue..
- En déduire la valeur du rendement ρ de la réaction.
- Tableau d’avancement, réactif limitant et avancement maximal.
![]() Quantités de matière initiales :
Quantités de matière initiales :
- Quantité de matière initiale d’alcool benzylique :
-
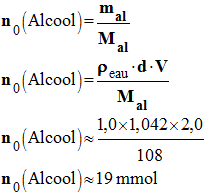
- n0 (Alcool) ≈ 19 mmol
- Quantité de matière initiale d’ions permanganate :
- n0 (MnO4–) = C · V
- n0 (MnO4–) ≈ 120,0 × 10– 3 × 0,25
- n0 (MnO4–) ≈ 30 mmol
- Tableau d’avancement :
|
Équa. |
3 C6H5 –CH2O (ℓ) |
+
4 MnO4–
(aq) |
→ |
3 C6H5–COO–
(aq) |
+
4 MnO2
(s) |
+
HO– (aq) |
+
4 H2O
(ℓ) |
|
|
mmol |
mmol |
|
|
mmol |
mmol |
mmol |
|
État i |
n0
(Alcool) ≈ 19 |
n0
(MnO4–)
≈ 30 |
|
0 |
0 |
– |
– |
|
État x |
n0
(Alcool) – 3x |
n0
(MnO4–)
– 4x |
|
3
x |
4
x |
– |
– |
|
État
max |
n0
(Alcool) – 3xmax |
n0
(MnO4–)
– 4 xmax |
|
3
xmax |
4
xmax |
– |
– |
![]() Réactif limitant et avancement maximal :
Réactif limitant et avancement maximal :
- Hypothèse 1 : l’alcool est le réactif limitant
- Alors : n0 (Alcool) – 3 xmax1 = 0
- xmax1 = n0 (Alcool) / 3
- xmax1 ≈ 6,3 mmol
- Hypothèse 2 : le réactif limitant est l’ion permanganate :
- n0 (MnO4–) – 4 xmax2 = 0
- xmax2 = n0 (MnO4–) / 4
- xmax2 ≈ 7,5 mmol
- Valeur de l’avancement maximal xmax :
- Il est égal à la plus petite des deux valeurs :
- xmax = xmax1 ≈ 6,3 mmol < xmax2 ≈ 7,5 mmol
- Le réactif limitant est l’alcool.
- Maintenant, on peut compléter le tableau d’avancement.
|
Équa. |
3 C6H5 –CH2OH (ℓ) |
+ 4 MnO4– (aq) |
→ |
3 C6H5–COO– (aq) |
+ 4 MnO2 (s) |
+ HO– (aq) |
+
4 H2O
(ℓ) |
|
|
mmol |
mmol |
|
|
mmol |
mmol |
mmol |
|
État i |
n0 (Alcool) ≈ 19 |
n0 (MnO4–) ≈ 30 |
|
0 |
0 |
– |
– |
|
État x |
n0 (Alcool) – 3x |
n0 (MnO4–) – 4x |
|
3 x |
4 x |
– |
– |
|
État max |
0 |
4,8 |
|
19 |
25 |
– |
– |
![]() Quantité de matière d’ions benzoate obtenue :
c’est la quantité maximale d’ions benzoate attendue.
Quantité de matière d’ions benzoate obtenue :
c’est la quantité maximale d’ions benzoate attendue.
- nmax (Benzaoate) ≈ 19 mmol
![]() Quantité de matière d’acide benzoïque obtenue :
c’est la quantité maximale d’acide benzoïque attendue.
Quantité de matière d’acide benzoïque obtenue :
c’est la quantité maximale d’acide benzoïque attendue.
- Lors de la réaction :
|
C6H5–COO–
(aq) + H+
(aq) →
C6H5–COOH
(s) |
- Les ions hydrogène H+ (aq) sont introduits en excès :
- En conséquence : nmax (Benzaoate) = nmax (Acide benzoïque) ≈ 19 mmol
- Masse d’acide benzoïque attendue :
- mmax (Acide benzoïque) = nmax (Acide benzoïque) . M (Acide benzoïque)
-
mmax (Acide benzoïque) ≈ 19
× 10
– 3
× 122
-
mmax (Acide benzoïque) ≈ 2,3 g
![]() Rendement de la réaction :
Rendement de la réaction :
- On a obtenu une masse mexp = 1,9 g.
-
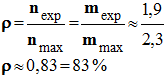
- Le rendement obtenu est de 83%. Il est inférieur à 100%.
- Plusieurs causes peuvent expliquer ce résultat :
- L'avancement maximal n'était peut-être pas atteint.
- De l'acide benzoïque reste dissout dans l'eau et ne cristallise pas.
- Le rinçage du précipité à l'eau distillée peut dissoudre une petite quantité d'acide benzoïque cristallisé.
- Pour purifier l’acide benzoïque obtenu, on peut utiliser une méthode assez simple : la recristallisation.
5)- Comment peut-on caractériser le produit synthétisé ?
- On peut faire C.C.M.
- On peut déterminer la valeur de la température de fusion au banc Kofler.

|
|







