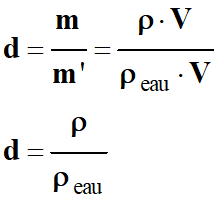|
Chim. N° 02
|
Extraction et
caractérisation
d'espèces chimiques.
Exercices
|
|
Pour
aller plus loin :
|
Mots clés :
Extraction des espèces
chimiques ; les méthodes d'extraction ; chromatographie ;
chromatographie
en phase gazeuse ; la distillation ; l'entraînement à
la vapeur ;
la distillation fractionnée ; l'ampoule à
décanter ; la densité ; la masse volumique ;
l'éthanol
; l'éther éthylique ; ...
|
1)
Exercice 4 page 210.
|
Déterminer la densité de
l'éthanol
L'étiquette d'un flacon d'éthanol
présente les informations ci-après :
|
Éthanol
|
|
C2H5OH Alcool éthylique
|

F
|
|
M = 46,07 g / mol ;
d = 0,79 ;
Teb
= 78,5 ° C
|
|
R : 11 S : 7-16
|
On souhaite vérifier la densité
de l'éthanol.
On dispose pour cela d'une balance,
d'éprouvettes graduées,
de béchers et d'un
flacon d'éthanol.
1. A l'aide de la fiche 5 des rabats
de couverture,
préciser les mesures de sécurité
à respecter pour manipuler sans danger l'éthanol.
2. Proposer un protocole permettant de
déterminer la densité
de l'éthanol.
3. Lors d'une expérience, on a
trouvé qu'un volume V = 20 cm3 d'éthanol
de masse m = 15,8 g,
alors que le même volume
d'eau a une masse meau= 20,0 g.
En déduire la densité d
de l'éthanol par rapport à l'eau.
|
|
Correction
1.
Mesures de sécurité :
|
Espèces
chimiques inflammables
|
|
Elles
prennent feu
au contact
d’une flamme :
alcool, essence, butane
|
|

|
|
Il
faut impérativement
respecter les consignes
de sécurité.
|
|
Il
faut éloigner ces
espèces chimiques
de toute flamme.
|
|
Rappels
:
-
La densité des liquides et des solides se mesure
par rapport à l’eau.
-
La densité des gaz se mesure par rapport
à l’air.
| d = |
Masse d'un volume
V de l'espèce
chimique |
|
| Masse d'un même volume V d'eau |
-
Conséquence :
Masse d'un volume V de
l'espèce chimique :
m =
ρ
. V
- Masse du même volume V
d'eau :
m' =
ρ
eau .
V
- Densité :
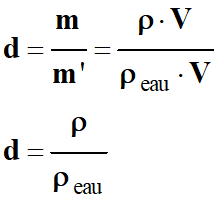
- La densité est un nombre qui n’a pas d’unité.
|
2. Protocole expérimental.
Première étape :
Peser la masse d'éthanol
contenu dans une fiole jaugée de volume V = 25 mL.
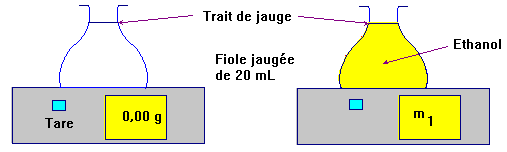
Deuxième étape :
Peser le même volume
V = 25 mL d'eau.
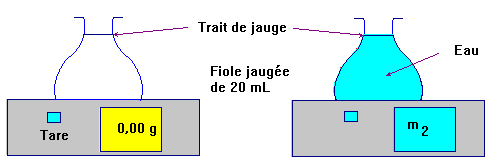
Troisième étape : Faire le quotient des
deux masses.
3. Densité de l'éthanol par rapport à
l'eau.
| |
m
1 |
|
| d = |
|
|
| |
m
2 |
|
| |
15,8 |
|
| d = |
|
|
| |
20,0 |
|
| |
|
|
| d
≈ |
0,79 |
|
|
2)
Exercice 5 page 210.
|
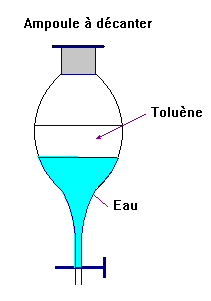
Exploiter la densité de l'eau et du toluène.
Le toluène et l'eau sont des liquides non miscibles.
Le
toluène a une densité par rapport à l'eau
d = 0,86.
Dessiner une ampoule à décanter contenant ces deux
liquides en précisant la nature de chaque phase.
|
|
Correction
|
3)
Exercice 7 page 210.
|
Exploiter les propriétés
des solvants pour extraire l'aspirine.
L'aspirine ou acide acétylsalicylique
est peu soluble dans l'eau ; à 25 ° C,
sa solubilité
n'y est que de 3,4 g / L.
Elle est en revanche très soluble
dans l'éthanol
(d = 0,79) ou
dans l'éther éthylique
(d = 0,71), solvant dont le document ci-après présente
un extrait de l'étiquette.
|
|
|
|

F+
|
|
|
|
|
L'eau et l'éthanol sont miscibles
en toutes proportions, alors que l'éther et l'eau sont
non miscibles.
1. Une solution d'aspirine de volume
V = 200 mL contient une masse m = 0,52 g d'aspirine.
Est-elle
saturée
?
2. On souhaite extraire cette aspirine
soit avec de
l'éthanol soit avec de l'éther éthylique.
-
On dispose du matériel suivant :
- ampoule à décanter,
entonnoir, béchers, supports
divers, noix de fixation,
-
éprouvettes graduées, évaporateur à
solvant.
a. Lequel de ces deux solvants convient-il
d'utiliser ? Justifier la réponse.
b. Proposer un protocole permettant de
réaliser cette extraction.
Faire un schéma illustrant l'étape
principale de l'extraction en précisant bien la position
des diverses phases.
c. A l'aide de la fiche 5 des rabats
de couverture, préciser les mesures de sécurité
à respecter pour manipuler sans danger le solvant choisi.
|
Correction
:
|
1)-
La solution est saturée lorsque
le soluté introduit
ne peut plus se dissoudre et forme un dépôt solide.
Une solution est saturée dès que le solvant ne peut
dissoudre la totalité
du soluté.
En filtrant cet ensemble au travers d'un papier filtre,
on obtient, d'une part, la solution saturée
parfaitement limpide
et, d'autre part, le résidu solide
Ø
On
peut faire un tableau de proportionnalité :
|
Volume
de
solvant
|
1000
mL = 1 L
|
200
mL
|
|
Masse
d’aspirine
|
3,4
g
|
m
=
|
|
|
|
|
200 x
3,4
100
|
|
|
|
|
|
|
|
m
= |
=>
|
m
≈ 0,68 g
|
|
|
|
|
|
|
|
|
Dans
200 mL d’eau, on peut dissoudre
0,68 g d’aspirine.
La solution
n’est pas saturée car
m
= 0,52 g
|
|
|
2)-
Extraction de l’aspirine :
a)- Solution à utiliser :
Pour extraire l’aspirine,
il faut utiliser l’éther éthylique.
L’aspirine est soluble dans l’éthanol
et l’éther éthylique,
mais l’éther éthylique est insoluble dans l’eau.
Alors que l’éthanol est soluble dans l’eau en toutes
proportions.
b)- Protocole :
Dans une ampoule à décanter, on verse
la solution d’aspirine.
On ajoute un peu d’éther éthylique.
Après
une agitation vigoureuse, on laisse décanter.
L’éther
éthylique et l’eau étant non miscible, on se trouve en présence de
deux phases :
la phase organique est située au-dessus de la phase
aqueuse car l’éther éthylique est moins dense que l’eau.
L’aspirine
étant plus soluble dans l’éther éthylique que dans l’eau se trouve
principalement dans la phase supérieure.
On récupère la phase supérieure
et on fait évaporer le solvant pour obtenir l’aspirine solide (solide
blanc).
On a réalisé l’extraction par un solvant.
c)- Mesures de sécurité :
Il faut éviter toute flamme
et toute source de chaleur.
- D’après les pictogrammes, l’éther éthylique est inflammable.
- Il faut l’éloigner
de toutes sources de chaleur et de toutes flammes, étincelles.
- De plus, il faut travailler dans un endroit ventilé.
|
4)
Exercice 14 page 212.
|
Séparation d'un
mélange de diiode I2 et
de chlorure de fer III
FeCl3
A 25 ° C, le diiode
I2 et le chlorure de fer III FeCl3 sont deux
solides.
Le diiode est très
soluble dans l'éther éthylique et peu soluble dans l'eau
alors que le chlorure de fer III est insoluble dans l'éther
éthylique et très soluble dans l'eau.
En solution aqueuse,
le diiode est jaune orangé et
le chlorure de fer III orange-marron.
Dans l'éther
éthylique le diiode et violet.
L'eau est l'éther
éthylique sont non miscibles.
On dispose d'une solution
aqueuse S contenant, outre l'eau, uniquement du diiode et
du chlorure
de fer III.
1. En utilisant les
connaissances du Collège, décrire des tests permettant
de vérifier
que la solution étudiée contient
du diiode, des ions fer III Fe3+ et des ions chlorure
Cl
–.
2. Proposer, en la
justifiant à l'aide des données, une méthode
permettant d'obtenir à partir
de la solution S deux solutions,
l'une de diiode, l'autre de chlorure de fer III.
3. Décrire les
opérations à effectuer et, pour les différentes
étapes, faire des schémas légendés et
colorés.
4. Comment terminer
cette manipulation pour obtenir les deux solides I2 et
FeCl3 ?
- Données :
Température d'ébullition
:
éther éthylique 34 ° C ; eau : 100 ° C
- Densité : éther éthylique : 0,71
|
Correction :
|
Séparation d'un mélange de diiode I2
et de chlorure de fer III FeCl3
1)-Test du diiode et test des ions fer
III :
- En présence d’empois d’amidon, une solution
jaune-orangé
de diiode prend une teinte bleue à violacée.
-
Ce test est caractéristique du diiode.
- Une solution orange de chlorure de fer
III
donne un
précipité rouille d’hydroxyde de fer
III
lorsque l’on verse
quelques gouttes d’une solution incolore
d’hydroxyde de sodium (soude).
-
Ce test est caractéristique des
ions fer
III.
- Une solution incolore de chlorure de sodium donne
un
précipité blanc de chlorure d’argent
lorsque l’on verse
quelques gouttes d’une solution incolore
de nitrate d’argent.
-
Ce
test est caractéristique des ions chlorure.

|
|
Ag
+ (aq) + Cl
–
(aq)
® AgCl (s)
|
|
2)-
Extraction par un solvant :
Le diiode est très soluble dans
l'éther éthylique et peu
soluble dans l'eau alors que
le chlorure
de fer
III
est
insoluble dans l'éther éthylique et très soluble dans l'eau.
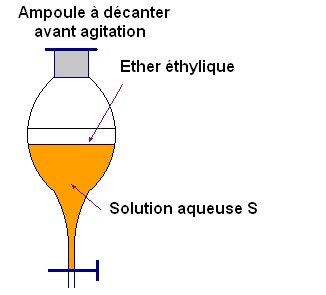
On verse la solution
S
dans une ampoule à décanter.
On ajoute un peu d’éther éthylique.
Après une agitation vigoureuse, on laisse décanter.
L’éther éthylique et l’eau étant non miscible, on se trouve
en présence de deux phases :
la phase organique est située
au-dessus de la phase aqueuse car l’éther éthylique est moins dense
que l’eau.
Le diiode étant plus soluble dans l’éther éthylique que
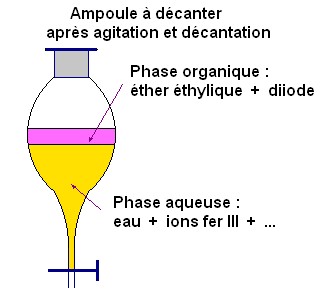
dans l’eau se trouve principalement dans la phase supérieure.
Les
ions fer
III
se retrouve dans la phase aqueuse située au-dessous.
On peut facilement
séparer les deux phases.
L’une contient le diiode (couleur violette)
et l’autre contient les
ions fer
III
(couleur orange-marron).
3)-
Schémas légendés des différentes étapes :
4)-
Pour obtenir les résidus solides, il faut évaporer les
solvants.
Pour l’éther éthylique, il faut travailler sous la
hotte.
|
5)- Exercice 1 page
224. Connaître le matériel de chromatographie.
Le schéma ci-contre
représente
une
chromatographie en
cours d'élution. |
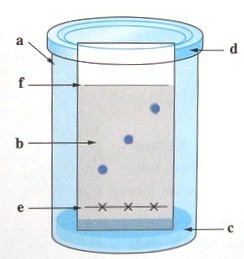 |
| Légender ce schéma. |
| |
|
Le schéma ci-contre
représente
une
chromatographie
en cours d'élution.
|

|
a
|
Bécher
|
|
Légender ce schéma.
|
b
|
Plaque
chromatographique
|
|
Correction
:
déplacer la souris
sur les différentes
lettres
|
c
|
Eluant
|
|
d
|
Boîte de
Pétri
|
|
e
|
Ligne de
dépôts
|
|
f
|
Front du
solvant
|
6)- Exercice 4 page 224. Déterminer
un rapport frontal.
|
On réalise, sur un support donné et avec un éluant
approprié,
la chromatographie des colorants rouges C1,
C2,
C3 présents
dans deux types de bonbons rouges
B1 et B2.
Le
chromatogramme obtenu est représenté ci-dessous.
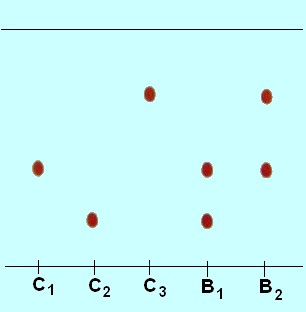
1. Rappeler la définition du rapport frontal.
2. Déterminer le rapport frontal de chacun des colorants.
La chromatographie permet la séparation des constituants d’un mélange.
Des espèces chimiques identiques migrent à des hauteurs identiques
sur une même plaque de chromatographie.
3. En déduire, en justifiant la réponse, quels colorants
contient chacun des bonbons.
|
|
Correction :
1. Définition du rapport frontal.
|
R f
=
|
Distance parcourue par le constituant (milieu
de la tache)
|
|
|
Distance parcourue par le front du solvant
|
2. Rapport frontal de chacun des colorants.
La chromatographie permet la séparation des constituants d’un mélange.
Des espèces chimiques identiques migrent à des hauteurs identiques
sur une même plaque de chromatographie.
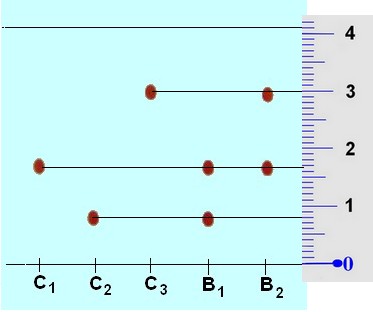
Grace à la règle graduée, on peur
déterminer la valeur du rapport frontal de chaque colorant.
Distance parcourue par l'éluant : H = 4,1 cm
Distance parcourue par le colorant C1 :
h1 = 1,7 cm
Distance parcourue par le colorant C2 :
h2 = 0,80 cm
Distance parcourue par le colorant C3 :
h3 = 3,0 cm
Rapport frontal du constituant C1 :
|
|
h1
H
|
|
|
1,7
4,1
|
|
|
|
|
R f1
= |
Þ
|
R
f1 =
|
=>
|
R
f1 »
0,41
|
|
|
|
|
|
|
Rapport frontal du constituant C2 :
|
|
h2
H
|
|
|
0,80
4,1
|
|
|
|
|
R f2
= |
=>
|
R
f2 =
|
=>
|
R
f2 »
0,20
|
|
|
|
|
|
|
Rapport frontal du constituant C3 :
|
|
h3
H
|
|
|
3,0
4,1
|
|
|
|
R f3
= |
=>
|
R
f3 =
|
=>
|
R
f3 »
0,73
|
|
|
|
|
|
|
3. Les colorants présents dans chaque bonbon
:
Le bonbon rouge B1 est contient un mélange des
deux colorants C1 et C2.
Il apparaît deux taches aux mêmes
niveaux que C1 et C2.
Le bonbon rouge B2 est contient un mélange des
deux colorants C1 et C3.
Il apparaît deux taches aux mêmes
niveaux que C1 et C3.
|
I-
Exercice 12 page 39.
a)- L’arôme de vanille :
- L’arôme de vanille vendu dans le commerce est composé essentiellement
de 3 espèces chimiques :
- la vanilline, l’acide vanillique et l’acide p-hydroxybenzoïque.
- L’arôme de vanille est-il une espèce chimique pure ou un mélange ?
- L’arôme de vanille du commerce est un mélange.
-
Il contient plusieurs
espèces chimiques :
-
la vanilline, l’acide vanillique et l’acide p-hydroxybenzoïque.
b)- La vanilline extraite de la gousse de vanille.
- La vanilline extraite de la gousse de vanille est utilisée en parfumerie
et surtout en pâtisserie.
- Le protocole expérimental
de l’extraction est le suivant : l’extrait de vanille est dilué dans
l’eau puis versé dans une ampoule à décanter.
- Du chloroforme est
ensuite versé dans l’ampoule à décanter.
-
Après agitation vigoureuse et dégazage,
on procède à la séparation des phases.
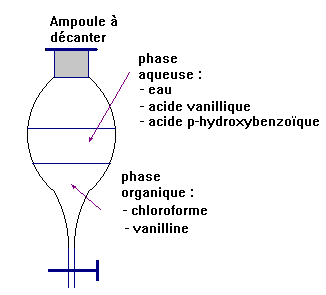
- À l’aide des indications
ci-dessous, faire un schéma de l’ampoule à décanter et préciser le contenu
de chaque phase.
- Données :
-
Le chloroforme est présent dans la phase inférieure.
-
La vanille est très soluble dans le chloroforme et peu soluble dans l’eau.
- L’acide vanillique et l’acide p-hydroxybenzoïque sont solubles
dans l’eau.
-
La densité du chloroforme est supérieure à 1.
- Les espèces chimiques présentes dans la phase inférieure sont :
le chloroforme et la vanilline.
- Le chloroforme est plus dense que
l’eau et insoluble dans l’eau.
- La vanilline est plus soluble dans
le chloroforme que dans l’eau.
- La phase supérieure comprend : l’eau, l’acide vanillique et
l’acide p-hydroxybenzoïque.
- Schéma :
b)- De quel type d’extraction s’agit-il ? quel
est le rôle du chloroforme ?
- Il s’agit d’une extraction par un solvant.
-
Le chloroforme est le
solvant.
-
Il permet d’extraire la vanilline de l’arôme de vanille.
c)- Quelles sont les opérations à effectuer après la séparation des phases
contenues dans l’ampoule pour isoler la vanilline pure
?
- Séchage de la phase organique avec du sulfate de sodium anhydre.
- Filtration du sulfate de sodium hydraté.
- Distillation du chloroforme.

II-
Exercice 16 page 40.
a)-
Indiquer la signification des renseignements mentionnés sur l’étiquette
d’une bouteille d’éther (éthoxyéthane).
|
ÉTHOXYETHANE
|
|
900 mL
|
PUR
|
Réf. 1020E
|
|
(C2H5)2O
M = 74,12 g / mol
d= 0,71
Teneur min : 99,0
%
qeb
= 34 ° C
Stockage : hors lumière
|

F+
Très
inflammable
|
Extrêmement
inflammable.
Peut former des peroxydes explosifs.
Conserver le récipient
dans
un endroit bien ventilé.
Conserver à l’écart de toute
source d’ignition
– ne pas fumer.
Ne pas jeter les résidus à l’égout.
Éviter l’accumulation
des
charges électrostatiques.
|
- Caractéristiques physiques
-
Sur l’étiquette figure les caractéristiques physiques de l’éther :
-
sa formule, la masse molaire, le pourcentage de pureté, la densité, la température
d’ébullition.
- De plus, il est indiqué que l’éther est inflammable et qu’il
faut travailler dans un endroit ventilé.
b)- L’éther est couramment employé comme solvant d’extraction. Comparer
sa densité à celle de l’eau.
- L’éther n’est pas soluble dans l’eau.
-
La densité de l’éther est inférieure
à celle de l’eau.
- Dans une ampoule à décanter, l’éther se situe au-dessus
de l’eau.
c)- D’après les informations fournies par l’étiquette, quelles précautions
faut-il prendre pour manipuler l’éther ?
- Les pictogrammes.
- D’après les pictogrammes, l’éther est inflammable.
- Il faut l’éloigner
de toutes sources de chaleur et de toutes flammes, étincelles.
-
De plus,
il faut travailler dans un endroit ventilé.

III-
Exercice 17 page 40.
- Le dichlorométhane a une
densité de 1,326.
-
Calculer sa masse volumique en g
. cm
– 3.
Donnée :
-
L’eau
liquide a une masse volumique égale à 1000 kg . m – 3.
- Masse volumique du dichlorométhane :
|
|
ρ
|
|
|
d =
|
|
|
|
|
ρeau
|
|
|
|
|
|
|
ρ =
d .
ρeau
|
|
|
|
|
|
ρ =
1,326 x 1000
|
|
ρ ≈ 1,326 kg . m -
3 |

IV-
Exercice 18 page 40.
- L’hexane a une masse volumique
égale à 660 kg .
m – 3
et l’eau liquide a une masse volumique égale à 1000 kg . m
– 3.
- Calculer la densité de l’hexane.
-
Densité de l’hexane :
|
|
ρ |
|
|
d =
|
|
|
|
|
ρeau |
|
|
|
|
|
|
|
|
|
|
|
660
|
|
|
d =
|
|
|
|
|
1000
|
|
|
|
|
|
|
|
|
|
|
d ≈
|
0,66
|
|

V-
exercice 20 page 40.
- Dans le tableau suivant sont répertoriées les densités
de mélanges eau-éthanol en fonction du pourcentage volumique d’éthanol contenu
dans le mélange.
- Tableau de valeurs :
|
% volumique
d’éthanol
|
0
|
20
|
40
|
60
|
80
|
100
|
|
Densité
d
|
1,000
|
0,970
|
0,937
|
0,893
|
0,845
|
0,790
|
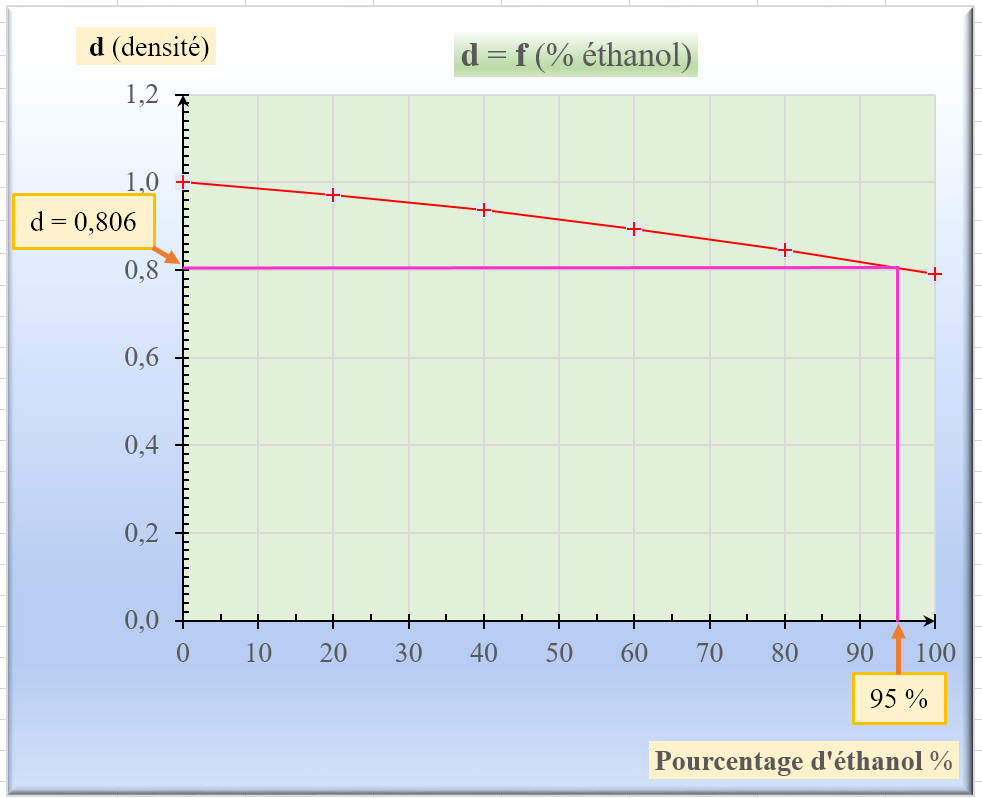
a)- Quelle est la densité de l’éthanol pur ?
- La densité de l’éthanol pur est
d = 0,790
(voir le tableau : pourcentage volumique d’éthanol : 100 %)
b)- Tracer la courbe représentant la densité du mélange eau-éthanol en
fonction du pourcentage volumique d’éthanol.
- Tracé de la courbe :
|
%
Volumique
d’éthanol
|
Densité
d
|
Cliquer sur l'image pour l'agrandir
|
|
0
|
1,000
|
|
20
|
0,970
|
|
40
|
0,937
|
|
60
|
0,893
|
|
80
|
0,845
|
|
100
|
0,790
|
c)-
L’alcool à 95 ° vendu dans le commerce a une densité d = 0,806.
- Que
peut-on en déduire quant à la composition volumique de l’alcool à 95 ° ?
- exploitation
du graphique :
- D’après le graphique, l’alcool à 95 ° contient 95 % d’éthanol en
volume.
- En conséquence : 100 mL d’éthanol à 95 ° permet d’obtenir 95
mL d’éthanol pur.
 Retour
en haut
Retour
en haut