| Chim. N° 01 | L'atome. Cours Exercices Exercices 18 |
|
|
Mots clés : Cours de chimie seconde l'atome, seconde, element chimique ,symbole d'une atome, masse, rayon d'un atome, représentation d'un atome, isotope, ion, noyau d'un atome, charge d'un ion, isotopes, numéro atomique, notation symbolique, conservation du cuivre, dimension, masse, électron, conservation du fer, structure de l'atome, ... |
|
|
|
1)-
Introduction.
2)-
Historique. |
|
|
3)-
Grandeurs caractéristiques
d’un atome ou du noyau d’un atome.
|
|
|
a)- Conservation de l’élément cuivre
b)- Conservation de l’élément fer.
c)- Conclusion. |
|
|
Exercices : énoncé avec correction a)- Exercice 2 : Déterminer un numéro atomique : b)- Exercice 7 : Déterminer la formule d’un ion : c)- Exercice 8 Déterminer la charge d’un ion : d)- Exercice 10 Identifier des noyaux isotopes : e)- Exercice 11 : Chercher la composition d’un noyau ou d’un ion. f)- Exercice 15 : Composition chimique du Soleil de la Terre et du corps humain. g)- Exercice 16 : établir une notation symbolique : |
|
Exercices 2018 : énoncé avec correction 1)- Exercice 6
page 65 : Déterminer la composition d’un noyau 2)- Exercice 7
page 65 : Déterminer la composition d’un atome. 3)- Exercice 8
page 65 : Calculer la masse d’un atome. 4)- Exercice 10
page 65 : Calculer la charge d’un noyau. 5)- Exercice 12
page 65 : Déterminer la charge d’un ion. 6)- Exercice 13
Page 66 : Déterminer la composition d’un ion. 7)- Exercice 20
Page 67 : l’étiquette d’une eu minérale. 8)- Exercice 27
page 69 : Le cinabre : médicament utilisé en homéopathie. |
Toute substance, vivante ou inerte, est constituée à partir d’atomes.
Ils sont le plus souvent associés les uns aux autres pour former des assemblages plus ou moins complexes.
Ils peuvent former des réseaux cristallins (les métaux) ou
des molécules (la molécule d’eau).
La connaissance de l’atome et l’étude de sa structure datent
du XIXe siècle.
Le britannique Thomson découvrit l’électron et Rutherford
mis en évidence la structure lacunaire de l’atome (1897).
► Vers 400 ans av. J.-C.
- Le Grec DÉMOCRITE (460 – 370 av. J.-C) a l’intuition que la matière est constituée de petits « grains » indivisibles, qu’il appelle atomes (du grec atomos, qui signifie « insécable »).
- Il imagine
les atomes pleins et immuables.
► Vers 350 ans av. J.-C.
- ARISTOTE (384 – 322 av. J.-C) ne croît pas à l’existence des atomes.
- Pour lui, la matière est pleine et est constituée d’un mélange de quatre « éléments » : le feu, l’air, la terre et l’eau.
- Son prestige est tel que le modèle de DÉMOCRITE est abandonné.
- Il faudra attendre près de
vingt siècles pour que la notion d’atome soit réhabilitée.
► 1805.
- L’anglais John DALTON (1766 – 1844) reprend l’hypothèse de DÉMOCRITE.
- Selon lui, l’atome est une sphère pleine de matière,
semblable à une boule de billard.
►
1904.
- En 1897, le physicien John Joseph THOMSON (1856 –
1940) découvre l’un des composants de l’atome : l’électron, particule chargée
négativement.
- En 1904, il propose un modèle dans lequel les électrons sont plongés dans une sphère chargée positivement, comme des prunes (plum en anglais) dans un pudding.
- Dans ce modèle, les électrons dispersés au sein de l’atome équilibrent la charge positive de la sphère.
- L’ensemble est
électriquement neutre.
► 1909.
- Le physicien et chimiste britannique Ernest RUTHERFORD (1871 – 1937) bombarde une feuille d’or très fine avec des particules α, bien plus petites que les atomes d’or et chargées positivement.
- Il
observe qu’une tache fluorescente intense apparaît au centre de l’écran et que
quelques taches fluorescentes apparaissent à la périphérie de la tache centrale.
- Schéma de l’expérience de RUTHERFORD :
Cliquer sur l'image pour l'agrandir
- Vidéo :
► 1911.
- Cette expérience a conduit Ernest RUTHERFORD à
proposer, en 1911, un nouveau modèle :
- Un atome est constitué d’un noyau central très petit autour duquel des électrons chargés négativement sont en mouvement, comme les planètes autour du Soleil :
- L’atome est constitué essentiellement de vide.
- Modèle planétaire de l’atome :
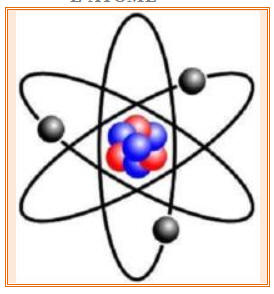
- Ernest RUTHERFORD a mis en évidence la structure
lacunaire de l’atome : l’atome est essentiellement fait de vide.
► Un modèle toujours en évolution.
- De nombreux scientifiques (N. BOHR en 1913, E.
Schrödinger en 1926, J. CHADWICK en 1932, etc…) ont enrichi la description de
l’atome :
- L’atome est constitué :
- D’un noyau et d’électrons en mouvement autour du
noyau.
- Le noyau est constitué de particules : les
protons et les neutrons.
- Les neutrons ne sont pas chargés.
- La charge portée par un proton est exactement
l'opposée de celle portée par un électron.
- L’atome est électriquement neutre.
- Le noyau concentre la plus grande partie de la
masse de l’atome.
- Le modèle actuel de l’atome, appelé modèle
probabiliste, fait intervenir la physique quantique.
- Cette théorie établit que les électrons n’ont pas
d’orbite définie, mais permet de déterminer leur « probabilité de présence »
autour du noyau.
- Modèle probabiliste :
► Pour aller plus loin :
-
Les
nucléons de sont pas des particules élémentaires.
- Ils sont
constitués de particules : les quarks.
-
Les
briques fondamentales de la matière sont donc :
-
Les
quarks qui sont les constituants des protons et des neutrons.
-
Et les
électrons.
- Les
protons et neutrons du noyau sont composés de 3 quarks.
- On
étudie au CERN les interactions entre quarks pour découvrir comment les
particules se sont formées dans les premiers instants de l'Univers.
Cliquer sur l'image pour l'agrandir
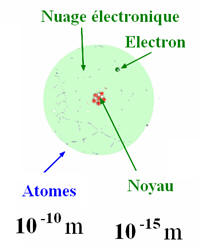
- Un atome est une entité constituée d’un noyau et d’électrons en mouvement dans le vide autour du noyau.
- Le noyau :
- Le noyau est constitué de particules appelées nucléons.
- Les nucléons sont de deux types : les protons et les neutrons.
|
Caractéristiques
du proton |
|
|
|
|
Masse |
mp = 1,67265 × 10–27 kg |
|
Charge |
+ e
= 1,602189
×10 –
19 C
|
|
- C est le symbole du Coulomb unité de charge électrique
|
Caractéristiques
du neutron |
|
|
|
|
Masse |
mn = 1,67496
× 10–27 |
|
Charge |
nulle |
|
- Remarque :
- e représente la charge élémentaire.
- Elle s’exprime en coulomb (symbole C)
- La charge élémentaire a pour valeur
:
e = =
1,602189 × 10–
- La masse du neutron est voisine de celle du proton : m p ≈ m n
|
Caractéristiques
de l’électron |
|
|
|
|
Masse |
m
e = 9,10953
× 10– |
|
Charge |
- e
=
- 1,602189 × 10– 19 C |
|
- Les électrons constituent le cortège électronique de l’atome.
- Mouvement des électrons autour du noyau :
- Les électrons d’un atome se déplacent à grande vitesse et à grande distance autour du noyau.
- Ils n’ont pas de trajectoire bien définie.
- C’est pour cela que l’on parle de nuage électronique.
- On peut délimiter une région de l’espace autour du noyau ou la probabilité de trouver l’électron est maximale.
- Un électron porte une charge électrique négative opposée à la charge du proton.
- La masse du proton est environ 1846 fois celle de l’électron.
3)-
Grandeurs caractéristiques d’un atome ou du noyau
d’un atome.
- Le nombre de nucléons est noté
A, on l’appelle aussi le
nombre de masse.
- Le nombre de protons que contient le noyau est noté
Z.
- On l’appelle aussi le numéro atomique ou le nombre de charge.
- Les deux nombres A et
Z suffisent pour caractériser
un noyau.
- L’atome étant électriquement neutre, le nombre d’électrons d’un atome est égal au nombre de protons.
- On dit que l’électroneutralité est vérifiée pour tout atome.
- La charge positive du noyau, notée Q, est égale à la charge des Z protons qui le constituent :
|
Q = Z . e |
- Les atomes sont représentés par des symboles :
- En général, la première lettre du nom écrite en majuscule.
- On rajoute parfois une deuxième lettre écrite en minuscule pour éviter les confusions.
- On trouve les symboles de tous les atomes dans la classification périodique que l’on étudiera plus tard.
- Le symbole du noyau s’obtient à partir du symbole de l’atome correspondant.
- Exemple : Symbole de l’atome d’hydrogène :
H,
symbole du noyau :
![]()
- Nombre de protons : 1 Nombre de neutrons : 1 Nombre d’électrons : 1
- Formule générale du noyau d’un atome :
![]()
- Exemple :
![]() symbole
du noyau de l’atome de cuivre.
symbole
du noyau de l’atome de cuivre.
- L’atome de cuivre est constitué de Z= 29 protons, A – Z = 34 neutrons et Z = 29 électrons.
- Un atome comprend : Z protons et Z électrons, et A – Z neutrons.
- Les deux grandeurs A et Z permettent de caractériser un noyau ou un atome.
|
Atome le plus léger |
Atome d’Hydrogène |
m H = 1,67 x 10 – |
|
L’un des plus lourd |
Atome d’Uranium |
m U = 3,95 x 10 – |
- La masse d’un atome est essentiellement concentrée sur son noyau car la masse des électrons est négligeable devant celle des nucléons :
- mp
≈
- La masse d’un atome de nombre de masse A :
- mp
≈ mn = m nucléon
|
m Atome ≈
A .
m
H
m Atome ≈
A .
m
nucléon |
- On représente les atomes par des sphères.
- Le diamètre d’un atome est de l’ordre de 10–10 m.
- L’atome appartient au domaine de l’infiniment petit.
|
Le plus petit des atomes |
Atome d’Hydrogène |
r H
≈ 52,9 pm |
|
L’un des plus gros |
Atome de Césium |
r Cs
≈ 265
pm |
- Le rayon des atomes est de l’ordre de 100 pm.
- Le rayon de l’atome est 100 000 fois plus gros que celui du noyau.
- Entre les électrons et le noyau, il n’y a que le vide.
- L’atome a une structure lacunaire.
- Des atomes sont isotopes si leurs noyaux possèdent le même nombre de protons mais des nombres différents de neutrons.
- Exemple : On considère les nucléides (Z, A) suivants : (6,12), (6,13), (6,14).
- On remarque que Z = 6.
- Cette valeur de Z caractérise l’élément carbone de symbole C.
|
|
|
|
Atomes isotopes |
|
98,9 % |
1,1 % |
Traces |
Composition d’un morceau de graphite |
- pour les nommer, on ajoute à leur nom le nombre de nucléons de leur noyau : on parle de carbone 12, de carbone 13 et de carbone 14.
- Un ion provient d’un atome ou d’un groupement d’atomes ayant gagné ou perdu un ou plusieurs électrons.
- Un anion (ion chargé moins) résulte de la capture d’un ou plusieurs électrons.
- Un cation (ion chargé plus) résulte de la perte d’un ou plusieurs électrons.
- Exemples d’ions monoatomiques :
- Un ion monoatomique provient d’un atome ayant gagné ou perdu un ou plusieurs électrons.
- Un anion est un ion qui a une charge négative.
- Un cation est un ion qui porte une charge positive.
- Cl – : L’ion chlorure provient d’un atome de chlore ayant gagné 1 électron.
- On peut dans ce cas écrire : Cl + e– → Cl–
- Na+ : L’ion sodium provient d’un atome de sodium ayant perdu 1 électron.
- On peut donc écrire dans ce cas : Na → Na+ + e–
- Lors du passage d’un atome à un ion monoatomique, seul le nombre d’électrons change, le noyau lui n’est pas affecté.
- Exemples :
|
|
Formule
de l’ion |
Charge
de l’ion |
Symbole
du noyau |
Nombre
de protons |
Nombre
de neutrons |
Nombre
d’électrons |
|
Ion chlorure |
Cl– |
-
e |
|
17 |
18 |
18 |
|
Ion cuivre II |
Cu2+ |
+ 2 e |
|
29 |
34 |
27 |
a)-
Conservation de l’élément cuivre :
TP Chimie N° 05 Notion expérimentale d’élément chimique.
- Exemple de l’élément cuivre :
-
L’élément cuivre représente ce qui est commun au
cuivre métal et à tous ses composés.
- Le cuivre métal, l’ion cuivre II, l’oxyde de
cuivre II, l’hydroxyde de cuivre II contiennent l'élément cuivre.
- Le numéro atomique.
- Le numéro atomique Z
caractérise un
élément chimique.
- Tous les représentants (atomes ou ions) d’un
élément ont un noyau comportant Z protons.
- Tous les atomes d’un même élément ont le même
cortège électronique et des propriétés chimiques identiques.
- Conservation de l’élément chimique.
- Au cours des réactions chimiques, les noyaux
n’étant pas modifiés, les différents éléments se conservent.
- Les éléments présents avant la transformation
sont présents après la réaction.
b)-
Conservation de l’élément fer.
► Formation des ions fer II :
Fe2+ (aq)
- Des ions fer II, Fe2+ (aq), se forment lorsque l’on verse une solution d’acide chlorhydrique (H+ (aq) + Cl– (aq)) dans un tube à essais contenant du fer en poudre.
- On observe aussi un dégagement gazeux de
dihydrogène.
|
2
(H+ (aq) +
Cl– (aq))
+ Fe (s) →
H2
(g) + Fe2+(aq)
+
2 Cl– (aq) |
|
|
- Le gaz obtenu provoque une légère détonation en
présence d’une flamme.
► Formation de l’hydroxyde de fer II :
Fe(OH)2
(s)
- Les ions fer II, Fe2+ (aq), réagissent avec les ions hydroxyde, HO– (aq), d’une solution aqueuse d’hydroxyde de sodium (soude : {Na+ (aq) + HO– (aq)}).
- On obtient un précipité vert pâle
d’hydroxyde de fer II :
Fe(OH)2
(s).
|
|
|
Fe2+
(aq) + 2 HO–
(aq) →
Fe(OH)2
(s) |
► Oxydation de l’hydroxyde de fer
II :
Fe(OH)2
(s)
- Au contact de l’oxygène
de l’air, l’hydroxyde de fer II (précipité vert pâle)
se transforme spontanément en hydroxyde de fer
III (précipité rouille).
|
4
Fe(OH)2
(s) + 2 H2O
(ℓ)+ O2 (g) →
4 Fe(OH)3
(s)
|
- Après déshydratation, l’hydroxyde de fer
III, donne de l’oxyde de fer III
(solide de couleur
rouille).
|
2 Fe(OH)3
(s) →
Fe2O3
(s) + 3H2O
(g)
|
► Cycle du fer :
c)- Conclusion.
- Un élément chimique est ce qui est commun à un corps simple et à tous ses composés.
- Il est défini par son nombre de charge
Z.
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 2 : Déterminer un numéro atomique :
b)- Exercice 7 : Déterminer la formule d’un ion :
c)- Exercice 8 Déterminer la charge d’un ion :
d)- Exercice 10 Identifier des noyaux isotopes :
e)- Exercice 11 : Chercher la composition d’un noyau ou d’un ion.
f)- Exercice 15 : Composition chimique du Soleil de la Terre et du corps humain.
g)- Exercice 16 : établir une notation symbolique :
|
|