|
Chim. N° 02 |
Changement de couleur et réaction chimique. Cours. |
|
|
Mots clés : Système chimique, avancement, réaction chimique, tableau d'avancement, avancement maximal, mélange stœchiométrique, absorbance, spectre d'absorption, absorbance en fonction de la longueur d'onde, absorbance en fonction de la concentration, Loi de Beer-Lambert, courbe d'étalonnage, ... |
|
|
Exercices : énoncé avec correctiona)- Exercice 6 page 90. Compléter un tableau d’avancement.b)- Exercice 7 page 90. Utiliser un tableau d’avancement.c)- Exercice 9 page 90. Établir l’état final d’un système (I)d)- Exercice 11 page 91. Analyser des graphes.e)- Exercice 14 page 91. Tracer une courbe d’étalonnage.f)- Exercice 16 page 92. Réaction entre l’acide oxalique et les ions permanganate.g)- Exercice 18 page 92-93. Étude d’une solution colorée de bain de bouche. |
I- Évolution d’un système
chimique.
1)- Rappel : cours de seconde :
Chimie N° 08
la réaction chimique.
- La transformation chimique qui fait intervenir les réactifs et les produits s’appelle la réaction chimique.
- Elle modélise la transformation chimique subie par un système chimique.
► Lois de conservation :
- Conservation des éléments chimiques :
- Au cours d’une réaction chimique, il y a conservation des éléments chimiques.
- Les éléments présents dans les réactifs se retrouvent dans les produits.
- Conservation de la charge : au cours d’une réaction chimique, la charge se conserve.
- Conservation de la masse : (Lavoisier) :
- Le chimiste français Lavoisier a montré que la masse des réactifs qui disparaissent est égale à la masse des produits qui apparaissent.
► Équation chimique :
- L’équation chimique est l’écriture symbolique d’une réaction chimique.
- Par convention :
- On écrit les formules des réactifs dans le membre gauche de l’équation chimique
- On écrit les formules des produits dans le membre droit de l’équation chimique.
-
On sépare les deux membres de
l’équation par une flèche.
|
Réactifs |
Transformation
chimique |
Produits |
|
( … ) + ( … ) |
→ |
( … ) + ( … ) |
► Ajustement des nombres stœchiométriques.
- Ajuster les nombres stœchiométriques d’une équation :
- C’est choisir ces nombres de manière à traduire la conservation de tous les éléments mis en œuvre et la conservation de la charge globale.
- Par convention, le nombre stœchiométrique se place devant la formule de l’espèce chimique.
- Le nombre stœchiométrique 1 ne s’écrit pas
► Applications 1 : Ajustement des nombres stœchiométriques :
- Le butane brûle dans le dioxygène pour donner du dioxyde de carbone et de l’eau
- Tableau :
|
|
Réactifs |
|
Produits |
|
Équation
chimique |
2 C4H10 (g) + 13 O2 (g) |
→ |
8 CO2 (g) + 10 H2O (ℓ) |
|
Éléments chimiques
présents |
Carbone C, hydrogène H, et oxygène O. |
||
|
Nombre de
« carbone » |
2
x 4 = 8 |
|
8 x 1 = 8 |
|
Nombre
d’ « hydrogène » |
2 x 10 = 20 |
|
10 x 2 = 20 |
|
Nombre
d’ « oxygène » |
13 x 2 = 26 |
|
8 x 2 + 10 x 1 = 26 |
► Applications 2 : Ajustement des nombres stœchiométriques :
- Le diiode en solution aqueuse, que l’on note I2 (aq), réagit avec les ions thiosulfate S2O32– (aq) pour donner des ions iodure I– (aq) et des ions tétrathionate S4O62– (aq).
|
|
Réactifs |
|
Produits |
|
Équation
chimique |
I2 (aq) + 2 S2O32– (aq) |
→ |
2 I– (aq) + S4O62– (aq) |
|
Éléments chimiques
présents |
Carbone C, hydrogène H, et oxygène O. |
||
|
Nombre
d’« iode » |
1
x 2 = 2 |
|
2 x 1 = 2 |
|
Nombre
de « soufre » |
2 x 2 = 4 |
|
1 x 4 = 4 |
|
Nombre
d’ « oxygène » |
2 x 3 = 6 |
|
1 x 6 = 6 |
|
Nombre de
« charges » |
0 + 2
x (-2) = (-4) |
|
2
x (-1) + 1
x (-2) = (-4) |
2)- Avancement d’une
réaction.
- L’avancement x d’une transformation chimique est une grandeur exprimée en mole qui permet de décrire l’état du système au cours de la transformation.
- Il permet d’exprimer les quantités de matière de réactifs et de produits présents dans le système chimique à chaque instant.
- L’avancement x est une quantité de matière. Elle s’exprime en mol.
- Dans l’état initial, x = 0,
- au cours de la transformation, 0 ≤ x ≤ xmax
- À l’état final : x = xmax (au niveau de la classe de première S, les réactions étudiées sont totales)
- En conséquence, l’avancement x ≥ 0.
3)- Tableau d’avancement de la réaction :
a)- Rôle du tableau d’avancement :
- Il décrit l’évolution des quantités de matière du système de l’état initial à l’état final en fonction de l’avancement x.
- Les nombres placés devant l’avancement x sont égaux aux nombres stœchiométriques de l’équation chimique.
- On n’écrit pas le nombre stœchiométrique 1.
- Le tableau permet de calculer la valeur de l’avancement maximal xmax et de déterminer l’état final du mélange réactionnel.
- Il est très pratique pour l’étude des réactions chimiques.
b)- Étude : Exploitation de l’expérience 1 :
![]() Expérience 1 :
Expérience 1 :
- On verse un volume V2 = 40 mL d’une solution aqueuse de thiosulfate de sodium {2 Na+ (aq) + S2O32– (aq)}
de concentration C2 = 1,0 x 10 – 2 mol / L dans un bécher.
- Cette solution est incolore.
- on ajoute lentement, tout en agitant, un volume V1 = 10 mL d’une solution aqueuse de diiode I2 (aq)
de couleur jaune-orangé, de concentration C1 = 1,0 x 10– 2 mol / L, à l’aide d’une burette graduée.
- Schéma :

► Observations :
- Au fur et à mesure, de l’ajout de la solution, on observe la décoloration de la solution aqueuse de diiode.
- Lorsque toute la solution de diiode a été versée, la solution finale est incolore.
- Au cours de la réaction, il se forme des ions iodure I– (aq) et des ions tétrathionate S4O62– (aq) qui sont incolores.
- Les ions sodium Na+ (aq), qui sont incolores, ne participent pas à la réaction, ce sont des ions spectateurs.
![]() Remarque :
Remarque :
- La décoloration de la solution indique la disparition du diiode au cours de la réaction
- En fin de réaction, tout le diiode a disparu puisque le mélange réactionnel est incolore.
► Tableau d’avancement :
- Première étape : on calcule les quantités de matière de chaque réactif ;
|
Expérience 1 : |
Solution de diiode |
Solution de thiosulfate de sodium |
|
Volume |
V1 = 10 mL |
V2 = 40 mL |
|
Concentration |
C1 = 1,0 x 10– 2 mol / L |
C2 = 1,0 x 10– 2 mol / L |
|
Quantité de matière |
n1 = C1 x V1 n1 ≈ 1,0 x 10– 4 mol n1 ≈ 0,10 mmol |
n2 = C2 x V2 n2 ≈ 4,0 x 10– 4 mol n2 ≈ 0,40 mmol |
|
Équation |
I2 (aq) |
+ 2 S2O32– (aq) |
→ |
2 I– (aq) |
+ S4O62– (aq) |
|
|
État du
système |
Avancement |
n (I2)
|
|
|
|
|
|
État initial
(mmol) |
x = 0 |
n1 = 0,10 |
n2 = 0,40 |
0 |
0 |
|
|
Au cours
de
la
transformation |
x |
0,10
– x |
0,40
– 2
x |
2
x |
x |
|
|
État final
(mmol) |
x = xmax |
0,10
– xmax |
0,40
– 2
xmax |
|
2
xmax |
xmax |
- On remarque que l’avancement x est égal à la quantité de matière de diiode consommée.
- On peut écrire : n (I2) = n1 - x
- Au début de la réaction, l’avancement x = 0, puis l’avancement x augmente au cours de la réaction pour atteindre la valeur xmax lorsque la réaction est terminée.
- Du point de vue expérimental, on sait que, en fin de réaction, tout le diiode a disparu.
- Le but est de trouver la valeur de xmax.
- La connaissance de la valeur de xmax permet de compléter le tableau et de trouver l’état final du système.
- Comment peut-on déterminer la valeur maximale de x : Détermination de xmax ?
- Comme, on est en présence de deux réactifs, on peut émettre deux hypothèses.
- Hypothèse 1 : on considère que le réactif est le diiode I2 (aq) :
- 0,10 – xmax1 = 0 => xmax1 = 0,10 mmol
- Hypothèse 2 : on considère que le réactif est l’ion thiosulfate S2O32– (aq) :
- 0,40 – 2 xmax2 = 0 => xmax2 = 0,20 mmol
- L’avancement maximal est égal à la plus petite des deux valeurs :
- Car on ne peut pas consommer plus de réactif qu’il n’y en a au départ
- (On ne peut pas consommer 0,20 mmol de diiode car au départ, on en a 0,10 mmol)
- xmax = xmax1 = 0,10 mmol ≤ xmax2
- En conséquence :
- Le réactif limitant est le diiode I2 (aq), il a été totalement consommé.
- Ceci est en accord avec les observations expérimentales.
- Le réactif en excès est l’ion thiosulfate S2O32– (aq), il n’a pas totalement réagi.
- Il reste des ions thiosulfate en fin de réaction.
- On peut maintenant compléter le tableau d’avancement de la réaction.
|
Équation |
I2 (aq) |
+ 2 S2O32– (aq) |
→ |
2 I– (aq) |
+ S4O62– (aq) |
|
|
État du
système |
Avancement |
|||||
|
État initial
(mmol) |
x = 0 |
n1 = 0,10 |
n2 = 0,40 |
0 |
0 |
|
|
Au cours de
la
transformation |
x |
0,10
– x |
0,40
– 2
x |
2
x |
x |
|
|
État final
(mmol) |
x = xmax
= |
0,10
– xmax |
0,40
– 2
xmax |
|
2
xmax |
xmax |
|
0,10
|
0 |
0,20 |
|
0,20 |
0,10 |
|
- On connait ainsi l’état final du système et le bilan de matière.
c)- Réactif limitant et avancement maximal.
- Avancement maximal :
- Pour déterminer la valeur de l’avancement maximal xmax,
- On calcule les valeurs de l’avancement qui annulent les quantités de chacun des réactifs.
- La plus petite de ces valeurs donne la valeur de l’avancement maximal de la réaction.
- Réactif limitant :
- Le réactif limitant est le réactif qui est associé à la plus petite des valeurs.
- Il est totalement consommé au cours de la réaction.
- Sa quantité de matière s’annule en fin de réaction.
4)- Autre méthode de détermination de l’avancement maximal xmax.
-
On peut
déterminer xmax
en traçant les droites représentant les variations des quantités
de matière des réactifs en fonction de l’avancement
x de
la réaction.
-
Dans le
cas précédent :
|
n
(I2)
= 0,10
– x
|
|
|
|
n (S2 O32–) = 0,40 – 2 x |
-
Les
deux droites coupent l’axe horizontal et
xmax
est égal à la plus petite abscisse des deux points
d’intersection avec l’axe horizontal.
-
Graphe : On
peut montrer l’évolution du système grâce à un tableur : ici
Excel.
- On peut observer, qu’au cours de la réaction, les réactifs disparaissent et les produits se forment.
Vidéo
Réaction chimique entre le diiode en solution aqueuse
et une solution aqueuse de thiosulfate de sodium.
Le diiode est le réactif limitant.
5)- Cas particulier : Le mélange stœchiométrique.
- Dans certains cas, à la fin de la réaction, tous les réactifs ont été entièrement consommés.
- On dit que dans l’état initial, les réactifs ont été introduits dans les proportions stœchiométriques : le mélange est stœchiométrique.
► Application 3 :
- On verse un volume V2 = 40 mL d’une solution aqueuse de thiosulfate de sodium {2 Na+ (aq) + S2O32– (aq)}
- de concentration C2 = 1,0 x 10 – 2 mol / L dans un bécher.
- Cette solution est incolore.
- on verse, tout en agitant, un volume V1 d’une solution aqueuse de diiode I2 (aq) de couleur jaune-orangé, de concentration
- C1 = 1,0 x 10– 2 mol / L.
- Déterminer la valeur du volume V1 de solution de diiode I2 (aq) qu’il faut verser pour obtenir un mélange stœchiométrique.
- Quelle est la couleur prise par le mélange réactionnel.
► Résolution
- Quantités de matière initiales :
|
Expérience : |
Solution de diiode |
Solution de thiosulfate de sodium |
|
Volume |
V1 = ? mL |
V2 = 40 mL |
|
Concentration |
C1 = 1,0 x 10– 2 mol / L |
C2 = 1,0 x 10– 2 mol / L |
|
Quantité de matière |
n1 = C1 x V1 |
n2 = C2 x V2 n2 ≈ 4,0 x 10 – 4 mol n2 ≈ 0,40 mmol |
- Tableau d’avancement :
|
Équation |
I2 (aq) |
+ 2 S2O32– (aq) |
→ |
2 I– (aq) |
+ S4O62– (aq) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mmol) |
x = 0 |
n1 = ? |
n2 = 0,40 |
0 |
0 |
|
|
Au cours de
la
transformation |
x |
n1-
x |
0,40
– 2
x |
2
x |
x |
|
|
État final
(mmol) |
x = xmax |
n1–
xmax = 0 |
0,40
– 2
xmax
= 0 |
|
2
xmax |
xmax |
|
|
|
|
|
|
|
|
- Comme tous les réactifs ont été totalement consommés, on peut écrire :
- 0,40 – 2 xmax = 0 et n1– xmax = 0
- On en déduit la valeur de xmax = 0,20 mmol et la valeur de n1= xmax = 0 ,20 mmol
- Volume de solution de diiode :
-
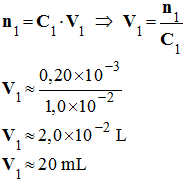
- On peut ainsi compléter le tableau d’avancement :
|
Équation |
I2 (aq) |
+ 2 S2O32– (aq) |
→ |
2 I– (aq) |
+ S4O62– (aq) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mmol) |
x = 0 |
n1 = 0,20 |
n2 = 0,40 |
0 |
0 |
|
|
Au cours de
la
transformation |
x |
0,20
–
x |
0,40
– 2
x |
2
x |
x |
|
|
État final
(mmol) |
x = xmax |
n1–
xmax = 0 |
0,40
– 2
xmax
= 0 |
|
2
xmax |
xmax |
|
xmax
= 0,20 |
0 |
0 |
|
0,40 |
0,20 |
|
- Couleur de la solution : la solution est incolore car tout le diiode a réagi.
- Résolution graphique :

Vidéo
et une solution aqueuse de thiosulfate de sodium.
Cas d’un mélange stœchiométrique.
6)- Application : étude de l’expérience 2 :
![]() Expérience 2 :
Expérience 2 :
- On verse un volume V2 = 40 mL d’une solution aqueuse de thiosulfate de sodium {2 Na+ (aq) + S2O32– (aq)} de concentration :
- C2 = 1,0 x 10– 2 mol / L dans un bécher.
- Cette solution est incolore.
- on ajoute lentement, tout en agitant, un volume V1 = 25 mL d’une solution aqueuse de diiode I2 (aq)
de couleur jaune-orangé, de concentration : C1 = 1,0 x 10– 2 mol / L, à l’aide d’une burette graduée.
► Observations et compléments:
- Au fur et à mesure, de l’ajout de la solution, on observe la décoloration de la solution aqueuse de diiode.
- Au cours de la réaction, il se forme des ions iodure I– (aq) et des ions tétrathionate S4O62– (aq) qui sont incolores.
- Les ions sodium Na+ (aq), qui sont incolore, ne participent pas à la réaction, ce sont des ions spectateurs.
- Lorsque toute la solution de diiode a été versée, la solution finale est colorée en jaune-orangé (elle est plus claire que la solution initiale de diiode).
![]() Remarque :
Remarque :
- La décoloration de la solution indique la disparition du diiode au cours de la réaction
-
En fin de réaction, tout le
diiode n’a pas disparu car la solution finale est colorée en
jaune-orangé.
-
Cette coloration est due à la
présence de diiode qui n’a pas réagi (le diiode est la seule
espèce colorée présente dans le mélange réactionnel).
► Calculer l’avancement maximal de la réaction.
► Indiquer quel est le réactif limitant et donner l’état final du mélange réactionnel
- Première étape : On calcule les quantités de matière de chaque réactif ;
|
Expérience 1 : |
Solution de diiode |
Solution de thiosulfate de sodium |
|
Volume |
V1 = 25 mL |
V2 = 40 mL |
|
Concentration |
C1 = 1,0 x 10– 2 mol / L |
C2 = 1,0 x 10– 2 mol / L |
|
Quantité de matière |
n1 = C1 x V1 n1 ≈ 2,5 x 10– 4 mol n1 ≈ 0,25 mmol |
n2 = C2 x V2 n2 ≈ 4,0 x 10– 4 mol n2 ≈ 0,40 mmol |
|
Équation |
I2 (aq) |
+ 2 S2O32– (aq) |
→ |
2 I– (aq) |
+ S4O62– (aq) |
|
|
État du
système |
Avancement |
n (I2)
|
|
|
|
|
|
État initial
(mmol) |
x = 0 |
n1 = 0,25 |
n2 = 0,40 |
0 |
0 |
|
|
Au cours de
la
transformation |
x |
0,25
– x |
0,40
– 2
x |
2
x |
x |
|
|
État final
(mmol) |
x = xmax |
0,25
– xmax |
0,40
– 2
xmax |
|
2
xmax |
xmax |
- Détermination de xmax :
- Comme, on est en présence de deux réactifs, on peut émettre deux hypothèses.
- Hypothèse 1 : on considère que le réactif est le diiode I2 (aq) :
- 0,25 – xmax1 = 0 => xmax1 ≈ 0,25 mmol
- Hypothèse 2 : on considère que le réactif est l’ion thiosulfate S2O32– (aq) :
- 0,40 – 2 xmax2 = 0 => xmax2 ≈ 0,20 mmol
- L’avancement maximal est égal à la plus petite des deux valeurs :
- xmax = xmax1 = 0,20 mmol ≤ xmax2
- En conséquence :
- Le réactif en excès est le diiode I2 (aq), il n’a pas totalement réagi.
- Ceci est en accord avec les observations expérimentales, en fin de réaction, la solution obtenue est colorée en jaune-orangé.
- Le réactif limitant est l’ion thiosulfate S2O32– (aq), il a été totalement consommé.
- On peut maintenant compléter le tableau d’avancement de la réaction.
|
Équation |
I2 (aq) |
+ 2 S2O32– (aq) |
→ |
2 I– (aq) |
+ S4O62– (aq) |
|
|
État du
système |
Avancement |
|
|
|
|
|
|
État initial
(mmol) |
x = 0 |
n1 = 0,10 |
n2 = 0,40 |
0 |
0 |
|
|
Au cours de
la
transformation |
x |
0,25
- x |
0,40
– 2
x |
2
x |
x |
|
|
État final
(mmol) |
x = xmax
= |
0,25
– xmax |
0,40
– 2
xmax |
|
2
xmax |
xmax |
|
0,20
|
0,050 |
0,0 |
|
0,40 |
0,20 |
|
- On connait ainsi l’état final du système et le bilan de matière.
- Exploitation graphique :
Vidéo
et une solution aqueuse de thiosulfate de sodium.
Le diiode est le réactif en excès.
II- Détermination de la concentration d’une espèce colorée.
1)- Absorbance d’une solution.
a)- Expérience 1 : Cas de la solution aqueuse de permanganate de potassium
![]() Expérience :
Expérience :
- Observation :
- La solution de permanganate de potassium est violette lorsqu’on observe à la lumière du jour.
- L’analyse de la lumière transmise par la solution de permanganate de potassium révèle la présence d’une bande sombre dans le spectre de la lumière blanche.
- Une partie du vert et du bleu a été absorbée par la solution.
- On obtient un spectre de bandes d’absorption. Les radiations absorbées dépendent de la nature du milieu.
- Un spectre de bande est caractéristique de la substance dissoute.

- Profil spectral :
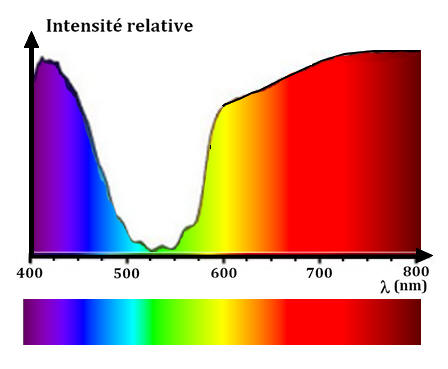
- Profil spectral de la solution aqueuse de permanganate de potassium.
![]() La couleur d’une solution résulte
de la superposition des radiations qui n’ont pas été absorbées.
La couleur d’une solution résulte
de la superposition des radiations qui n’ont pas été absorbées.
b)- L’absorbance :
Pour aller plus loin :
-
Absorbance de la solution en fonction de la longueur d’onde.
-
On utilise le fait que toute
solution colorée absorbe la lumière visible (400 nm <
λ0
< 800 nm).
-
Lorsqu’un faisceau de lumière
monochromatique traverse un milieu absorbant, l’intensité
lumineuse
I
du faisceau transmis est inférieure à l’intensité
lumineuse
I 0 du faisceau incident.
- Pour évaluer cette diminution, on utilise :
-
L’absorbance
A :
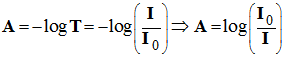
Cours de chimie de terminale S : Chim N° 02 Suivi temporel d’une transformation chimique
et TP chimie N° 02 Suivi temporel d’une transformation par une méthode physique.
- La proportion de lumière absorbée par une solution colorée, à une longueur d’onde λ donnée, représente son absorbance notée A.
- C’est une grandeur qui n’a pas d’unité.
- C’est une grandeur additive : l’absorbance d’une solution est la somme des absorbances de toutes les espèces présentes dans la solution.
c)- Mesure de l’absorbance.
-
On utilise le fait que
toute solution colorée absorbe la lumière visible (400 nm <
λ0
< 800 nm).
-
Lorsqu’un faisceau de
lumière monochromatique traverse un milieu absorbant,
l’intensité lumineuse I
du faisceau transmis est
inférieure à l’intensité lumineuse I0 du
faisceau incident.
-
Pour mesurer
l’absorbance, on utilise un spectrophotomètre.
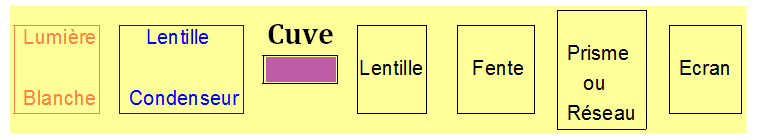
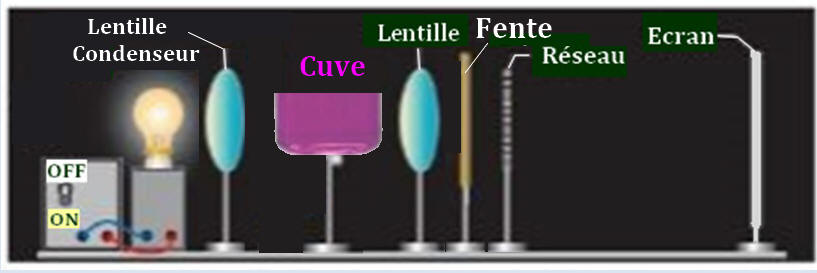
- Un système dispersif (prisme ou réseau) permet de sélectionner une radiation lumineuse de longueur d’onde donnée.
- Cette radiation est dirigée vers l’échantillon à analyser.
- Le flux lumineux transmis est mesuré et converti en valeur d’absorbance.
- L’appareil affiche la valeur de l’absorbance qui est un nombre sans unité compris entre 0 et 2.
2)- Spectre d’absorption d’une solution aqueuse : Absorbance en fonction de la longueur d’onde
a)- Mode opératoire :
-
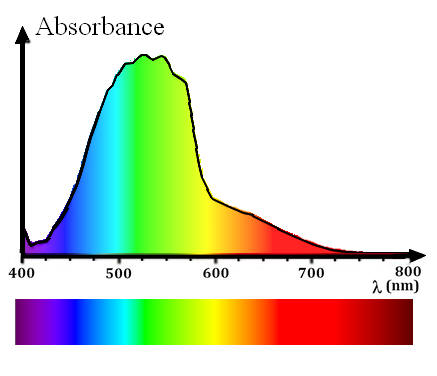
L’absorbance d’une
solution colorée dépend de la longueur d’onde de la radiation
lumineuse utilisée.
-
On donne l’absorbance
d’une solution de diiode en fonction de la longueur d’onde :
-
Pour une solution de
diiode de concentration C =
1,0
mmol / L, on
mesure l’absorbance A pour différentes longueurs d’ondes.
-
La plage de variation
de la longueur d’onde se situe dans l’intervalle suivant :
-
400 nm <
λ < 700
nm.
-
On règle la longueur
d’onde sur la valeur souhaitée, on fait le blanc avec la
solution étalon, puis on mesure l’absorbance.
-
Il faut répéter le mode
opératoire pour chaque mesure.
b)- Courbe obtenue :
|
Absorbance d’une solution de diiode en fonction de la longueur d’onde : Solution de diiode de concentration
C =
1,0
mmol / L La solution absorbe principalement dans le bleu et un peu dans le vert. La couleur complémentaire du bleu est le jaune. |
|
|
-
L’étude du spectre
permet de déterminer la longueur d’onde
λmax
pour laquelle l’absorbance est maximale.
- Dans le cas de la solution aqueuse de diiode, λmax ≈ 475 nm.
3)- Absorbance en fonction de la concentration.
a)- Réglage du spectrophotomètre.
-
Pour réaliser les mesures
d’absorbance, le spectrophotomètre est généralement réglé sur la
longueur d’onde
λmax
correspondant au maximum d’absorption du spectre de la solution
étudiée.
- À cette longueur d’onde, la valeur de l’absorbance étant la plus grande, l’incertitude sur la mesure est la plus petite.
- Pour les solutions aqueuses de diiode, on choisit λ = 450 nm, pour avoir le maximum de variations pour la valeur de A.
- On n’a pas choisi λ = 475 nm car le spectrophotomètre sature en fin d’expérience lorsque la concentration en diiode devient trop grande.
b)- Préparation des solutions et mesures :
-
On dispose d’une
solution S0 de concentration en diiode
C0
= 1,0 mmol / L.
-
À partir de
S0,
préparer les solutions 10 mL de solution
S en utilisant
les solutions présentes dans les burettes.
- Matériel :
-
Préparer la solution
S et réaliser la mesure de l’absorbance de la solution
préparée.
|
Groupes |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Solution S mmol / L |
0,10 |
0,20 |
0,30 |
0,40 |
0,50 |
0,60 |
0,70 |
0,80 |
0,90 |
1 |
|
Absorbance A g1 |
0.120 |
0.256 |
0.435 |
0.578 |
0.723 |
0.818 |
0.997 |
1.149 |
1.281 |
1.404 |
|
Absorbance A g2 |
0.096 |
0.228 |
0.361 |
0.508 |
0.628 |
0.723 |
0.878 |
1.053 |
1.109 |
1.261 |
-
Pour préparer la
solution S, on mélange la solution de diiode de
concentration C0 = 1,0 mmol / L et la solution
d’iodure de potassium de concentration
C = 0,20 mol / L.
- Pour préparer la solution 1, on mélange à l’aide des burettes graduées, 1 mL de solution de diiode de concentration
C0 =
1,0 mmol / L et 9 mL de solution d’iodure de potassium de
concentration C = 0,20 mol / L.
- Pour préparer la solution 2, on mélange à l’aide des burettes graduées, 2 mL de solution de diiode de concentration
C0 =
1,0 mmol / L et 8 mL de solution d’iodure de potassium de
concentration C = 0,20 mol / L.
-
Ainsi de suite….
c)- Exploitation des mesures.
- On trace la courbe A = f (C).
- Courbe obtenu par le Groupe 1 :
- Courbe obtenue par le Groupe 2 :
- On obtient la courbe d’étalonnage.
- Ce graphe est une portion de droite passant par l’origine.
- L’absorbance A est proportionnelle à la concentration C de la solution de diiode.
- A = k . [I2].
- On peut généraliser ce résultat à toutes les solutions colorées.
-
Pour les solutions suffisamment
diluées, l’absorbance est proportionnelle à la concentration de
l’espèce colorée.
► Définition :
|
Définition : - L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle à la concentration (effective) C de cette espèce
et à l’épaisseur ℓ (cm)
de la solution traversée
par le faisceau lumineux.
-
A
(λ) =
ε (λ).ℓ.C -
ε
(λ) est appelé coefficient d’extinction molaire ou
coefficient d’absorption molaire.
-
Il
dépend de la nature de l’espèce dissoute et de la longueur
d’onde de la radiation utilisée.
-
Il
dépend également du solvant et de la température.
|
- Unité :
|
Unité |
|
|
A |
sans unité |
|
ℓ |
cm |
|
ε (λ) |
mol – 1. L . cm – 1 |
-
A sans unité ;
ℓ
en cm et
ε
(λ)
en
mol – 1.L.cm
– 1.
- La courbe A = f (C) constitue la courbe d’étalonnage de la substance étudiée.
- Elle permet de déterminer la concentration d’une solution de la substance étudiée.
-
Elle permet donc de doser une
espèce chimique colorée.
- Afin d’augmenter la sensibilité de la méthode, on utilise la longueur d’onde qui correspond au maximum d’absorption de la substance étudiée.
-
Cette méthode est alors beaucoup plus précise que la méthode
colorimétrique utilisant une échelle des teintes.
1)- QCM : pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
Exercices : énoncé avec correction a)- Exercice 6 page 90. Compléter un tableau d’avancement. b)- Exercice 7 page 90. Utiliser un tableau d’avancement. c)- Exercice 9 page 90. Établir l’état final d’un système (I) d)- Exercice 11 page 91. Analyser des graphes. e)- Exercice 14 page 91. Tracer une courbe d’étalonnage. f)- Exercice 16 page 92. Réaction entre l’acide oxalique et les ions permanganate. g)- Exercice 18 page 92-93. Étude d’une solution colorée de bain de bouche. |
|
|