|
QCM N° 05 a |
Changement de couleur et Réaction chimique |
|
|
|
|
QCM N° 05 a :
Changement de couleur et réaction
chimique
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’avancement x est une
grandeur qui : |
n’a pas
d’unité. |
s’exprime
en
mol. |
augmente au cours de
la réaction. |
BC |
|
2 |
À la fin d’une réaction
chimique : |
les réactifs sont toujours totalement
consommés. |
les réactifs sont totalement consommés si le mélange initial est
stœchiométrique. |
le réactif limitant est totalement
consommé. |
BC |
|
3 |
Dans un état final pour lequelles quantités des deux réactifs exprimés
en mol, sont :
Réactifs 1 :
6,0 – 3 xmax
Réactifs 2 :
8,0 – 2 xmax |
xmax
= 4,0 mol |
le réactif 1
est limitant. |
le réactif 2
est limitant. |
B |
|
4 |
On mélange 10,0 mol d’aluminium Al et
10,0 mol de dioxygène
O2.
L’équation de
la réaction est : 4 Al (s) + 3 O2 (g)
→ 2 Al2O3 (s)
Dans l’état
final. |
il reste 2,5 mol
de O2. |
2,5 mol de Al ont été
consommés. |
il s’est formé 5,0 mol
de
Al2O3. |
AC |
|
5 |
Après un mélange stœchiométrique
de réactifs : |
les réactifs sont entièrement
consommés. |
l’état final ne contient que des
produits. |
il s’est formé la même quantité de chacun
des produits. |
AB |
|
6 |
Pour la réaction suivante :
2
Al (s) + 6
H+
(aq) Le mélange initial des réactifs est stœchiométrique
si : |
AC |
|||
|
7 |
Un spectrophotomètre
affiche : |
l’absorbance
d’une solution. |
la concentration
d’une solution. |
la couleur
d’une solution. |
A |
|
8 |
Soit C la concentration molaire d’une espèce colorée, λ la longueur d’onde
utilisée
et
k une
constante. La loi de Beer-Lambert
s’écrit : |
A
= k .
λ |
A
= k .
C |
A
= λ .
C |
B |
|
9 |
À partir du graphe ci-dessous, la loi de
Beer-Lambert s’écrit : |
A
= 1,0 C |
A
= 0,10 C |
A
= 10 C |
C |
|
10 |
L’absorbance d’une
solution
colorée est : |
toujours proportionnelle à la concentration C de l’espèce
colorée. |
proportionnelle à la concentration C de l’espèce colorée pour les solutions suffisamment
diluées |
proportionnelle à la longueur d’onde λ de la radiation
utilisée |
|
►
Avancement d’une réaction
chimique :
-
L’avancement
x d’une
transformation chimique est une grandeur exprimée en mole qui
permet de décrire l’état du système au cours de la
transformation.
-
Il permet d’exprimer les
quantités de matière de réactifs et de produits présents dans le
système chimique à chaque instant.
-
L’avancement
x est une
quantité de matière. Elle s’exprime en mol.
-
Dans l’état initial,
x = 0,
-
au cours de la
transformation, la valeur de l’avancement de la réaction
augmente : 0
≤ x
≤ xmax
-
À l’état final :
x =
xmax (au niveau de la classe de première S,
les réactions étudiées sont totales)
-
En conséquence, l’avancement
x
≥ 0.
►
Mélange stœchiométrique :
-
Dans certains cas, à la fin de la
réaction, tous les réactifs ont été entièrement consommés.
- On dit que dans l’état initial, les réactifs ont été introduits dans les proportions stœchiométriques :
- Le mélange est stœchiométrique.
- Mélange stœchiométrique :
- Dans
l’état initial, les réactifs ont été introduits dans les
proportions définies par les coefficients de la réaction.
►
Avancement maximal : xmax
-
Le but est de trouver la valeur
de xmax.
-
La connaissance de la valeur de
xmax permet de compléter le tableau et de
trouver l’état final du système.
-
Comment peut-on déterminer la
valeur maximale de x : Détermination de
x
max
?
-
Comme, on est en présence de deux
réactifs, on peut émettre deux hypothèses.
-
Hypothèse 1 : on considère le
réactif 1 :
-
6,0 – 3
xmax1 =
0
=> xmax1 = 2,0 mol
-
Hypothèse 2 : on considère le
réactif 2 :
-
8,0 – 2
xmax 2
= 0
=> xmax2
= 4,0 mol
-
L’avancement maximal est égal
à la plus petite des deux valeurs :
-
Car on ne peut pas consommer plus
de réactif qu’il n’y en a au départ
-
xmax =
xmax1
= 2,0 mol ≤ xmax2
-
En conséquence :
-
Le
réactif limitant est le
réactif 1, il a été totalement consommé.
-
Le
réactif en excès est le
réactif 2, il n’a pas totalement réagi.
►
Tableau d’avancement d’une
réaction :
-
Il décrit l’évolution des
quantités de matière du système de l’état initial à l’état final
en fonction de l’avancement x.
-
Les nombres placés devant
l’avancement x sont égaux aux nombres stœchiométriques de
l’équation chimique.
-
On n’écrit pas le nombre
stœchiométrique
1.
-
Le tableau permet de calculer la
valeur de l’avancement maximal xmax et de
déterminer l’état final du mélange réactionnel.
-
Il est très pratique pour l’étude
des réactions chimiques.
-
Exemple :
|
Équation |
4 Al (s)
|
+
3 O2
(g) |
→ |
2
Al2O3 (s) |
|
|
État du
système |
Avancement |
n
|
|
|
|
|
État initial
(mol) |
x = 0 |
n1
= 10 |
n2
= 10 |
0 |
|
|
Au cours
de
la
transformation |
x |
10
– 4 x |
10
– 3 x |
2 x |
|
|
État final
(mol) |
x = xmax
= ? |
10
– 4 xmax
= |
10
– 3 xmax
= |
|
2 xmax
= |
-
Le but est de trouver la valeur
de xmax.
-
La connaissance de la valeur de
xmax permet de compléter le tableau et de
trouver l’état final du système.
-
Comment peut-on déterminer la
valeur maximale de x : Détermination de
x
max
?
-
Comme, on est en présence de deux
réactifs, on peut émettre deux hypothèses.
-
Hypothèse 1 : on considère que le
réactif est l’aluminium Al (s) :
-
10 – 4 xmax1 =
0
=> xmax1 = 2,5 mol
-
Hypothèse 2 : on considère que le
réactif est le dioxygène O2 (g) :
-
10 – 3 xmax2 =
0
=> xmax2
≈ 3,3 mol
-
L’avancement maximal est égal
à la plus petite des deux valeurs :
-
Car on ne peut pas consommer plus
de réactif qu’il n’y en a au départ
-
xmax =
xmax1
= 2,5 mol ≤ xmax2
-
En conséquence :
-
Le
réactif limitant est
l’aluminium Al (s), il a été totalement consommé.
-
Le
réactif en excès est le
dioxygène O2 (g), il n’a pas totalement réagi.
|
Équation |
4 Al (s)
|
+
3 O2
(g) |
→ |
2
Al2O3 (s) |
|
|
État du
système |
Avancement |
n
|
|
|
|
|
État initial
(mol) |
x = 0 |
n1
= 10 |
n2
= 10 |
0 |
|
|
Au cours
de
la
transformation |
x |
10
– 4 x |
10
– 3 x |
2 x |
|
|
État final
(mol) |
x = xmax
= 2,5 mol |
10 – 4 xmax = 0,0 mol |
10 – 3 xmax = 2,5 mol |
|
2 xmax
= 5,0 mol |
►
Pour retrouver la relation :
-
Exemple :
2 Al (s) + 6
H+
(aq) → 2 Al3+ (aq) + 3
H2
(g)
|
Mélange stœchiométrique
|
2 Al (s)
|
+
6 H+
(aq) |
→ |
|
|
Quantité
de
matière |
n0
(Al) |
n0
(H+) |
|
|
|
Coefficients
stœchiométriques |
2 |
6 |
||
|
Relation
entre
les
quantités de matière
des réactifs |
ou
|
|||
►
Le spectrophotomètre :

-
Le spectrophotomètre mesure de
l’absorbance d’une solution par spectrophotométrie.
-
Un système dispersif (prisme ou
réseau) permet de sélectionner une radiation lumineuse de
longueur d’onde donnée.
-
Cette radiation est dirigée vers
l’échantillon à analyser.
-
Le flux lumineux transmis est
mesuré et converti en valeur d’absorbance.

►
Loi de Beer-Lambert.
-
Définition.
|
- L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle à la concentration (effective) C de cette espèce et à l’épaisseur ℓ
(cm) de la solution traversée par le faisceau lumineux. -
A (λ) = ε (λ).ℓ.C -
Cette relation n’est valable que
pour les solutions suffisamment diluées. -
ε (λ)
est appelé coefficient d’extinction molaire ou coefficient
d’absorption molaire. -
Il dépend de la nature de
l’espèce dissoute et de la longueur d’onde de la radiation
utilisée. -
Il dépend également du solvant et
de la température. (mol
– 1.L.cm
– 1). |
-
Courbe d’étalonnage d’un
spectrophotomètre.
-
La courbe
A =
f (C) constitue la courbe d’étalonnage de la
substance étudiée.
-
Elle permet de déterminer la
concentration d’une solution de la substance étudiée.
-
Afin d’augmenter la sensibilité
de la méthode, on utilise la longueur d’onde qui correspond au
maximum d’absorption de la substance étudiée.
-
Cette méthode est alors beaucoup
plus précise que la méthode colorimétrique utilisant une échelle
des teintes.
►
Exploitation du graphique de la
loi de Beer-Lambert
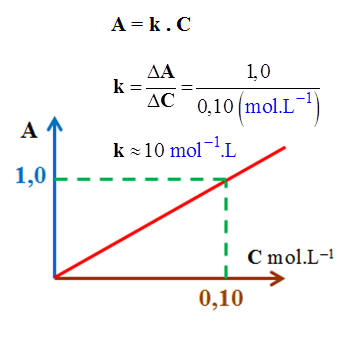
-
À l’aide de la courbe
A =
f (C), on peut déterminer la valeur de la
concentration C d’une solution diluée grâce à la mesure
de son absorbance.
- Exemple :
|
|




