|
Chim. N° 08 |
La Réaction chimique. Cours. |
|
|
Mots clés : Cours de chimie seconde La réaction chimique, transformation physique, transformation chimique, système chimique, état initial, état final, lois de conservation, écriture d'une équation chimique, nombres stœchiométriques, effets thermiques des trasformations physiques, effets thermiques des transformations chimiques, endothermique, exothermique, athermique, QCM, Vaporisation, fusion, solidification, sublimation, liquéfaction, effort physique, sueur, ... |
|
|
|
Exercices : énoncé et correction a)-
Exercice 1 page 268. Identifier une transformation. b)-
Exercice 4 page 268. Décrire l’évolution d’un système chimique. c)-
Exercice 6 page 268. Ajuster des nombres stœchiométriques. d)-
Exercice 13 page 270. Des airbags pour rouler en toute sécurité. e)-
Exercice 14 page 270. Brûler des sucres, brûler des graisses. |
1)- Transformation chimique et transformation physique.
a)- Étude d’un briquet contenant du butane : (Alcane de formule brute C4H10)
- Dans quel état physique se trouve le butane dans le récipient ?

![]() On appuie sur la valve du briquet sans actionner
la molette :
On appuie sur la valve du briquet sans actionner
la molette :

- Une partie du butane présent à l’état liquide dans le briquet se vaporise et se répand à l’état gazeux dans l’atmosphère.
- Au cours de cette transformation, les molécules de butane C4H10 n’ont pas été modifiées.
- Le butane passe d’un état condensé, l’état liquide à un état dispersé, l’état gazeux.
![]() La vaporisation du butane est un exemple de
transformation physique.
La vaporisation du butane est un exemple de
transformation physique.
![]() On appuie sur la valve du briquet tout en actionnant
la molette.
On appuie sur la valve du briquet tout en actionnant
la molette.

- On observe la combustion du butane dans le dioxygène de l’air.
- Le butane C4H10 réagit avec le dioxygène O2 pour donner par combustion complète,
- du dioxyde de carbone CO2
- et de l’eau H2O (cette réaction sera étudiée en détail un peu plus tard).
- Au cours de cette transformation, des espèces chimiques disparaissent (le butane et le dioxygène)
- et des espèces chimiques apparaissent (le dioxyde de carbone et l’eau).
![]() La combustion du butane est un exemple
de
transformation chimique.
La combustion du butane est un exemple
de
transformation chimique.
b)- Expérience 2 : Réaction entre la solution aqueuse de sulfate de cuivre II et la soude.
- On verse quelques gouttes de soude dans un tube à essais contenant une solution aqueuse de sulfate de cuivre II.
- Il se forme un précipité bleu.
- Ce précipité est une nouvelle espèce chimique, appelée : hydroxyde de cuivre II.
- Une transformation chimique a eu lieu
- Les réactifs sont les ions cuivre II et les ions hydroxyde. Ils sont en solutions.
- Le produit de la réaction est l’hydroxyde de cuivre II (le précipité). Il se trouve à l’état solide.
- Une transformation chimique a lieu chaque fois qu’une nouvelle espèce chimique apparaît ou chaque fois qu’une nouvelle espèce chimique disparaît.
- Au cours d’une transformation chimique :
- les espèces chimiques qui disparaissent sont appelées les réactifs
- et les espèces chimiques qui apparaissent sont appelées les produits.
d)- Exemples : transformation chimique ou non ?
- Fermentation du raisin, ébullition de l’eau, fabrication d’un objet en fer, combustion du butane, …
2)- Description d’un système chimique.
- Un système chimique est un ensemble d’espèces chimiques.
- Pour décrire l’état du système chimique, à l’échelle macroscopique, il faut indiquer :
- La nature et la quantité des espèces chimiques qui le composent
- L’état physico-chimique des espèces chimiques (solide, liquide, gazeux, ions en solution).
- Les paramètres physiques : la pression P, la température θ (la température absolue T)
3)- État initial et état final d’un système chimique.
- On appelle état initial (E.I) du système chimique, l’état de ce système avant la transformation chimique.
- On appelle état final (E.F) du système chimique, l’état de ce système lorsque la transformation chimique est terminée.
- La transformation chimique permet le passage de l’état initial à l’état final.
b)- Exemple 2 : réaction entre la soude et la solution de sulfate de cuivre II.
|
État initial |
Transformation chimique |
État final |
|
Solution aqueuse de sulfate de
cuivre II : (Cu2+ (aq)
+ SO4 2– (aq) ) Solution aqueuse de soude : (Na+ (aq)
+ HO – (aq) ) quantités de matière : n
(Cu2+), n (SO4
2–), n (Na+),
n
(HO –), température et pression : p et θ |
Action de la soude sur la solution aqueuse de sulfate de cuivre II |
Précipité bleu d’hydroxyde de cuivre II : Cu(OH)2 (s) et la solution bleue : (Cu2+
(aq) + SO4 2– (aq)
) et (Na+ (aq)
+ HO – (aq) ) ? quantités de matière : n
(Cu(OH)2),
n (Cu2+), n (SO4
2–),
n (Na+), n
(HO –) ? température et pression : p et θ |
c)- Conclusion :
- Lorsque l’évolution d’un système chimique s’accompagne de l’apparition de nouvelles espèces chimiques,
- le passage de l’état initial à l’état final est une transformation chimique.
II- Réaction chimique et équation chimique.
- Retour sur la réaction entre le sulfate de cuivre II et la soude.
- On peut simplifier le système chimique et s’intéresser qu’aux espèces chimiques qui participent à la réaction.
- La transformation chimique qui fait intervenir les réactifs et les produits s’appelle la réaction chimique.
- Elle modélise la transformation chimique subie par un système chimique.
- On écrit : la solution de sulfate de cuivre II réagit avec la solution de soude pour donner de l’hydroxyde de cuivre II.
- On peut écrire plus simplement : les ions cuivre II réagissent avec les ions hydroxyde pour donner de l’hydroxyde de cuivre II.
- Les ions sodium et les ions sulfate ne participent pas à la réaction mais ils font partie du système chimique.
- Ce sont des ions spectateurs ou des espèces chimiques spectatrices
- Exemple : lorsqu’on s’intéresse à la combustion du butane dans l’air.
- Le système chimique concerné comprend beaucoup d’espèces chimiques différentes.
- On limite notre étude aux espèces chimiques qui participent à la réaction.
- Réaction chimique : Le butane brûle dans le dioxygène en donnant du dioxyde de carbone et de l’eau.
- Le système chimique comprend : le butane, le dioxygène, le dioxyde de carbone et l’eau.
- Conservation des éléments chimiques :
- Au cours d’une réaction chimique, il y a conservation des éléments chimiques.
- Les éléments présents dans les réactifs se retrouvent dans les produits.
- Conservation de la charge : au cours d’une réaction chimique, la charge se conserve.
- Conservation de la masse : (Lavoisier) :
- le chimiste français Lavoisier a montré que la masse des réactifs qui disparaissent est égale à la masse des produits qui apparaissent.
3)- Écriture d’une équation chimique : nombres stœchiométriques
- L’équation chimique est l’écriture symbolique d’une réaction chimique.
- Par convention :
- On écrit les formules des réactifs dans le membre gauche de l’équation chimique
- On écrit les formules des produits dans le membre droit de l’équation chimique.
-
On sépare les deux membres de l’équation par une flèche.
|
Réactifs |
Transformation
chimique |
Produits |
|
( … ) + ( … ) |
→ |
( … ) + ( … ) |
b)- Ajustement des nombres stœchiométriques.
- Ajuster les nombres stœchiométriques d’une équation, c’est choisir ces nombres de manière à traduire la conservation de tous les éléments mis en œuvre.
- Par convention, le nombre stœchiométrique se place devant la formule de l’espèce chimique.
- Le nombre stœchiométrique 1 ne s’écrit pas
c)- Applications : ajustement des nombres stœchiométriques :
- Le butane brûle dans le dioxygène pour donner du dioxyde de carbone et de l’eau
- Tableau :
|
|
Réactifs |
|
Produits |
|
Équation chimique |
2 C4H10 (g) + 13 O2 (g) |
→ |
8 CO2 (g) + 10 H2O (ℓ) |
|
Éléments
chimiques présents |
Carbone C, hydrogène H, et oxygène O. |
||
|
Nombre de
« carbone » |
2
× 4 =
8 |
|
8 × 1 = 8 |
|
Nombre
d’ « hydrogène » |
2 × 10 = 20 |
|
10 × 2 = 20 |
|
Nombre
d’ « oxygène » |
13 × 2 = 26 |
|
8 × 2 + 10 × 1 = 26 |
- Le sulfate de cuivre II réagit avec la soude en donnant un précipité bleu d’hydroxyde de cuivre II.
|
|
Réactifs |
|
Produit |
|
Équation chimique |
(Cu2+ (aq) + 2 HO – (aq) ) |
→ |
Cu(OH)2 (s) |
|
Éléments
chimiques présents |
Carbone Cu, hydrogène H, et oxygène O. |
||
|
Nombre de
« cuivre » |
1
× 1 =
1 |
|
1 × 1 = 1 |
|
Nombre
d’ « hydrogène » |
2 × 1 = 2 |
|
1 × 2 = 2 |
|
Nombre
d’ « oxygène » |
2 × 1 = 2 |
|
1 × 2 = 2 |
|
Charge |
1
×
(2+)
+ 2
×
(1-)
=
0 |
|
0 |
III- Effets thermiques accompagnant une transformation physique ou chimique.
1)- Les changements d’état d’un corps pur :
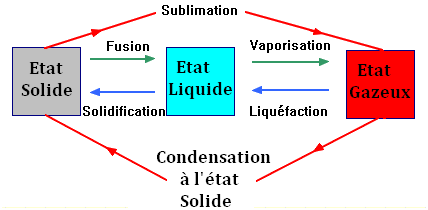
- Ce sont des transformations physiques qui n’affectent pas la structure des molécules du corps pur.
- Les changements d’état interviennent sur les interactions entre les molécules appelées liaisons intermoléculaires.
- Des effets chimiques accompagnent ces changements d’état :
- Fusion, vaporisation et sublimation absorbent de la chaleur.
- Inversement, solidification, liquéfaction et condensation à l’état solide dégagent de la chaleur.
2)- Cas d’une transformation chimique.
a)-
Dissolution de composés ioniques dans l’eau :
![]() Expérience :
Expérience :
-
On dispose de 4 solides ioniques :
-
Le chlorure de sodium
NaCl (s)
-
Le chlorure de calcium
CaCl2 (s)
-
Le nitrate de potassium
KNO3 (s)
-
Le chlorure de magnésium
MgCl2 (s)
-
Première étape :
-
On dispose de quatre tubes à essais :
-
On verse de l’eau distillée dans les tubes à essais
-
On mesure la température de l’eau distillée dans chaque tube
à essais une fois que l’équilibre thermique est réalisé.

-
Deuxième étape :
- On verse deux spatules de chlorure de sodium dans le tube A,
- deux spatules de chlorure de calcium dans le tube B,
- deux spatules de nitrate de potassium dans le tube C
- et deux
spatules de chlorure de magnésium dans le tube
D.

-
On ferme les tubes à essais avec un bouchon, on agite jusqu’à
dissolution complète des différents solides.

-
On enlève les bouchons et on mesure la température des
différents tubes à essais.

-
Tableau des mesures :
|
Tube |
A |
B |
C |
D |
|
Solide |
NaCl (s) |
CaCl2 (s) |
KNO3 (s) |
MgCl2 (s) |
|
Température initiale |
24 ° C |
24 ° C |
24 ° C |
24 ° C |
|
Température après dissolution |
24 ° C |
27 ° C |
19 ° C |
29 ° C |
|
Solution obtenue |
Solution de chlorure de sodium |
Solution de chlorure de calcium |
Solution de nitrate de potassium |
Solution de chlorure de magnésium |
|
Formule de la solution |
Na+ (aq) + Cl– (aq) |
Ca2+ (aq) + 2 Cl– (aq) |
K+ (aq) + NO3– (aq) |
Mg2+ (aq) + 2 Cl– (aq) |
![]() Conclusion :
Conclusion :
-
Lors de la dissolution d’un solide ionique dans l’eau, le
système peut absorber ou céder de la chaleur.
-
Le système peut aussi ne pas céder, ni absorber de la chaleur
(cas de la dissolution du chlorure de sodium dans l’eau).
-
La dissolution d’un cristal ionique dans l’eau se déroule en
3 étapes :
-
La dissociation des
ions du solide ;
-
La solvatation des
ions ;
-
La dispersion des ions
dans le solvant.
b)-
Cas général des réactions chimiques.
-
Lors d’une réaction chimique, le système peut absorber ou
céder de la chaleur.
-
Lorsque des molécules de réactifs disparaissent, des liaisons
chimiques sont rompues.
-
Pour rompre les liaisons chimiques le système absorbe de la
chaleur ou de l’énergie thermique.
-
Mais lorsque des molécules de produits apparaissent, des
liaisons chimiques se forment.
-
Pour former des liaisons chimiques, le système cède de
l’énergie.
- Si le système absorbe plus d’énergie thermique qu’il n’en cède,
- on dit que la réaction chimique est endothermique,
- globalement elle absorbe de la chaleur
- (c’est le cas de la réaction
entre l’hydroxyde de baryum hydraté et le thiocyanate d’ammonium)
- Si le système absorbe moins d’énergie thermique qu’il n’en cède,
- on dit que la réaction chimique est exothermique,
- globalement elle cède de la chaleur
- (c’est le cas de la combustion
du butane dans le dioxygène)
- Si le système absorbe autant d’énergie thermique qu’il n’en cède,
- on dit que la réaction chimique est athermique,
- globalement elle ne cède ni absorbe de la chaleur.
-
C’est le cas de la réaction d’estérification.
-
Les effets thermiques qui accompagnent les réactions
chimiques ont de nombreuses applications domestiques et
industrielles.
3)- Cas d’une transformation physique.
-
Les transformations physiques fusion, vaporisation et
sublimation absorbe de l’énergie thermique du milieu extérieur qui
se refroidit.
-
Les transformations physiques inverses, solidification,
liquéfaction et condensation, cèdent de l’énergie thermique au
milieu extérieur qui se réchauffe.
►
Sueur et effet thermique :
-
Lors d’un effort physique, la sueur, en s’évaporant, absorbe
une partie de la chaleur produite par le corps et permet ainsi
d’abaisser sa température.
-
L’activité physique provoque une augmentation de la
température du corps.
-
La transpiration, grâce à la production de sueur par les
glandes sudoripares, permet de maintenir le corps à une température
quasiment constante, voisine de 37 ° C.
-
Au cours d’un effort physique, un muscle produit de l’énergie
thermique.
-
Celle-ci doit être évacuée afin que la température du muscle
n’augmente pas trop.
-
Les glandes sudoripares prélèvent de l’eau dans l’organisme
et l’eau absorbe l’énergie thermique produite par le muscle.
-
En arrivant à la surface de la peau, une partie de l’énergie
thermique transportée par l’eau est libérée dans la peau qui
s’échauffe.
-
Une autre partie de l’énergie thermique est libérée à
l’extérieur.
-
L’eau sortant de la peau par les pores (la sueur) se
vaporise.
-
Cette transformation physique absorbe de l’énergie thermique
et permet ainsi d’abaisser la température de la couche supérieure
de la peau et du corps.
![]() Expérience :
Expérience :
-
Un tissu imbibé d’eau distillée remplace le vêtement mouillé
et le ventilateur remplace des courants d’air.
-
On imbibe d’eau distillée un morceau de tissu de coton.
-
On entoure un thermomètre avec le morceau de tissu mouillé et
un autre thermomètre avec un morceau de tissu sec.
-
On mesure les températures initiales du morceau de tissu
mouillé et du morceau de tissu sec.
-
On met en route le ventilateur, puis en relève les
températures finales après 10 min de fonctionnement.
-
On remarque qu’au cours de l’expérience, la température du
tissu mouillé diminue. Alors que celle du tissu sec reste
pratiquement constante.
-
Ceci vient du fait que l’eau contenue dans le tissu mouillé
s’évapore et absorbe de l’énergie thermique.
-
En conséquence, « la sensation de froid » se traduit par une
baisse de température du vêtement mouillé.
1)- QCM : Pour chaque question, indiquer la ou les bonne(s) réponse(s).
2)- Exercices : Exercices : énoncé et correction
a)- Exercice 1 page 268. Identifier une transformation.
b)- Exercice 4 page 268. Décrire l’évolution d’un système chimique.
c)- Exercice 6 page 268. Ajuster des nombres stœchiométriques.
d)- Exercice 13 page 270. Des airbags pour rouler en toute sécurité.
e)- Exercice 14 page 270. Brûler des sucres, brûler des graisses.
|
|
