Exercices avec correction Chap. N° 09
Forcer l'évolution d'un système chimique
![]()
Exercices 2024
![]()
I- Exercice : Modéliser la photosynthèse :
La photosynthèse peut être modélisée par la réaction d'oxydoréduction entre
le dioxyde de carbone gazeux CO2 (g) et l'eau H2O
(ℓ).
DONNÉES :
-
Couples oxydant / réducteur :
-
CO2 (g) / C6H12O6
(aq)
-
O2 (g) / H2O (ℓ).
a)-
Déterminer les demi-équations électroniques correspondant aux deux
couples.
b)-
En déduire l'équation de la réaction modélisant la photosynthèse.
c)- Le système chimique lors de la photosynthèse évolue en sens opposé à celui donné par le critère d'évolution spontanée.
Indiquer la source énergétique
utilisée par les végétaux pour forcer cette transformation.
a)-
Demi-équations électroniques correspondant aux deux couples.
-
Couple oxydant / réducteur :
-
CO2 (g) / C6H12O6
(aq)
|
|
Demi-équation
électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
CO2
(g) |
|
Deuxième étape :
On équilibre le carbone |
6 CO2
(g) |
|
Troisième étape : On
équilibre l’élément
oxygène avec de l’eau |
6 CO2
(g) |
|
Quatrième étape : On
équilibre l’élément
hydrogène avec H+
(on travaille en milieu acide) |
6 CO2
(g)
+
24
H+
(aq) |
|
Cinquième étape :
On équilibre les charges
avec les électrons. |
6 CO2
(g)
+
24
H+
(aq)
+ 24 e – |
-
Couple oxydant / réducteur : Chap. N° 02 Réactions d’oxydo-réduction Cours
Première (2019)
-
O2 (g) / H2O (ℓ).
|
|
Demi-équation électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
O2
(g) |
|
Deuxième étape : On
équilibre l’élément
oxygène avec de l’eau |
O2
(g) |
|
Troisième étape : On
équilibre l’élément
hydrogène avec H+
(on travaille en milieu acide) |
O2
(g) +
4
H+
(aq) |
|
Quatrième étape :
On équilibre les charges
avec les électrons. |
O2
(g) +
4
H+
(aq) +
4 e – |
b)-
Équation de la réaction modélisant la photosynthèse.
|
6
CO2 (g)
+
24
H+
(aq)
+ 24 e –
|
×1 |
|
2
H2O
(ℓ) |
×
6 |
|
6
CO2 (g) +
6 H2O
(ℓ)
|
|
c)-
Indiquer la source énergétique utilisée par les végétaux pour forcer
cette transformation.
-
Le système chimique lors de la photosynthèse évolue en sens opposé à celui donné
par le critère d'évolution spontanée.
-
Le système a besoin d’un apport d’énergie pour évoluer dans le sens inverse.
-
C’est le Soleil qui apporte cette énergie.
-
La photosynthèse :
-
Les plantes, par la photosynthèse, assurent la conversion de l’énergie
rayonnante de la lumière en énergie chimique.
-
Elles forment un réacteur chimique.
-
Une partie des radiations de la lumière du Soleil est absorbée par la
chlorophylle contenue dans les feuilles.
-
Cette énergie permet la réaction entre le dioxyde de carbone atmosphérique et
l’eau.
-
Il se forme alors du dioxygène et du glucose.
Déterminer un
type de conversion.
Les
organismes chlorophylliens
II- Exercice : Compteur électrique d’Edison.
Entre 1882 et 1895, les habitations étaient alimentées en courant électrique
continu.
Le scientifique américain Thomas Edison (1847-1931) a mis en place un
appareil permettant de mesurer « l'électricité consommée » :
10 % du courant de chaque habitation était dérivé vers une cellule
électrolytique dont une des électrodes en zinc plongeait dans une solution de
sulfate de zinc {Zn2+ (aq) + SO42–
(aq)}.
Une fois par mois, l’électrode était débranchée, rincée séchée puis pesée.
Lors d’un relevé pour une maison, après une durée de consommation électrique
Δt = 30 jours, une masse m = 34 g de zinc avait été déposée sur
l'électrode.
DONNÉES :
Masse molaire du zinc : M (Zn) = 65,4 g . mol–1.
a)-
Exprimer puis calculer la quantité de matière de zinc
n (Zn)
déposée pendant ces 30 jours.
b)-
Exprimer puis calculer la charge électrique totale
Q ayant
circulé dans la cellule pendant cette même durée. Exprimer en A . h.
c)-
Exprimer puis calculer la consommation d’électricité en
A . h de la maison considérée.
d)-
Proposer un moyen permettant d'éviter de réalimenter la
cellule électrolytique en ions Zn2+
tous les mois.
a)-
Expression et calcul de la quantité de matière de zinc
n (Zn)
déposée pendant ces 30 jours.
-
Étude de l’électrolyse de la solution de sulfate
de zinc II :
-
Plus de 50% de la production mondiale de zinc
sont obtenus par électrolyse d'une solution de sulfate de zinc acidifiée à
l'acide sulfurique.
-
Les ions sulfate ne participent pas aux réactions
électrochimiques.
-
On observe un dépôt métallique sur l'une des
électrodes et un dégagement gazeux sur l'autre.
-
Dans le cas présent, on utilise une électrode en
zinc et une électrode de graphite.
-
On veut que le dépôt de zinc se fasse sur
l’électrode de zinc.
►
Réactions
susceptibles de se produire sur chaque électrode
- Couples oxydant / réducteur :
- Zn2+ (aq) /
Zn (s) ;
H+ (aq) /
H2 (g) ;
O2 (g) /
H2O
(ℓ)
-
À la cathode
se produit une réduction (borne
reliée à la borne négative du générateur).
-
Deux réactions sont possibles :
-
H+
(aq) + 2 e– =
H2 (g)
-
Zn2+
(aq) + 2 e– =
Zn (s)
-
À l’anode
se produit une oxydation :
-
2 H2O
(ℓ) = O2 (g) + 4
e– + 4
H+ (aq)
-
Équation bilan :
|
Zn2+
(aq) + 2 e– |
|
Zn
(s) |
× 2 |
|
2 H2O
(ℓ) |
|
O2
(g) + 4 e– + 4 H+ (aq) |
× 1 |
|
2 Zn2+
(aq) + 2 H2O (ℓ) |
→ |
2 Zn
(s) + O2 (g) + 4 H+ (aq) |
|
-
Cette transformation chimique est une
transformation forcée.
-
C’est le générateur qui apporte l’énergie
nécessaire à la transformation chimique.
-
Schéma du dispositif :
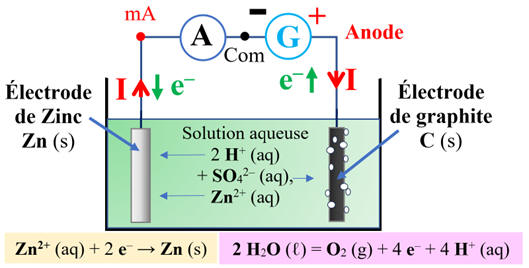
-
Les électrons arrivent par la borne
– du générateur.
-
Les électrons se déplacent dans le circuit
électrique et les ions dans la solution aqueuse.
-
Les anions chargés négativement se déplace vers
l'anode reliée à la borne positive du générateur.
-
Les cations chargés positivement se déplace vers
la borne négative du générateur.
►
Remarque :
-
Les termes anode et cathode pour noter les
électrodes s’emploient aussi pour les piles.
-
L’anode
désigne toujours l’électrode où se produit l’oxydation.
-
La
cathode désigne toujours l’électrode où se produit la
réduction
-
Durée de consommation électrique :
-
Δt = 30 jours
-
Masse de zinc : m = 34 g et masse
molaire : M (Zn)
= 65,4 g . mol–1
-
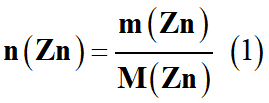
-
Application numérique :
-
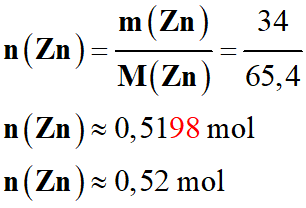
b)-
Expression et calcul de la charge électrique totale
Q ayant circulé dans la cellule pendant la durée
Δt = 30 jours.
-
Charge électrique totale
Q :
-
La quantité d’électricité Q mise en jeu au
cours de l’électrolyse pendant la durée Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday : La valeur absolue de la
charge d’une mole d’électrons définit le faraday de symbole F.
-
1 F = |NA . n (e–)|
-
Q
quantité d’électricité mise en jeu : grandeur positive :
Unité : coulomb (C).
-
Quantité de matière d’électrons échangés : n
(e–)
-
On utilise la demi-équation électronique qui fait
intervenir les électrons et l’élément zinc :
|
Équation |
Zn2+
(aq) |
+ 2 e– |
→ |
Zn
(s) |
|
Quantité
de matière |
n
(Zn
2+) |
n
(e–) |
|
n
(Zn) |
|
Coefficient
stœchiométrique |
1 |
2 |
|
1 |
-
Relation :
-
n (e–) = 2 n (Zn)
-
On en déduit la relation suivante :
-
Q =
n (e–)
. F
-
Q = 2
n (Zn) .
F
-
Application numérique :
-
Q = 2
n (Zn) .
F
-
Q ≈ 2
× 0,52 × 96500
-
Q ≈
1,00 ×105 C
-
Q ≈
1,0 ×105 C
-
De la relation :
|
Q
= I . Δt |
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de l’électrolyseur (s) |
-
On tire que :
-
1C = 1 A . s = 1/3600 A . h
-
En A . h :
-
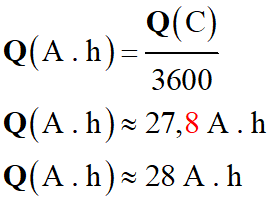
c)-
Expression et calcul de la consommation d’électricité en
A . h de la maison considérée.
-
Le scientifique américain Thomas Edison
(1847-193)1 a mis en place un appareil permettant de mesurer « l'électricité
consommée » :
-
10 % du courant de chaque habitation était dérivé
vers une cellule électrolytique.
-
La quantité d’électricité calculée précédemment
représente 10 % de « l’électricité consommée » par la maison :
-
Qconsommée = 10
Q (A . h)
-
Application numérique :
-
Qconsommée = 10
Q (A . h)
-
Qconsommée ≈ 10 × 28
-
Qconsommée ≈ 2,8 × 102
A . h
d)-
Moyen permettant d'éviter de réalimenter la cellule
électrolytique en ions Zn2+
tous les mois.
-
Le mieux est d’utiliser un compteur Linky qui
prélève moins de 10 % de « l’électricité consommée ».
III- Exercice : Rails de chemin de fer :
La préparation du manganèse métallique, utilisé pour la fabrication des rails
de chemin de fer, se fait par électrolyse d'une solution de sulfate de manganèse
II {Mn2+ (aq) + SO42–
(aq)} acidifiée par du sulfate d’ammonium{2 NH4+
(aq) + SO42– (aq)}.
DONNÉES :
-
Couples oxydant / réducteur :
-
H+ (aq) /
H2 (g)
-
Mn2+ (aq) /
Mn (s)
-
S2O82–
(aq) / SO42–
(aq)
-
O2 (g) /
H2O
(ℓ).
-
Masse molaire : M (Mn) = 54,9 g . mol–1.
1.
Expliquer pourquoi le sulfate d'ammonium permet acidifier la solution.
2.
Dresser la liste des espèces chimiques présentes en solution afin de
prévoir toutes les réactions électrochimiques susceptibles de se produire aux
électrodes.
3.
En opérant sous une tension de U = 5,0 V, pour une intensité
I = 35,0 kA, seul du manganèse se forme et un dégagement de dioxygène est
observé.
a)-
Écrire l'équation de la réaction modélisant l'électrolyse.
b)-
Exprimer puis calculer la masse maximale
mmax de métal qu'il est
possible d'obtenir chaque jour.
c)-
En réalité, la masse de métal obtenu est
mexp = 530 kg. Interpréter
cette constatation expérimentale et calculer le rendement de la synthèse du
manganèse.
d)-
Exprimer puis calculer la consommation massique, c'est-à-dire
l'énergie nécessaire pour déposer un kilogramme de manganèse.
1.
Acidification de la solution.
-
Sulfate d'ammonium : {2 NH4+
(aq) + SO42–
(aq)}
-
L’ion sulfate ne possède pas de propriétés acido-basiques
(base conjuguée d’un acide fort)
-
L’ion ammonium possède des propriétés acido-basiques.
-
C’est la forme acide du couple : NH4+ (aq) / NH3
(aq) : KA = 6,3 × 10–10
-
C’est un acide faible :
NH4+ (aq) + H2O
(ℓ)
![]() NH3 (aq)
+ H3O+ (aq)
NH3 (aq)
+ H3O+ (aq)
-
Cette solution permet d’acidifier la solution et d’améliorer la conduction de la
solution.
2.
Liste des espèces chimiques présentes en solution.
-
Les différentes solutions : sulfate de manganèse, sulfate d’ammonium,
-
Mn2+ (aq),
SO42–
(aq)
-
NH4+ (aq), NH3 (aq)
-
Le solvant l’eau : H2O (ℓ)
-
H3O+ (aq) ou H+ (aq) et
HO– (aq) (ultra
minoritaire)
-
Prévision des réactions électrochimiques susceptibles de se produire aux
électrodes :
-
Réactions susceptibles de se produire à la
cathode : (réduction)
-
Mn2+ (aq) + 2
e–
![]() Mn (s)
Mn (s)
-
2 H+ (aq) + 2
e–
![]() H2 (g)
H2 (g)
-
Réactions susceptibles de se produire à l’anode :
(oxydation)
-
2 SO42– (aq)
![]() S2O82–
(aq) + 2 e–
S2O82–
(aq) + 2 e–
-
2 H2O
(ℓ)
![]() O2 (g) + 4 H+ (aq) + 4
e–
O2 (g) + 4 H+ (aq) + 4
e–
3.
Électrolyse :
a)-
Équation de la réaction modélisant l'électrolyse.
-
Avec les réglages du générateur : du manganèse
Mn (s) se forme et un dégagement de
dioxygène O2 (g) est
observé.
|
Mn2+
(aq) + 2 e– |
|
Mn
(s) |
× 2 |
|
2 H2O
(ℓ) |
|
O2
(g) + 4 e– + 4 H+ (aq) |
× 1 |
|
2 Mn2+
(aq) + 2 H2O (ℓ) |
→ |
2 Mn
(s) + O2 (g) + 4 H+ (aq) |
|
b)-
Expression et calcul de la masse maximale
mmax de métal qu'il est
possible d'obtenir chaque jour.
-
Tension : U = 5,0 V,
-
Intensité : I = 35,0 kA,
-
Durée : Δt = 1,0 j = 8,64 × 104 s
-
Calcul de la quantité d’électricité Q
mise en jeux :
-
L’intensité I du courant qui circule
dans l’électrolyseur pendant la durée Δt
est donnée par la relation
suivante :
|
Q
= I . Δt |
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de l’électrolyseur (s) |
-
La quantité d’électricité Q mise en jeu au cours de l’électrolyse pendant
la durée Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday : La valeur absolue de la charge d’une mole d’électrons
définit le faraday de symbole F.
-
1 F = |NA . n (e–)|
-
Q quantité
d’électricité mise en jeu : grandeur positive : Unité :
coulomb (C).
-
On peut déduire de ces relations la quantité de matière d’électrons échangés au
cours de l'électrolyse :
-

-
Pour relier cette quantité de matière d’électrons échangés à la quantité de
matière de manganèse formé, il faut utiliser la demi-équation électronique
suivante :
|
Équation |
Mn2+
(aq) |
+ 2 e– |
→ |
Mn
(s) |
|
Quantité
de matière |
n
(Mn
2+) |
n
(e–) |
|
nmax
(Mn) |
|
Coefficient
stœchiométrique |
1 |
2 |
|
1 |
-
Relation :
-
n (e–) = 2 nmax (Mn)
-

-
Et enfin, en utilisant la relation suivante :
-
mmax = mmax (Mn)
= nmax (Mn)
. M (Mn)
-
![]()
-
Application numérique :
-
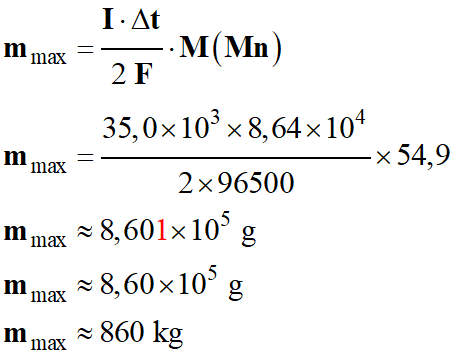
c)-
Rendement de la synthèse du manganèse.
-
Bilan énergétique d’un électrolyseur.

-
Dans une pile ou un électrolyseur, une partie de l’énergie
est dissipée sous forme de transfert thermique (effet joule).
-
Ce phénomène diminue le rendement de ces convertisseurs.
-
En conséquence la masse de métal obtenu mexp est toujours
inférieure à la valeur mmax calculée précédemment
-
Masse calculée précédemment : mmax = 860 kg
-
Masse de métal obtenu : mexp
= 530 kg.
-
Rendement de l’électrolyse :
-
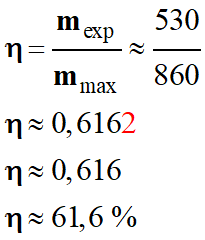
d)-
Consommation massique.
-
Énergie nécessaire pour déposer un kilogramme de manganèse :
-
Énergie électrique nécessaire pour produire
mexp = 530 kg de
manganèse :
-
Welec =
U .
I . Δt
-
Tension : U = 5,0 V,
-
Intensité : I = 35,0 kA,
-
Durée : Δt = 1,0 j = 8,64 × 104 s
-
Pour déposer un kilogramme de manganèse :
-
Consommation massique Emas :
-

-
Pour les unités : [Welec] = (V) . (A) . (s) = (J)
-
1 kWh = 3,6 × 106 J
-
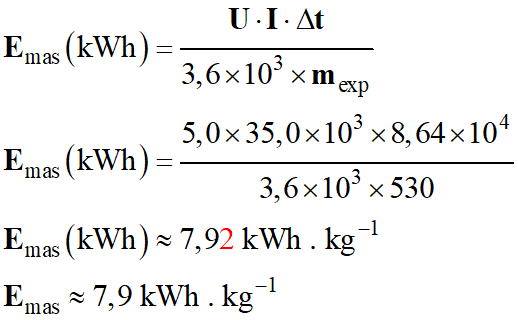
VI- Exercice : Constante de Faraday :

La constante de Faraday correspond à la charge électrique d’une mole de
charge élémentaire.
Cette constante peut être déterminée expérimentalement par une expérience
d'électrolyse.
L’électrolyse d'une solution d'iodure de potassium est réalisée dans un tube
en U.
L’électrolyse est maintenue pendant une durée Δt = 10 min et le
générateur extérieur délivre un courant d'intensité constante I = 10 mA.
À l'issue de cette électrolyse le contenu du tube en U est versé dans un
bécher.
Les électrodes et le tube sont rincés et les eaux de rinçage sont ajoutées
dans le bécher.
Le diiode formé est alors titré par une solution de thiosulfate de sodium{2
Na+ (aq) + S2O32–
(aq)} de concentration en quantité de matière C’ = 10 mmol . L–1.
Le volume versé à l'équivalence Véq vaut 6,1 mL.
DONNÉES :
-
Couples oxydant / réducteur
-
I2 (aq) /
I– (aq)
-
K+ (aq) /
K (s)
-
H2O
(ℓ) / H2 (g)
-
O2 (g) /
H2O
(ℓ).
-
S4O62–
(aq) / S2O32– (aq)
a)-
Déterminer l'équation de la réaction d'électrolyse.
b)-
Déterminer l'équation de la réaction support du titrage.
c)-
À partir de la valeur du volume à l'équivalence obtenu, déterminer la
quantité de diiode titré.
d)-
En déduire la valeur de la constante de Faraday.
e)-
Comparer à la valeur donnée dans les tables. Discuter des sources
d'erreurs possibles.
a)-
Équation de la réaction d'électrolyse.
-
Électrolyse d'une solution d'iodure de potassium :
-
Espèces présentes :
K+ (aq) +
I–
(aq)
-
Le solvant : H2O (ℓ)
-
Les couples oxydant / réducteur :
-
I2 (aq) /
I– (aq)
-
K+ (aq) /
K (s)
-
H2O
(ℓ) / H2 (g)
-
O2 (g) /
H2O
(ℓ).
-
Réactions susceptibles de se produire à la
cathode : (réduction)
-
K+ (aq) +
e–
![]() K (s)
K (s)
-
2 H2O
(ℓ) + 2 e–
![]() H2
(g) + 2 HO– (aq)
H2
(g) + 2 HO– (aq)
-
Réactions susceptibles de se produire à l’anode :
(oxydation)
-
2 H2O
(ℓ)
![]() O2 (g) + 4 H+ (aq) + 4
e–
O2 (g) + 4 H+ (aq) + 4
e–
-
2 I– (aq)
![]() I2 (aq) + 2
e–
I2 (aq) + 2
e–
►
Remarques :
-
Le potassium K (s) est un métal très réactif.
-
Il réagit avec l'eau pour former de l'hydroxyde de potassium (K+
(aq) + HO– (aq)) et
un dégagement de dihydrogène gazeux (H2
(g)).
-
Cette réaction est exothermique et peut être dangereuse.
-
Potassium métal dans l’eau :




-
Lors de l'électrolyse, l'eau, solvant, est présente et réagit avec le potassium
formé.
-
À la cathode, on observe un dégagement gazeux de dihydrogène
H2 (g) :

-
À l’anode on note l’apparition d’une coloration brune due à la formation de
diiode I2 (aq).

-
On peut aussi observer suivant les conditions expérimentales un dégagement
gazeux de dioxygène.
-
Dans le cas présent, on considère que les réactions aux électrodes sont les
suivantes :
|
2 I–
(aq) |
= |
I2
(aq) + 2 e– |
× 1 |
|
2 H2O
(ℓ) + 2 e– |
= |
H2
(g) + 2 HO–
(aq) |
× 1 |
|
2 I–
(aq) + 2 H2O (ℓ) |
→ |
I2
(aq) + H2 (g) + 2 HO–
(aq) |
|
b)-
Équation de la réaction support du titrage.
-
Titrage de la solution de diiode par une solution de thiosulfate de sodium{2
Na+ (aq) +
S2O32–
(aq)} de concentration en quantité de matière
C’ = 10 mmol . L–1.
-
On est en présence d’un titrage colorimétrique.
-
L’équivalence est repérée par un
changement de couleur :
-
Le diiode
I2 (aq), seule espèce colorée du système chimique étudié, n’est plus
présent à l’équivalence.
-
La solution devient incolore.
-
Toutefois, l’équivalence étant difficile à repérer, on ajoute juste avant
l’équivalence un indicateur coloré, l’empois d’amidon, qui permet de repérer
plus facilement l’équivalence.
►
Dispositif expérimental :
-
Au départ, la solution a la teinte
suivante :

-
On verse progressivement la solution de
thiosulfate de sodium (contenue dans la burette graduée) dans l’erlenmeyer, tout
en agitant.
-
La solution de S1 de
diiode, I2 (aq) se décolore progressivement.
-
Pour que l'indicateur qui permet de
repérer l'équivalence soit performant, il faut en verser quelques gouttes juste
avant l'équivalence lorsque la solution est jaune paille (on peut faire
plusieurs dosages pour améliorer la technique).
-
Teinte du mélange réactionnel avant
l’ajout de l’empois d’amidon :

-
Après l’ajout de l’empois d’amidon, le
mélange réactionnel prend une teinte bleue-violacée.

-
À l’équivalence, le mélange réactionnel
prend la teinte suivante :

-
Le volume de solution S de
thiosulfate de sodium est alors :
Véq = 6,1 mL
-
Schéma du montage :

►
Équation de la réaction de titrage :
|
I2
(aq) + 2 e– |
= |
2 I–
(aq) |
× 1 |
|
2 S2O32–
(aq) |
= |
S4O62–
(aq) + 2
e– |
× 1 |
|
2 I–
(aq) +
2 S2O32–
(aq) |
→ |
I2
(aq) +
S4O62–
(aq) |
|
I2
(aq) + 2
S2O32–
(aq) → 2
I– (aq) +
S4O62–
(aq)
c)-
Valeur de la quantité de diiode titré.
►
Tableau d’avancement de la réaction :
|
Équation |
I2
(aq) + |
2
S2O32–
(aq) |
→ |
2
I– (aq) |
+
S4O62–
(aq) |
|
|
état |
Avanc. x (mol) |
n (I2)
(mol) |
n
(S2O32–)
(mol) |
|
n
(I–)
(mol) |
n
(S4O62–)
(mol) |
|
État initial
à
l’équivalence
(mol) |
0 |
n (I2)
= ? |
n
(S2O32–) =
C’ . Véq |
0 |
0 |
|
|
Au cours
de la
transformation |
x |
n (I2)
– x |
n (S2O32–) – 2
x |
2 x |
x |
|
|
État final
à
Équivalence |
xmax
= xéq |
n
(I2)
– xéq |
n
(S2O32–) – 2
xéq |
2 xmax |
xmax |
|
|
0 |
0 |
|
|
|||
|
n (I2)
= xéq |
C’ .
Véq = 2
xéq |
2 xmax |
xmax |
|||
►
Quantité de matière n (I2) de
diiode :
-
À l’équivalence, les réactifs ont été mélangés dans les proportions
stœchiométriques :
|
de titrage |
I2
(aq) |
+ 2
S2O32–
(aq) |
→ |
2
I– (aq) + S4O62–
(aq) |
|
Quantités
de matières
à l’équivalence |
n
(I2) |
C’ .
Véq |
|
|
|
Coefficients
stœchiométriques |
1 |
2 |
||
-
![]()
-
Application numérique :
-
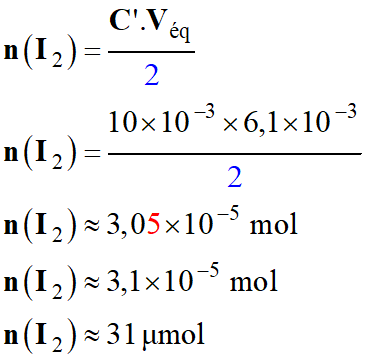
d)-
Valeur de la constante de Faraday.
-
Charge électrique totale Q :
-
La quantité d’électricité Q mise en jeu au cours de l’électrolyse pendant
la durée Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday : La valeur absolue de la charge d’une mole d’électrons
définit le faraday de symbole F.
-
1 F = |NA . n (e–)|
-
Q quantité
d’électricité mise en jeu : grandeur positive :
Unité : coulomb (C).
-
Quantité de matière d’électrons échangés : n (e–)
-
On utilise la demi-équation électronique qui fait intervenir les électrons et
l’élément zinc :
|
Équation |
I2
(aq) |
+ 2 e– |
→ |
2 I–
(aq) |
|
Quantité
de matière |
n
(I2) |
n
(e–) |
|
n
(I–) |
|
Coefficient stœchiométrique |
1 |
2 |
|
2 |
-
Relation :
-
n (e–) = 2 n (I2)
-
On en déduit la relation suivante :
-
Q =
n (e–)
. F
-
Q = 2 n (I2)
. F
-
D’autre part :
-
L’électrolyse est maintenue pendant une durée Δt = 10 min et le
générateur extérieur délivre un courant d'intensité constante I = 10 mA.
-
Quantité d’électricité Q mise en jeux :
-
L’intensité I du courant qui circule
dans l’électrolyseur pendant la durée Δt
est donnée par la relation
suivante :
|
Q
= I . Δt |
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de l’électrolyseur (s) |
-
Q = 2 n (I2)
. F = I . Δt
-
On peut en déduire l’expression qui permet de calculer la constante de Faraday
F :
-
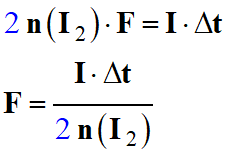
-
Application numérique :
-
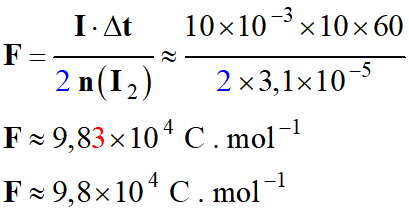
e)-
Comparaison avec la valeur donnée dans les tables.
-
Incertitude relative sur la valeur expérimentale de la constante de Faraday
F :
-

-
Les deux valeurs sont très proches.
-
Le résultat de l’expérience est satisfaisant.
-
Les sources d'erreurs possibles :
-
Bilan énergétique d’un électrolyseur.

-
Dans une un électrolyseur, une partie de l’énergie est dissipée sous forme de
transfert thermique (effet joule).
-
Ce phénomène diminue le rendement de ces convertisseurs.
-
C’est une source d’erreur.
-
On est en présence d’un titrage colorimétrique.
-
L’équivalence est repérée par un
changement de couleur :
-
Le diiode
I2 (aq), seule espèce colorée du système chimique étudié, n’est plus
présent à l’équivalence.
-
La solution devient incolore.
- Toutefois, l’équivalence étant difficile à repérer,
- Pour repérer plus facilement l'équivalence et limiter les erreurs, on ajoute juste avant l’équivalence un indicateur coloré, l’empois d’amidon.
-
C’est aussi une cause d’erreur.