|
Contrôle N° 05 Sciences physiques, Chimie
Terminale S énoncé
|
|
|
|
|
Exercice : RÉACTION D’OXYDORÉDUCTION AVEC LE COUPLE Zn2+ (aq) / Zn (s) (6,5 pts)
|
Le zinc est un métal de couleur bleu-gris,
moyennement réactif, qui se combine avec l’oxygène et d’autres
non-métaux, et qui réagit avec des acides dilués en dégageant du
dihydrogène.
On l’obtient principalement à partir du minerai
de sulfure de zinc (ZnS).
Le métal zinc est utilisé notamment comme
électrode dans de nombreuses piles telles que les piles salines et
alcalines.
Une autre application du zinc à l’état
métallique est son utilisation comme couche protectrice sur l’acier pour
lutter contre la corrosion.
Une technique possible est l’électro-zingage qui
consiste à faire un dépôt de zinc sur un métal par électrolyse.
|
Données : |
|
|
|
Une solution aqueuse contenant des ions cuivre Cu2+ est bleue ; Une solution aqueuse contenant du diiode (I2) est orange. |
|
Couples oxydant / réducteur |
Zn2+
(aq) / Zn (s) ; Cu2+
(aq) / Cu (s) Al3+
(aq) / Al (s); l2
(aq) / I– (aq) |
|
Masses molaires |
M (Zn) =
65,4 g / mol ; M (Al) = 27,0 g
/ mol |
|
Valeur du Faraday |
1 F =
9,65
× 104
C / mol |
|
Charge électrique élémentaire |
e
= 1,60
× 10–
19 C |
|
Constante d’Avogadro |
NA
= 6,02
× 1023
mol–1 |
1. Première expérience : Réaction avec le couple Cu2+ (aq) / Cu (s)
|
Dans un bécher, on introduit : Un volume V1 = 20 mL d’une solution aqueuse de sulfate de cuivre contenant des ions Cu2+ (aq) de concentration C1 = 1,0 × 10 –1 mol / L ; Un volume V2 = 10 mL d’une solution aqueuse de sulfate de zinc contenant des ions Zn2+ (aq) de concentration C2= 1,0 × 10 -1 mol / L ; Une lame de cuivre ; Une lame de zinc. Après quelques minutes, on observe plusieurs faits expérimentaux : Le mélange réactionnel initialement bleu est devenu quasiment incolore ; Un dépôt métallique rougeâtre est apparu sur la lame de zinc ; Le mélange réactionnel a subi une légère augmentation de température. On suppose que la transformation chimique qui se produit est modélisée par la réaction dont l’équation (1) figure ci-dessous. La constante d’équilibre de cette réaction a pour valeur K = 2,0 × 1037. Cu2+ (aq) + Zn (s) = Zn2+ (aq) + Cu (s) Équation (1) |
1.1. Disposant de l’équation de la réaction ci-dessus, donner l’expression du quotient de réaction Qr.
1.2. Calculer la valeur de ce quotient de réaction à l’état initial.
1.3. Appliquer le critère d’évolution spontanée et déterminer le sens d’évolution du système. Montrer que le sens d’évolution prévu est cohérent avec les observations expérimentales.
2. Deuxième expérience : Étude de la pile zinc-aluminium
|
On dispose maintenant : D’un volume V1 = 100 mL d’une solution aqueuse de sulfate de zinc contenant des ions Zn2+ (aq) de concentration C1 =3,0 × 10 –1 mol / L ; D’un volume V2 = 100 mL d’une solution aqueuse de sulfate d’aluminium contenant des ions Al3+ (aq) de concentration C2 =1,0 × 10 –1 mol / L ; D’une lame de zinc de masse m1 = 3,0 g ; D’une lame d’aluminium de masse m2 = 3,0 g ; D’un pont salin ; D’un conducteur ohmique de résistance R ; De fils de connexion. |
2.1. Schématisation de la pile
2.1.1. Réaliser le schéma annoté de la pile Zinc – Aluminium.
2.1.2. On branche un conducteur ohmique aux bornes de la pile. Compléter le schéma de la question précédente.
2.2. Principe de fonctionnement de la pile
L’équation de la réaction qui se produit quand la pile débite est :
3
Zn2+
(aq) + 2
Al
(s) = 2
Al3+
(aq) + 3
Zn (s)
2.2.1. Écrire l’équation de la réaction électronique qui se produit à l’électrode de zinc et celle qui se produit à l’électrode d’aluminium.
2.2.2. En déduire le sens de circulation des électrons dans le circuit extérieur. Justifier votre réponse.
2.2.3. Indiquer sur le schéma : le sens de circulation des électrons dans le circuit extérieur ; le sens du courant, la polarité de la pile.
2.3. Étude de la pile en fonctionnement.
2.3.1. Déterminer les quantités de matières initiales (en mol) en ion Zn2+ (aq) et en aluminium solide Al (s), sachant qu’on utilise la totalité des solutions disponibles pour réaliser la pile.
2.3.2. Compléter le tableau descriptif de l’évolution du système (voir annexe 1). En déduire le réactif limitant et la valeur xmax de l’avancement maximal.
2.3.3. Calculer la quantité maximale d’électricité Qmax que peut débiter cette pile. Justifier votre raisonnement à l’aide de la dernière colonne du tableau descriptif du système de l’annexe 1.
3. Troisième expérience : Électrolyse d’une solution d’iodure de zinc.
|
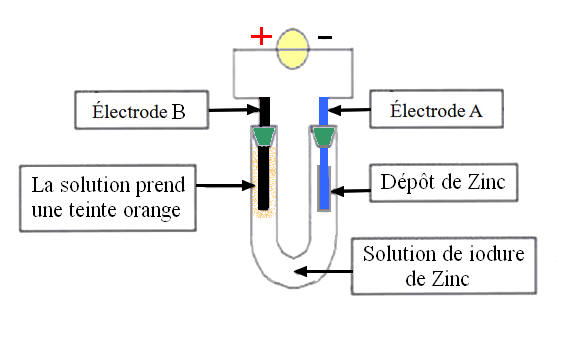
Pour faire cette expérience, on réalise un montage (représenté ci-dessous) comprenant un générateur, un tube en U rempli d’une solution aqueuse d’iodure de zinc (contenant des ions zinc Zn2+ et des ions iodure I-) et deux électrodes A et B. On constate que : Sur l’électrode A, il se forme un dépôt métallique de zinc ; Du côté de l’électrode B, la solution prend une teinte orange. |
3.1. Au niveau de l’électrode B :
3.1.1. Quel est le produit formé au niveau de l’électrode B ?
3.1.2. Écrire la demi-équation électronique correspondante.
3.2. Écrire l’équation de la réaction électronique modélisant la transformation sur l’électrode A.
3.3. Parmi les électrodes A et B, identifier l’anode et la cathode en justifiant vos réponses.
3.4. Étude quantitative de l’électrolyse :
Au cours de l’électrolyse, l’intensité du courant été maintenue à la valeur I = 500 mA. Un dépôt de zinc de masse m (Zn) = 1,50 g a été obtenu sur l’électrode A.
3.4.1. Calculer la quantité de matière d’électrons n (e–) (en mol) qui a circulé pendant l’électrolyse. On pourra raisonner sur l’équation de la réaction mise en œuvre au niveau de l’électrode A ou sur toute autre justification bien argumentée.
3.4.2. En déduire la quantité d’électricité Q mise en jeu pendant l’électrolyse.
3.4.3. Déterminer la durée Δt de l’électrolyse.
4. Bilan :
Pour chacune des trois expériences ci-dessus, indiquer à l’aide de croix sur le tableau, situé en annexe 1, si la transformation chimique mise en jeu : est spontanée ou forcée ; nécessite de l’énergie ou libère de l’énergie.
Annexe 1 de l’exercice I. à rendre avec la copie
4.1. Tableau descriptif du système :
|
Équation |
3
Zn2+ (aq) + 2 Al (s) = 2 Al3+ (aq) + 3 Zn (s) |
|
||||
|
État du système |
Avancement (mol) |
Quantité de matière (mol) |
Quantité d’électrons échangée (mol) |
|||
|
État initial |
0 |
|
|
1,0
× 10–2 |
4,6
× 10–2 |
0 |
|
En cours de transformation |
x |
|
|
|
|
|
|
État maximal |
xmax |
|
|
|
|
|
4.2. Bilan énergétique :
|
Transformation chimique : |
spontanée |
forcée |
nécessitant de l’énergie |
libérant de l’énergie |
|
Première expérience |
|
|
|
|
|
Deuxième expérience |
|
|
|
|
|
Troisième expérience |
|
|
|
|
Annexe : Tableau rempli.