|
|
Forcer l’évolution d’un système chimique Exercices |
|
|
|
|
|
QCM r
Forcer l’évolution d’un
système chimique La transformation forcée Le fonctionnement d’un
électrolyseur La conversion et le stockage de l’énergie |
1)- Exercice 05 page 182 : Identifier la réaction électrochimique :
|
Identifier la réaction électrochimique : L’électrolyse d’une solution d’acide sulfurique (2 H+ (aq) + SO42– (aq) ) est réalisée à l’aide du montage schématisé ci-dessous.
1.
Déterminer le sens de déplacement des
électrons. 2.
Identifier l’anode et la cathode. 3.
Écrire l’équation de la réaction. 4.
Comparer, en justifiant, les volumes de gaz
dégagés aux deux électrodes.
-
Données :
-
H+ (aq) /
H2 (g) :
O2 (g) /
H2O
(ℓ)
-
Les ions sulfate
SO42–
(aq) ne réagissent pas. |
|
Identifier la réaction électrochimique : 1.
Sens de déplacement des électrons.
-
Le générateur impose le sens du
courant dans le circuit.
-
Le courant sort de la borne positive
du générateur.
-
Dans les fils conducteurs, les
porteurs de charge sont les électrons qui se déplacent dans le sens inverse du courant.
-
Les électrons sortent de la borne
négative du générateur.
-
Schéma :
2.
Identification de l’anode et la cathode.
-
L’anode
désigne toujours l’électrode où se produit l’oxydation.
-
À l’anode des électrons sont cédés
par la demi-équation électronique produite
-
La
cathode désigne toujours l’électrode où se produit la
réduction.
-
À la cathode, les électrons sont
consommés par la demi-équation électronique produite.
3.
Équation de la réaction.
-
Demi- équations électroniques et
équation de la réaction :
4.
Comparaison des volumes de gaz dégagés aux
deux électrodes.
-
Tableau :
-
Relation :
-
-
Or :
V (H2)
= n (H2
) . Vm et
V (O2)
= n (O2 ) . Vm
-
Comme
n (H2
) = 2
n (O2
)
-
V (H2)
= n (H2 ) .
Vm =
2
n (O2 ) .
Vm
-
V (H2)
= 2
V (O2 )
-
Le volume de gaz obtenu à la cathode
est le double de celui obtenu à l’anode.
-
À l'anode : Le dioxygène
O2 ravive la combustion d’une bûchette incandescente.
-
À la cathode : Le dihydrogène H2
provoque une légère détonation en présence d’une flamme. |
2)- Exercice 07 page 183 : Déterminer une quantité de matière :
|
Déterminer une quantité de matière : Les casseroles en cuivre sont étamées, c’est-à-dire recouvertes d’un dépôt d’étain Sn (s), afin d’éviter de retrouver des traces d’élément cuivre dans les aliments. Ce dépôt peut être réalisé, par électrolyse ou par bain d’étain
en fusion.
L’électrolyse d’une solution aqueuse acidifiée de chlorure d’étain II, Sn2+ (aq) + 2 Cℓ– (aq), est réalisée pendant 30 minutes à une intensité constante du
courant électrique maintenue égale à 0,80 A. 1. Un dépôt d’étain Sn (s) se forme sur une électrode. Écrire l’équation de la réaction
électrochimique et nommer l’électrode. 2. Sur l’autre électrode, se dégage un gaz qui ravive une allumette incandescente. Écrire l’équation de la réaction
électrochimique ayant lieu
sur cette électrode. 3.
Déterminer la quantité d’étain Sn
(s), puis la masse d’étain m (Sn),
qui se dépose au cours de l’électrolyse.
-
Données :
-
Les électrodes utilisées sont
inattaquables.
-
O2 (g) /
H2O
(ℓ) ; Sn2+ (aq) / Sn
(s)
-
M (Sn)
= 118,7 g . mol–1 |
|
Déterminer une quantité de matière : 1.
Équation de la réaction électrochimique et
nommer l’électrode.
-
Un dépôt d’étain
Sn (s) se forme sur une électrode.
-
Demi-équation électronique de la
réaction :
-
Cette réaction consomme des
électrons.
-
C’est la cathode :
-
Il se produit une réduction. 2.
Équation de la réaction électrochimique ayant lieu sur cette
électrode.
-
Sur l’électrode, se dégage un gaz qui
ravive une allumette incandescente.
-
Ce gaz est le dioxygène O2
(g).
-
Cette réaction cède des électrons.
-
C’est l’anode.
-
Il se produit une oxydation. 3.
Détermination de la quantité d’étain Sn
(s), puis la masse d’étain m (Sn), qui se dépose au
cours de l’électrolyse.
-
Bilan
de la réaction :
-
Durée de l’électrolyse :
Δt = 30 min.
-
Intensité du courant :
I = 0,80 A
-
Quantité de matière d’étain
Sn (s) :
-
On utilise la demi-équation
électronique qui fait intervenir les électrons et l’élément étain :
-
Relation (1) :
-
-
Relation (2) :
-
-
En combinant (1) et (2) :
-
-
Application numérique :
-
-
Masse d’étain déposé :
-
m (Sn)
= n (Sn) .
M (Sn)
-
m (Sn)
≈ 7,5 × 10–3 × 118,7
-
m (Sn)
≈ 0,885 g
-
m (Sn)
≈ 0,89 g |
3)- Exercice 09 page 183 : Déterminer un type de conversion :
|
Déterminer un type de conversion : Lors de la photosynthèse des végétaux, la chlorophylle utilise l’énergie lumineuse pour transformer le dioxyde de carbone CO2 (g) et de l’eau H2O
(ℓ) en glucide comme le glucose C6H12O6
(aq), et en dioxygène O2 (g).
Lors de la respiration des végétaux, le dioxygène consommé oxyde le glucose en dioxyde de carbone. Cette réaction est la réaction opposée à celle ayant lieu lors de
la photosynthèse. 1. Écrire les demi-équations électroniques des couples : O2 (g) / H2O
(ℓ) et CO2 (g) / C6H12O6
(aq). 2.
En déduire l’équation de la réaction ayant
lieu lors de la respiration des végétaux. 3.
Type de conversion : a.
En l’absence de lumière, la photosynthèse
n’a pas lieu. Expliquer le rôle joué par la lumière. b.
Déterminer le type de conversion d’énergie
qui se produit lors de la photosynthèse. |
Déterminer un type de conversion : 1.
Demi-équations électroniques des couples :
-
Couple :
O2
(g) / H2O
(ℓ) 2 H2O
(ℓ)
O2
(g) + 4 H+ (aq) + 4 e–
-
Couple :
CO2 (g) / C6H12O6 (aq) 6
CO2
(g) + 24 H+ (aq) + 24 e–
C6H12O6
(aq) + 6 H2O
(ℓ) 2.
Équation de la réaction ayant lieu lors de
la respiration des végétaux.
-
Lors de la respiration des végétaux,
le dioxygène O2 (g) consommé
oxyde le glucose C6H12O6 (aq) en dioxyde de carbone
CO2 (g).
(O2
(g) + 4 H+ (aq) + 4 e–
→
2 H2O
(ℓ))
× 6
C6H12O6
(aq) + 6 H2O
(ℓ)
→
6 CO2
(g) + 24 H+ (aq) + 24 e–
6 O2
(g) +
C6H12O6
(aq)
6 CO2
(g) + 6
H2O
(ℓ) 3.
Type de conversion : a.
En l’absence de lumière, la photosynthèse
n’a pas lieu. Expliquer le rôle joué par la
lumière.
Photosynthèse
WR
= h . υ
6 CO2
(g) + 6
H2O
(ℓ) 6 O2
(g) +
C6H12O6
(aq)
Respiration des végétaux
-
La lumière apporte l’énergie
nécessaire à la transformation chimique.
-
Elle force la réaction à ce faire
dans le sens de la photosynthèse. b.
Type de conversion d’énergie qui se produit
lors de la photosynthèse.
![]()
![]()
![]()
![]()
![]()
4)- Exercice 12 page 184 : Des couverts en métal argenté :
|
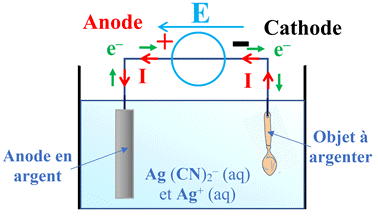
Des couverts en métal argenté : Pour argenter des objets métalliques, les orfèvres utilisent le principe de l’électrolyse« à anode soluble ». L’objet à argenter, jouant le rôle de cathode, est plongé dans une solution contenant des ions dicyanoargentate Ag (CN)2– (aq) et des ions argent I Ag+ (aq). Des anodes en argent sont placées de chaque côté du bain. Un
générateur délivre un courant d’intensité constante I = 0,70 A.
1.
L’électrolyse : a.
Schématiser le montage expérimental en
précisant les bornes du générateur auxquelles sont reliées la pièce à argenter
et les anodes. b.
Indiquer le sens conventionnel du courant
électrique et celui du déplacement des électrons. 2.
Dans le bain électrolytique, les ions argent
réagissent à la cathode selon l’équation de la réaction électrochimique : Ag+
(aq) + e– →
Ag (s)
-
Les ions argent et l’argent
métallique sur cette électrode seront écrits en vert.
-
Justifier l’intérêt d’avoir utilisé
l’objet à argenter comme cathode. 3.
Équation de la réaction électrochimique : a.
Identifier le produit formé à l’anode étant
donné le sens de circulation du courant. b. Écrire l’équation de la réaction électrochimique se produisant à l’anode. L’argent métallique à l’anode et
les ions argent intervenant à cette électrode seront écrits en rouge :
Ag (s)
et
Ag+
(aq). 4. En déduire l’écriture de l’équation de la réaction chimique modélisant la transformation se produisant lors de l’électrolyse. Justifier le terme « d’électrolyse à anode soluble ». 5. Par électrolyse, on souhaite réaliser un dépôt uniforme d’argent d’épaisseur e sur une cuillère dont la surface S est estimée à 70 cm2. La durée Δt de l’électrolyse est de 30 min. Établir l’expression de la masse d’argent m (Ag)
déposé sur le couvert pendant l’électrolyse en fonction de I,
Δt, M (Ag) et F (constante de Faraday). 6. Une fois l’électrolyse terminée, l’orfèvre applique un poinçon comportant les chiffres I ou II. En déduire le
poinçon que l’orfèvre doit appliquer sur la cuillère.
-
Données :
-
Couple oxydant / réducteur :
Ag+ (aq) /
Ag (s)
-
M (Ag)
= 108 g . mol–1 ;
-
Masse volumique de l’argent :
ρ = 10 g . cm–3 ;
-
Épaisseur du dépôt d’argent en μm :
-
Qualité I :
e > 33 μm
-
Qualité II : e > 20 μm |
Des couverts en métal argenté : 1.
L’électrolyse : a.
Schéma du montage expérimental. b.
Légende du montage. 2.
Intérêt d’avoir utilisé l’objet à argenter
comme cathode:
-
La cuillère jour le rôle de cathode :
-
Il se produit la réaction suivante :
c’est une réduction. Ag+
(aq) + e– →
Ag (s)
-
Le dépôt d’argent se fait directement
sur la cathode qui est l’objet à argenter. 3.
Équation de la réaction électrochimique : a.
Produit formé à l’anode étant donné le sens
de circulation du courant.
-
À l’anode, il se produit une
oxydation.
-
Cette réaction cède des électrons.
-
L’argent métal qui constitue l’anode
donne des ions argent Ag+
(aq). b.
Équation de la réaction électrochimique se
produisant à l’anode. Ag
(s) → Ag+ (aq)
+ e–
-
Les ions argent intervenant à cette
électrode sont écrits en rouge : Ag
(s) et
Ag+
(aq). 4.
Écriture de l’équation de la réaction
chimique modélisant la transformation se produisant lors de
l’électrolyse.
Ag+
(aq)
+ e–
→
Ag
(s)
Cathode
Ag
(s)
→
Ag+
(aq)
+
e–
Anode
Ag+
(aq)
+ Ag
(s)
→
Ag
(s)
+
Ag+
(aq)
-
Au cours de l’électrolyse, l’anode
est consommée.
-
Tout se passe comme si l’argent métal
avait été transporté de l’anode vers la cathode.
-
On parle d’électrolyse à anode
soluble. 5.
Expression de la masse d’argent m (Ag)
déposé sur le couvert pendant l’électrolyse en fonction de I,
Δt, M (Ag) et F (constante de Faraday).
-
Par électrolyse,
-
Dépôt uniforme d’argent d’épaisseur
e
-
Cuillère de surface
S = 70 cm3.
-
Durée Δt = 30 min
-
Relation :
-
Quantité de matière d’argent
Ag (s) :
-
On utilise la demi-équation
électronique qui fait intervenir les électrons et l’élément argent : Équation
Ag+
(aq)
+
e–
→
Ag
(s)
Quantité
de
matière
n
(Ag+)
n
(e–)
n
(Ag)
Coefficient
stœchiométrique
1
1
1
-
Relation (1) :
-
n (e–)
= n (Ag)
-
Masse d’argent :
-
m (Ag)
= n (Ag) . M
(Ag)
-
m (Ag)
= n (e–) . M (Ag) (1’)
-
Relation (2) :
-
-
En combinant (1) et (2)
-
6.
Poinçon que l’orfèvre doit appliquer sur la
cuillère.
-
Épaisseur du dépôt d’argent.
-
m (Ag)
= ρAg . V
-
m (Ag)
= ρAg . S
. e
-
Relation finale :
-
-
Application numérique :
-
-
Qualité II :
e
≈ 20 μm et e < 30 μm
-
L’orfèvre doit appliquer le poinçon
de chiffre II.
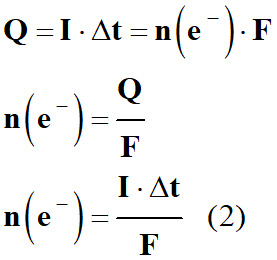
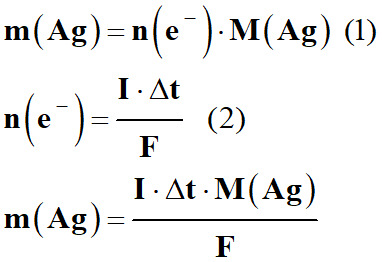

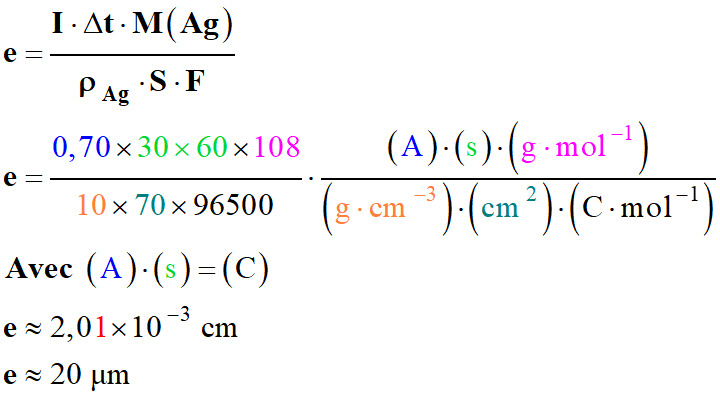
![]()
5)- Exercice 15 page 185 : Nickelage d’une pièce métallique :
|
Nickelage d’une pièce métallique : Il est possible de nickeler une pièce métallique afin de la rendre brillante par électrolyse. Un dépôt de nickel d’une épaisseur e = 40 μm est réalisé sur un pot d’échappement de moto de surface S = 10 dm2.
La pièce est plongée dans une solution contenant des ions nickel
II Ni2+ (aq). Le générateur délivre un courant d’intensité constante I =
0,70 A et la tension entre les électrodes est U = 3,0 V. 1.
Écrire l’équation de la réaction
électrochimique conduisant au dépôt de nickel. 2.
Déterminer la quantité n (Ni)
de nickel à déposer. 3.
En déduire la durée de l’électrolyse. 4.
Estimer l’énergie électrique nécessaire à la
réalisation du dépôt.
-
Données :
-
M (Ni) = 58,7 g . mol–1
-
Masse volumique du nickel : ρNi
= 8,9 g . cm–3 ;
-
Énergie (en joule) transférée par un
générateur :
|
||||||||||
|
Nickelage d’une pièce métallique : 1.
Équation de la réaction électrochimique
conduisant au dépôt de nickel.
-
Schéma du dispositif :
- Pour réaliser le nickelage électrolytique d'un objet métallique (un pot d’échappement),
la solution à utiliser contient toujours des ions nickel II
Ni2+ (aq) de concentration habituellement de l'ordre de 1,0 mol . L–1
;
-
Cette concentration doit être
maintenue à peu près constante au cours de l’électrolyse.
-
La pièce à nickeler (le pot
d’échappement) est immergée dans le bain d’électrolyse,
-
Elle est reliée à la borne négative
d’un générateur (la cathode)
-
La borne positive du générateur est
reliée à une électrode constituée de nickel pur, c'est l'anode (soluble).
-
À l’anode se produit une oxydation
(réaction qui cède des électrons) et à la cathode se produit une réduction
(réaction qui consomme des électrons) 2.
Quantité n (Ni) de nickel à
déposer.
-
Masse de nickel à déposer :
-
m (Ni) = ρNi
. V
-
m (Ni)
= ρNi .
S . e
-
Quantité de matière de nickel à
déposer : relation (1)
-
-
Quantité de matière de nickel Ni
(s) : relation (2)
-
On utilise la demi-équation
électronique qui fait intervenir les électrons et l’élément nickel :
-
3.
Durée de l’électrolyse.
-
On combine les relations (1) et (2) :
-
-
Application numérique :
- 4.
Énergie électrique nécessaire à la
réalisation du dépôt.
-
E = U . I .
Δt
-
E ≈ 3,0 × 0,70 × 1,7 ×105
-
E ≈ 3,5 ×105 J ≈ 98
Wh |
|
|