|
Les réactions d'oxydoréduction Cours |
|
|
|
|
|
|
I- Couples oxydant / réducteur. |
|
II- Réaction
d’oxydoréduction. |
|
Les réactions
d’oxydoréduction.
Les oxydants
et les réducteurs.
QCM réalisé avec le logiciel Questy Pour s’auto-évaluer |
|
1)-
Exercice 2 page 43 : Identifier des oxydants
et des réducteurs. 2)-
Exercice 4 page 43 : Recomposer des couples
oxydant /réducteur. 3)-
Exercice 8 page 43 : compléter des
demi-équations électroniques. 4)-
Exercice 8 page 43 : Établir des
demi-équations électroniques. 5)-
Exercice 11 page 44 : Identifier des couples
oxydant / réducteur. 6)-
Exercice 12 page 44 : Établir une réaction
d’oxydoréduction. 7)-
Exercice 12 page 45 : Le dioxyde de soufre
dans le vin. 8)-
Exercice 22 page 47 : Les propriétés de l’eau
oxygénée. DS (30 min) 9)-
Exercice 23 page 47 : L’encre sympathique.
|
En relation avec le TP Chimie N° 08
I- Couples oxydant /
réducteur.
-
Un oxydant
est une entité chimique capable de gagner un ou plusieurs électrons.
-
(Oxydant :
gagne)
-
Exemples du TP :
|
Ag+ |
|
Cu2+ |
|
Fe2+ |
|
Zn2+ |
-
Un réducteur
est une entité chimique capable de perdre un ou plusieurs électrons.
-
(Réducteur :
perd)
-
Exemples du TP :
Cu,
Fe ,
Zn
|
Cu |
|
Fe |
|
Zn |
2)-
Couples
oxydant / réducteur.
-
Les deux
espèces oxydant et réducteur obtenues en passant de l’une à l’autre par gain ou
perte d’un ou plusieurs électrons s’appellent des espèces conjuguées.
-
Elles
forment un couple oxydant / réducteur, noté Ox
/ Red.
-
Exemples :
|
Ox |
/ |
Red |
|
Cu2+
(aq) |
/ |
Cu (s) |
|
Fe2+
(aq) |
/ |
Fe (s) |
|
Zn2+
(aq) |
/ |
Zn (s) |
-
À tout couple
oxydant / réducteur, on associe la demi-équation électronique d’oxydoréduction
suivante :
|
Ox |
+ |
n
e – |
|
Red |
-
Ox
+
n e
– ![]() Red
Red
-
Exemple : Cu2+
(aq) + 2
e –
![]() Cu (s)
Cu (s)
-
Ceci est une
écriture formelle. La double flèche traduit la possibilité de passer d’une forme
à l’autre suivant les conditions expérimentales.
-
La
transformation chimique qui correspond au passage de l’oxydant
Ox à son réducteur
conjugué Red
est une réduction. :
-
Une réduction
est un gain d’électrons.
-
La
transformation chimique qui correspond au passage du réducteur
Red à son oxydant
conjugué Ox
est une oxydation :
-
Une oxydation
est une perte d’électrons.
-
Au cours
d’une réaction d’oxydoréduction, un oxydant est réduit et un réducteur est
oxydé.
-
En résumé :
|
|
|
|
Réduction |
|
|
Ox |
+ |
n
e – |
|
Red |
|
|
|
|
Oxydation |
|
|
Cu2+
(aq) |
+ |
2
e – |
|
Cu (s) |
a)-
Couples pour les métaux.
-
Les
métaux, noté M
(s), perdent facilement des électrons : ce sont des
réducteurs.
-
Ils donnent
des cations qui sont des oxydants.
-
Couple : Mn+
(aq) / M (s)
et demi-équation électronique associée :
-
Mn+
(aq) +
n
e –
 M (s)
M (s)
b)-
Couples entre cations métalliques.
-
Exemple : couple : Fe3+
(aq) / Fe2+
(aq)
|
Couple
Ox / Red |
Demi-équation
électronique |
|
Fe3+
(aq) / Fe2+ (aq) |
Fe3+
(aq) + e – |
-
Le cation de plus
grande charge est l’oxydant.
c)-
Couple du type
I2
/ I–
.
-
Le diiode
I2
peut capter des électrons pour donner des ions iodure
I–.
-
On peut
écrire la demi-équation électronique suivante :
|
Couple
Ox / Red |
Demi-équation
électronique |
|
I2
(aq) / I– (aq) |
I2
(aq) + 2 e – |
d)-
Le couple :
H+
(aq) / H2
(g).
-
Le
proton solvaté, H
+(aq), est un oxydant qui peut capter un électron pour donner
du dihydrogène.
-
Demi-équation électronique : 2 H+
(aq) + 2
e –
![]() H2
(g)
H2
(g)
|
Couple
Ox / Red |
Demi-équation
électronique |
|
H+
(aq) / H2 (g) |
2
H+ (aq) + 2 e
– |
-
Le dihydrogène
H2
(g) est un réducteur.
e)-
Le couple
MnO4
– (aq) / Mn
2+ (aq).
-
Une solution
aqueuse de permanganate de potassium est violette.
-
La
coloration de la solution est due à la présence des ions permanganate :
MnO4–
(aq).
-
Cette
solution se décolore quand l’ion permanganate se transforme en ion manganèse
Mn2+ (aq)
incolore
-
Application :
-
Écrire
la demi-équation électronique du couple MnO4
– (aq) / Mn
2+ (aq).
-
Pour ce
faire, on utilise une méthode systématique qui comprend plusieurs étapes :
|
|
Demi-équation
électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
MnO4–
(aq)
|
|
Deuxième étape : On
équilibre l’élément oxygène
avec de l’eau |
MnO4–
(aq)
|
|
Troisième étape : On
équilibre l’élément
hydrogène avec H+ (on travaille
en milieu acide) |
MnO4–
(aq) +
8
H+
(aq)
|
|
Quatrième étape : On équilibre
les charges
avec les électrons. |
MnO4–
(aq) +
8
H+
(aq) +
5 e – |
-
Conclusion :
l’ion permanganate est un oxydant en milieu acide.
II- Réaction
d’oxydoréduction.
-
Une réaction
d’oxydoréduction est une réaction qui met en jeu un transfert d’électrons entre
ses réactifs.
-
Elle fait
agir l’oxydant d’un couple avec le réducteur d’un autre couple pour donner leurs
espèces conjuguées.
-
Exemple : 2 Ag+
(aq) +
Cu (s)
→
2 Ag (s)
+ Cu2+
(aq)
-
On peut
écrire : Ox1
+
Red2
→
Red1
+ Ox2
2)-
Équation
d’une réaction d’oxydoréduction.
-
Une
réaction d’oxydoréduction fait intervenir l’oxydant
Ox1 et
le réducteur Red2
de deux couples oxydant réducteur Ox1
/ Red1
et Ox2
/ Red2.
-
Dans le bilan
de la réaction, les électrons ne doivent pas apparaître.
|
( Ox1
+ n1 e – |
|
( Red2
|
|
n2
Ox1
+ n1
Red2
→
n2
Red1
+
n1
Ox2 |
3)-
Exemple
de réaction d’oxydoréduction.
-
Le
diiode I2
(aq) est
réduit par les ions thiosulfate S2O32–
(aq).
-
On
obtient les ions iodure I–
(aq) et les ions tétrathionate S4O62–
(aq).
-
Donner les
deux couples oxydant / réducteur qui interviennent.
-
Donner les
demi-équations électroniques.
-
En déduire
l’équation de la réaction.
-
Les
couples: I2
(aq)/ I–
(aq) et S4O62–
(aq) /
S2O32–
(aq).
-
Les
demi-équations électroniques :
-
I2
(aq) +
2 e –
![]() 2 I
– (aq)
2 I
– (aq)
-
S4O62–
(aq) + 2 e
–
![]() 2
S2O32–
(aq)
2
S2O32–
(aq)
-
Équation de
la réaction :
|
I2
(aq) + 2 e – |
|
2 S2O32–
(aq)
|
|
I2
(aq)
+ 2 S2O32–
(aq) →
2 I– (aq)
+
S4O62–
(aq) |
- L’eau de Javel est une solution aqueuse. Son pouvoir désinfectant dépend de la valeur de sa concentration en ions hypochlorite.
- Lorsque celle-ci passe au-dessous d’une certaine valeur, l’eau de Javel n’est plus efficace.
-
Les bidons d’eau de Javel
indiquent une date limite d’utilisation.
-
L’ion hypochlorite
CℓO–
(aq) est un oxydant. Son réducteur conjugué est l’ion chlorure
Cℓ–
(aq)
-
Donner le
couple oxydant / réducteur et la demi-équation électronique.
-
Couple
oxydant / réducteur :
|
Couple
Ox / Red |
|
CℓO–
(aq) / Cℓ– (aq) |
-
Demi-équation
électronique :
|
|
Demi-équation
électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
CℓO–
(aq)
|
|
Deuxième étape : On
équilibre l’élément oxygène
avec de l’eau |
CℓO–
(aq)
|
|
Troisième étape : On
équilibre l’élément
hydrogène avec H+ (on travaille en milieu acide) |
CℓO–
(aq) + 2
H+
(aq)
|
|
Quatrième étape : On équilibre
les charges
avec les électrons. |
CℓO–
(aq) + 2
H+
(aq) +
2
e –
|
-
Les
indications du fabricant sont les suivantes :

|
EAU DE JAVEL 2,6 %
CHLORE ACTIF |
|
|
Caractéristiques
physiques |
|
|
Aspect |
Liquide limpide
exempt d’inpuretés |
|
Couleur |
Jaune paille |
|
Odeur |
Hypochlorée |
|
Point de congélation |
Début : –8,5 ° C |
|
Densité moyenne théorique : |
1,038 |
|
Caractéristiques
chimiques |
|
|
Degré chlorométrique |
8,5 ° |
|
%
Chlore actif mini : |
2,45 |
|
Chlore actif maxi : |
2,75 |
|
pH à 10 % |
12 |
|
Volume : 5 L;
Composition :
solution aqueuse d’hypochlorite de sodium
( Na+
+ ClO –) et de chlorure de sodium ; Date de
fabrication : mars 2020 ; À diluer dans
les trois mois qui suivent la fabrication. |
|
- L’Eau de Javel 2,6 % est un produit qui contient 2,6 % de chlore actif (8,5 ° chlorométrique) et désinfecte les locaux, poubelles et matériel en collectivité.
-
Il s’utilise également pour le blanchiment du linge.
- Le degré chlorométrique correspond au volume de dichlore libéré par un litre de solution au cours de cette transformation à 0 ° C et 1013 hPa.
(Volume molaire
Vm
= 22,4 L . mol–1)
-
Jusqu’à un
titre de 5 degrés chlorométriques, les produits chlorés sont des antiseptiques ;
au-delà, ce sont des désinfectants.
-
Lorsqu’on
verse de l’acide chlorhydrique concentré dans 100 mL de solution d’eau de Javel,
il se produit la réaction d’équation :
Cℓ–
(aq)
+
CℓO–
(aq) + 2 H+
(aq) →
Cℓ2
(g) + H2O
(ℓ)
-
La masse de
chlore actif indiqué sur l’étiquette correspond à la masse de dichlore libéré au
cours de cette transformation pour 100 g de solution.
-
Ainsi,
une eau de Javel à 2,6 % de chlore actif libère 2,6 g de dichlore au cours de
cette transformation pour 100 g de solution.
-
Retrouver le degré chlorométrique de cette eau de Javel
-
Masse
de dichlore libérée par l’eau de Javel à 2,6 % de chlore actif :
-
m
(Cℓ2)
= 2,6 g
-
Masse molaire
du dichlore :
-
M
(Cℓ2)
= 71,0 g . mol–1.
-
Quantité de
matière de dichlore libérée :
-
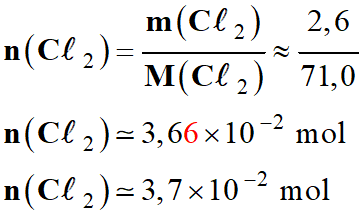
-
Or
n (Cℓ2)
= n (CℓO–)
= 3,7 × 10–2 mol
-
Concentration en ions hypochlorite de l’eau de Javel à 2,6 % de chlore actif
:
-
Il faut
connaître le volume de la solution.
-
On connaît la masse de la solution
m =
100 g et la densité d
= 1,038
-
(ρeau
= 1,00 g . mL –1)
-
Volume
V
de la solution :
-
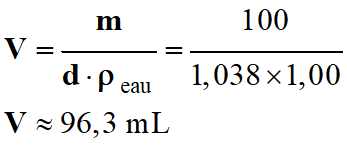
-
Concentration
C
en ion hypochlorite :
-
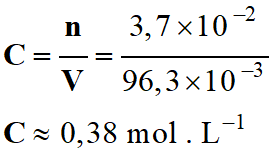
-
Pour 1 L de
solution, la quantité de matière en ions hypochlorite et en ions dichlore est la
suivante :
-
n (Cℓ2)
= n (CℓO–)
= C .
V
≈
0,38 × 1,0
-
n (Cℓ2)
= n (CℓO–)
≈ 0,38 mol
-
Volume de
dichlore libérée par un litre de solution d’eau de Javel à 2,6 % en chlore
actif :
-
V (Cℓ2)
= n (Cℓ2)
. Vm
-
V (Cℓ2)
= 0,38 × 22,4
-
V (Cℓ2)
≈ 8,5 L
-
Degré
chlorométrique de la solution d’eau de Javel à 2,6 % en chlore actif :
-
8,5 °
-
Pictogramme
de danger :
|
EAU DE JAVEL |
|
|
|
EUH206 :
Attention ! Ne pas utiliser en combinaison avec
d’autres produits.
Peut libérer des gaz dangereux (Cℓ2). |
|
H315 : Provoque
une irritation cutanée. |
|
H319 : Provoque
une sévère irritation des yeux. |
|
H410 : Très
toxique pour les organismes aquatiques.
Entraîner des
effets néfastes à long terme. |
-
Mesures de protection individuelle :

-
L’eau de
Javel se décompose lentement selon la réaction d’oxydoréduction suivante :
|
2 ClO–
(aq) |
→ |
2
Cl – (aq) |
-
Indiquer les couples
Ox /
Red
qui interviennent et donner les demi-équations électroniques.
-
Couple 1 :
|
Couple
Ox / Red |
|
CℓO–
(aq) / Cℓ– (aq) |
-
Demi-équation
électronique :
|
|
Demi-équation
électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
CℓO–
(aq)
|
|
Deuxième étape : On
équilibre l’élément
oxygène avec de l’eau |
CℓO–
(aq)
|
|
Troisième étape : On
équilibre l’élément
hydrogène avec H+ (on travaille en milieu acide) |
CℓO–
(aq) + 2
H+
(aq)
|
|
Quatrième étape : On équilibre
les charges
avec les électrons. |
CℓO–
(aq) + 2
H+
(aq) +
2
e –
|
-
Couple 2 :
|
Couple
Ox / Red |
|
O2
(g) /
H2O
(ℓ) |
-
Demi-équation électronique :
|
|
Demi-équation
électronique |
|
Première étape :
On écrit le couple
oxydant / réducteur |
O2
(g)
|
|
Deuxième étape : On
équilibre l’élément
oxygène avec de l’eau |
O2
(g)
|
|
Troisième étape : On
équilibre l’élément
hydrogène avec H+ (on
travaille en milieu acide) |
O2
(g) +
4
H+
(aq)
|
|
Quatrième étape : On
équilibre les charges
avec les électrons. |
O2
(g) +
4
H+
(aq) +
4 e
– |
-
Retrouver l’équation
bilan de la réaction de décomposition de l’eau de Javel :
|
(CℓO–
(aq) + 2
H+
(aq) +
2
e –
|
|
( 2
H2O
(ℓ)
|
|
2
CℓO–
(aq) → 2
Cℓ–
(aq) + O2 (g) |
-
La réaction est lente à température
ambiante.
-
L'eau de Javel
doit être conservée à l’abri de la lumière dans un emballage opaque et à
l'abri de la chaleur pour éviter l'accélération de sa décomposition.
Les réactions
d’oxydoréduction.
Les oxydants
et les réducteurs.
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
|
1)-
Exercice 2 page 43 : Identifier des oxydants
et des réducteurs. 2)-
Exercice 4 page 43 : Recomposer des couples
oxydant /réducteur. 3)-
Exercice 8 page 43 : compléter des
demi-équations électroniques. 4)-
Exercice 8 page 43 : Établir des
demi-équations électroniques. 5)-
Exercice 11 page 44 : Identifier des couples
oxydant / réducteur. 6)-
Exercice 12 page 44 : Établir une réaction
d’oxydoréduction. 7)- Exercice 12 page 45 : Le dioxyde de soufre dans le vin. 8)-
Exercice 22 page 47 : Les propriétés de l’eau
oxygénée. DS (30 min) 9)-
Exercice 23 page 47 : L’encre sympathique.
|
|
|