|
Titrages colorimétriques |
|
|
|
|
|
|
2)- Les différents types de dosage :
|
|
1)-
Détermination de la concentration des ions fer (II)
d’une solution de sel de Mohr.
2)-
Titrage colorimétrique du diiode par une solution
de thiosulfate de sodium. Les dosages par titrage La détermination de la concentration du réactif titré QCM réalisé avec le logiciel Questy
pour s |
|
|
|
1)-
Exercice 4
page 72 : Prévoir un changement de couleur.
2)-
Exercice 7
page 74 : Établir et exploiter une relation
d’équivalence.
3)-
Exercice 9
page 74 : Dosage du dioxyde de soufre dans le vin.
4)-
Exercice 12
page 75 : Titrage colorimétrique de l’eau oxygénée.
5)-
Exercice 15
page 76 : Titrage indirect de la vitamine C.
6)-
Exercice 14
page 76 : Titrage du paracétamol.
7)-
Exercice 17
page 77 : Titrage colorimétrique de la Bétadine. DS 30 min
8)-
Exercice 18
page 77 : Les pluies acides. DS 30 min. |
-
Un
dosage permet de déterminer la quantité de matière ou concentration d’une espèce
chimique dissoute en solution.
-
Un
dosage par titrage ou titrage est une technique de dosage qui met en jeu une
réaction chimique totale et rapide, spécifique et unique.
-
De
plus cette transformation doit présenter une caractéristique physique variant au
cours du dosage et facilement mesurable, ceci afin de suivre l’évolution du
système
2)-
Les différents types de dosage :
|
Dosage avec
un
spectrophotomètre |
Ce sont des dosages destructifs, la réaction chimique support du dosage consomme l’espèce chimique à doser. C’est pour cela que l’on travaille toujours avec une faible quantité de solution |
|
|
Dosage avec un
conductimètre
(titrage
conductimétrique) On mesure la conductivité du mélange réactionnel à l’aide d’un conductimètre. |
||
|
Dosage avec un
pH-mètre
(titrage
pH-métrique) On mesure le pH du mélange réactionnel à l’aide d’un pH-mètre |
||
|
Dosage avec un
indicateur coloré
(titrage
colorimétrique) On observe le changement de couleur du mélange réactionnel. Soit l’espèce à doser est colorée, soit il faut ajouter un indicateur coloré pour repérer l’équivalence. |
||
|
Dosage par
étalonnage : Réaliser un dosage par étalonnage consiste à déterminer la concentration d’une espèce en solution en comparant une grandeur physique, caractéristique de la solution, à la même grandeur physique mesurée pour des solutions
étalon. |
Échelle des
teintes |
Dans ce cas, aucune réaction
chimique n’est nécessaire pour le réaliser. Ici on compare la solution étudiée à des solutions étalons |
Contrôle de qualité par dosage.
3)-
Réaction support d’un titrage.
- Lors d’un titrage, le réactif titré A, dont on cherche à déterminer la concentration CA
réagit avec le
réactif B
de concentration
CB
connue.
-
L’équation de la réaction support du titrage s’écrit :
a A
+ b B
→ c C +
d D
-
Le réactif titré : on le met dans un bécher ou un erlenmeyer.
-
Montage :
Ou
5)-
La détermination de la concentration du réactif titré :
-
Au
cours du titrage, le réactif titrant est versé jusqu’à ce que le réactif titré
ait totalement réagi :
-
Alors on dit que l’équivalence est atteinte.
|
-
L’équivalence :
-
il y a équivalence lorsque les réactifs ont
été mélangés dans les proportions stœchiométriques de la réaction.
-
C’est-à-dire lorsqu’on a réalisé un mélange stœchiométrique des réactifs titré
et titrant.
-
Les deux réactifs de la réaction sont alors totalement consommés. |
|
-
Avant l’équivalence :
-
Le
réactif titrant
est totalement consommé, c’est le
réactif limitant
-
Il
reste encore du réactif titré : il est en excès. |
|
-
À l’équivalence :
-
Le
réactif titrant et le réactif titré sont totalement consommés.
-
Ils sont tous les deux limitants
(mélange stœchiométrique). |
|
-
Après l’équivalence :
-
Le
réactif titré
est totalement consommé : c’est le
réactif limitant.
-
Maintenant, c’est le réactif titrant qui est en excès. |
|
-
En
conclusion :
-
À l’équivalence du titrage, il y a changement de
réactif limitant. |
6)-
Repérage de l’équivalence :
|
-
Lors d’un titrage colorimétrique, on repère l’équivalence par un changement de
couleur du mélange réactionnel.
-
C’est le cas lorsque on teste une espèce coloré.
-
Il
est parfois possible d’utiliser un indicateur de fin de réaction pour observer
un changement de couleur à l’équivalence si les réactifs ne sont pas colorés.
-
On
ajoute alors un indicateur coloré adapté à la réaction chimique. |
-
Exemple : dosage du diiode
I2 (aq) par les ions thiosulfate
S2O32- (aq).
-
L’équivalence est repérée par un changement de couleur :
-
Le
diiode
I2 (aq), seule espèce colorée du système chimique étudié, n’est
plus présent à l’équivalence.
-
La
solution devient incolore.
- Toutefois, l’équivalence étant difficile à repérer, on ajoute juste avant l’équivalence un indicateur coloré,
l’empois d’amidon, qui permet de repérer
plus facilement l’équivalence.
7)-
Relation à l’équivalence :
-
L’équation support de dosage s’écrit :
a A
+ b B
→ c C +
d D
-
À
l’équivalence du titrage, on a réalisé un mélange stœchiométrique des réactifs
titrant et titré.
-
La
relation à l’équivalence du titrage s’écrit :
-

-
Comme on travaille avec des volumes et des concentrations, on peut affiner cette
relations :
-
Quantité de matière initiale du
réactif titré A :
-
On
connaît le volume utilisé :
VA
-
La
concentration du
réactif titré A :
CA
= ?
-
n0 (A)
=
CA
.
VA
-
Quantité de matière à l’équivalence du
réactif titrant B :
-
Volume versé à l’équivalence du
réactif titrant B :
VB =
VE
-
Le
volume
VE est le volume versé de solution titrante lorsque
l’équivalence est atteinte.
-
La
concentration du réactif titrant est connue :
CB
-
n0 (B)
=
CB .
VE
-
En
conclusion :

-
On
en déduit la concentration
CA
du réactif titré recherché :
-

1)-
Détermination de la concentration des ions fer (II) d’une solution de sel de Mohr.
a)-
Étude préliminaire :
![]() Dans un tube à essais :
Dans un tube à essais :
|
-
Introduire 2 mL de solution de sel de Mohr. - Ajouter goutte à goutte une solution de permanganate de potassium
(K+
(aq) + MnO4–
(aq) ) acidifiée.
-
Observer
et interpréter sachant que :
-
Les ions permanganate
MnO4
–
(aq)
donnent une couleur violette à la solution qui les contient
-
que les ions fer (II),
Fe2+
(aq), donnent une couleur vert pâle à la solution
qui les contient
-
que les ions fer
(III), Fe3+
(aq), donnent une couleur jaune-orangé à la solution
qui les contient
-
et
que les autres ions sont incolores. |
-
Observations :
|
- La solution de permanganate de potassium (K+ (aq) + MnO4– (aq) ) acidifiée se décolore presque immédiatement
en présence de sel de Mohr (ions fer
(II),
Fe
2+ (aq)).
-
La solution dans le tube à essais prend une teinte
orange caractéristique des ions fer (III),
Fe3+ (aq). |
![]() Citer les deux couples
oxydant / réducteur mis en jeu.
Citer les deux couples
oxydant / réducteur mis en jeu.
-
Établir l’équation bilan de la réaction de titrage.
-
Couples oxydant / réducteur :
-
Fe3+(aq)
/ Fe2+ (aq)
-
MnO4–
(aq)/ Mn2+ (aq)
-
Demi-équations électroniques :
-
Demi-équation électronique du couple
Fe3+(aq) / Fe2+ (aq)
|
Couple
Ox
/ Red |
Demi-équation électronique |
|
Fe3+
(aq) /
Fe2+ (aq) |
Fe3+
(aq) +
e –
|
-
Demi-équation électronique du couple
MnO4– (aq) / Mn2+ (aq).
|
|
Demi-équation électronique |
|
Première étape :
On écrit le
couple
oxydant /
réducteur |
MnO4–
(aq)
|
|
Deuxième étape : On équilibre l’élément oxygène avec de l’eau |
MnO4–
(aq)
|
|
Troisième étape : On équilibre l’élément hydrogène avec
H+
(on travaille en milieu
acide) |
MnO4– (aq)
+
8
H+
(aq)
|
|
Quatrième étape : On équilibre les
charges avec les électrons. |
MnO4–
(aq) +
8
H+
(aq) + 5
e –
|
b)-
Équation de la
réaction de dosage :
|
5
(Fe2+
(aq)
|
|
1 (MnO4–
(aq) + 8
H+ (aq) + 5
e –
|
|
MnO4–
(aq) +
8
H+
(aq)
+ 5
Fe2+
(aq) → Mn2+ (aq) +
5
Fe3+
(aq) +
4 H2O
(ℓ)
|
c)-
Titrage :
-
Le
montage :
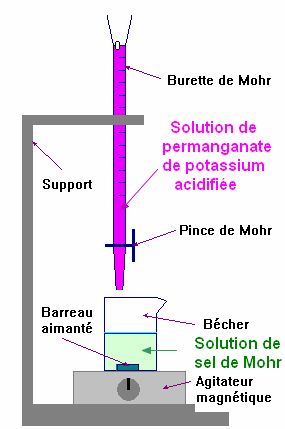
|
-
Solution contenant le
réactif titré A : Solution de sel de Mohr.
-
Volume de la solution de sel de Mohr :
VA
= 10,0 mL
-
Concentration en ion fer II de la solution de sel de Mohr :
-
CA = ? (à déterminer grâce au dosage) |
|
-
Solution contenant le
réactif titrant B :
Solution de permanganate de potassium.
-
Volume de la solution de permanganate de potassium :
-
C’est le volume versé à l’équivalence :
-
VE = ?
( à déterminer lors du dosage)
-
Concentration en ion permanganate de la solution de permanganate de potassium :
-
CB
= 15,0 mmol . L–1
|
|
-
On peut réaliser un premier dosage rapide pour avoir
une idée de la valeur du volume versé à l’équivalence
VE.
-
On
verse mL par mL la solution de permanganate de potassium jusqu’à l’obtention du
changement de couleur observé lors de l’expérience préliminaire.
-
On note, V1
le volume de la solution de permanganate de potassium versé.
-
Dans le cas présent :
-
V1 = 14 mL
-
Avec quelle précision connaît-on le volume versé à l’équivalence ?
-
Précision de l’ordre du millilitre.
-
En conséquence : 13 mL <
VE
< 14 mL |
-
On recommence le titrage, mais en versant rapidement
un volume V1
– 2 mL de réactif titrant.
-
On
continue ensuite, goutte à goutte, jusqu’au changement de couleur.
-
On note VE
le
volume versé :
-
Dans le cas présent,
-
VE ≈ 13,5 mL
-
Avec quelle précision connaît-on le volume versé à l’équivalence ?
-
Le volume versé à l’équivalence est connu à la goutte près.
-
Ordre de grandeur d’une goutte : de
0,05 mL à 0,10 mL environ
-
En
prenant 0,05 mL,
-
13,45 mL < VE
<
13,55 mL
![]() Dosage précis :
Dosage précis :
d)-
Exploitation :
- Tableau d’avancement de la réaction : Pour un volume V < VE et pour V < VE.
|
- Un dosage par titrage ou titrage est une technique de dosage qui met en jeu une réaction chimique
- totale et rapide,
spécifique et unique.
xE = xf =
xmax |
|
Équation |
MnO4– (aq) |
+
8
H+(aq) |
+
5
Fe2+
(aq) |
→ |
Mn2+
(aq) |
+
5
Fe3+
(aq) |
+4H2O(ℓ) |
|
|
État |
Avanc. |
|
|
|
|
|
|
|
|
É.I
(mol) |
|
n
(B) = 0 |
Excès |
n0
(A) = CA . VA |
0 |
0 |
solvant |
|
|
Au
cours |
x |
CB
. V – x = 0 |
Excès |
CA
. VA – 5 x |
x |
5 x |
solvant |
|
|
É.F
(mol) |
xmax |
CB
. VE – xmax |
|
CA
. VA – 5 xmax |
|
xmax |
5 xmax |
solvant |
|
Équi. |
0 |
Excès |
0 |
|
xmax |
5 xmax |
solvant |
|
-
Relation à l’équivalence :
-
À l’équivalence :
-
Quantité de matière ions permanganate versés :
-
nE (A) = CB . VE
-
Quantité de matière d’ions fer (II) Fe2+
(aq) initialement présents :
-
n0 (A) = CA
. VA
-
À
l’équivalence, les réactifs sont dans les proportions stœchiométriques :
-
Tous les réactifs ont été totalement consommés.
-
CB.VE
–
x
max
= 0
=>
x
max
=
CB.VE
(1)
-
D’autre part :
-
CA .
VA
– 5 xmax
= 0 =>
5
xmax
= CA
.
VA (2)
-
En
combinant (1) et (2) :
-
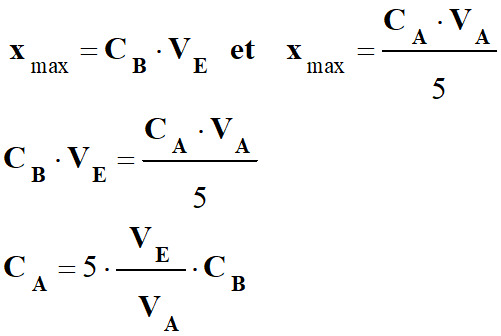
-
Application numérique :
-
Concentration
CA en ions fer (II)
Fe2+
(aq) :
- 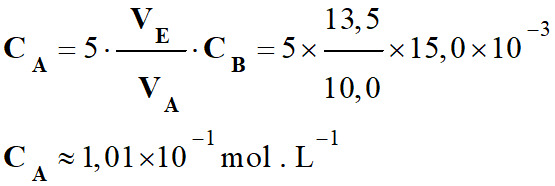
2)-
Titrage colorimétrique du diiode par une solution de thiosulfate de sodium.
►
But de la
manipulation :
-
On veut déterminer la valeur de la concentration
C1
d'une solution S1
de diiode,
I2
(aq)
-
à partir d'une solution
S2
de thiosulfate de sodium {2 Na+
(aq) + SO32–
(aq)}
-
de concentration C2 = 4,0 ×10–2 mol . L–1.
-
On
utilise un indicateur coloré (l'empois d'amidon) qui permet de repérer
l'équivalence.
►
Dispositif
expérimental :
- Dans une burette graduée de 25 mL, on introduit la solution S2 de thiosulfate de sodium
de concentration C2 = 4,0
× 10–2 mol . L–1
et on règle le zéro de la graduation.
-
Grâce à une pipette jaugée, on prélève
un volume V1 = 10,0 mL de
solution S1
de diiode, I2
(aq).
-
On verse le contenu de la pipette dans un erlenmeyer
de 250 mL et on ajoute un volume V0 = 50 mL
d’eau distillée.
-
Au
départ, la solution a la teinte suivante :

-
On
verse progressivement la solution de thiosulfate de sodium (contenue dans la
burette graduée) dans l’erlenmeyer, tout en agitant.
-
La solution de S1
de diiode, I2
(aq) se décolore progressivement.
- Pour que l'indicateur qui permet de repérer l'équivalence soit performant,
il faut en verser quelques gouttes juste avant l'équivalence lorsque la solution est jaune paille
(on peut faire plusieurs dosages pour améliorer la technique).
-
Teinte du mélange réactionnel avant l’ajout de l’empois d’amidon :

-
Après l’ajout de l’empois d’amidon, le mélange réactionnel prend une teinte
bleue-violacée.

-
À
l’équivalence, le mélange réactionnel prend la teinte suivante :

-
Le volume de solution
S2
de thiosulfate de sodium est alors :
VE
= 12,5 mL.
-
Schéma du montage :

►
Équation de la
réaction de titrage :
I2
(aq)
+ 2
S2O32–
(aq) →
2
I–
(aq)
+
S4O62–
(aq)
►
Tableau d’avancement
de la réaction :
|
Équation |
I2
(aq) + |
2
S2O32–
(aq) |
→ |
2
I– (aq) |
+
S4O62–
(aq) |
|
|
état |
Avanc.
x
(mol) |
n (I2)
(mol) |
n (S2O32–)
(mol) |
|
n (I–)
(mol) |
n
(S4O62–)
(mol) |
|
État initial
à
l’équivalence
(mol) |
0 |
n (I2)
= C1 . V1 |
n (S2O32–) =
C2 . VE |
|
0 |
0 |
|
Au cours
de la
transformation |
x |
C1
. V1 – x |
n (S2O32–) – 2
x |
2 x |
x |
|
|
État final
à
Équivalence |
xmax
= xE |
C1
. V1 – xE |
n (S2O32–) – 2
xE |
2 xmax |
xmax |
|
|
0 |
0 |
|
|
|
||
|
C1
. V1 = xE |
C2
. VE = 2 xE |
|
2 xmax |
xmax |
||
►
Concentration de la solution
S1 de
diiode :
-
À
l’équivalence, les réactifs ont été mélangés dans les proportions
stœchiométriques :
|
Équation
de titrage |
I2 (aq) |
+
2 S2O32–
(aq) |
→ |
2
I– (aq) +
S4O62– (aq) |
|
|
Quantités
de matières
à l’équivalence |
C1
. V1 |
C2 . VE |
|
|
|
|
Coefficients
stœchiométriques |
1 |
2 |
|
|
|
|
Relation |
|
|
|
|
|
- 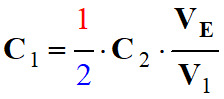
-
Application numérique :
- 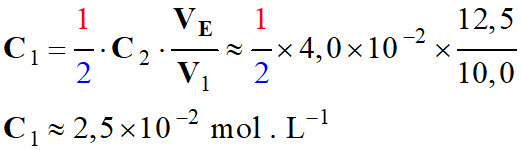
Les dosages par titrage
La détermination de la concentration du
réactif titré
QCM réalisé avec le logiciel Questy
pour s
|
1)-
Exercice 4
page 72 : Prévoir un changement de couleur.
2)-
Exercice 7
page 74 : Établir et exploiter une relation
d’équivalence.
3)-
Exercice 9
page 74 : Dosage du dioxyde de soufre dans le vin.
4)-
Exercice 12
page 75 : Titrage colorimétrique de l’eau oxygénée.
5)-
Exercice 15
page 76 : Titrage indirect de la vitamine C.
6)-
Exercice 14
page 76 : Titrage du paracétamol.
7)-
Exercice 17
page 77 : Titrage colorimétrique de la Bétadine. DS 30 min
8)-
Exercice 18
page 77 : Les pluies acides. DS 30 min. |