|
|
Les méthodes d'analyse chimique |
|
|
|
|
|
I-
L’analyse par une méthode chimique
|
|
II-
Les méthodes de suivi d’un titrage.
a)-
Réaction support de titrage :
|
|
III-
La composition d’un système. 1)-
Composition d’un système lors d’un titrage.
b)-
Composition du système dans
le bécher.
|
|
1)-
Préparation d’une solution.
QCM r
Méthodes d’analyse chimique Les méthodes de suivi d’un
titrage La composition d’un système
L |
|
Exercices : énoncé avec correction
Préparation à l’ECE : Les pastilles du bassin de Vichy
1)-
Exercice 03 page 62 : Déterminer une concentration. 2)-
Exercice 05 page 62 : Identifier une relation à
l’équivalence. 3)-
Exercice 06 page 62 : Établir une relation à
l’équivalence. 4)-
Exercice 09 page 63 : Repérer l’équivalence d’un
titrage conductimétrique. 5)-
Exercice 12 page 64 : Utiliser la méthode des
tangentes. 6)-
Exercice 13 page 64 : Établir la composition d’un
système. 7)-
Exercice 15 page 64 : Justifier l’évolution de la
conductivité. 8)-
Exercice 18 page 65 : Réaliser un contrôle de
qualité. 9)-
Exercice 21 page 67 : Algues et alimentation. 10)-
DS 01 : Traitement d’un effluent (35 min) : Exercice
24 page 68 11)-
DS 02 : Lutter contre le tartre (15 min) : Exercice
25 page 69.
|
I-
L’analyse par une méthode chimique
|
Titrer une espèce
chimique en solution,
c’est déterminer
sa concentration molaire dans la solution |
|
Le but du titrage
ou d’un dosage est de déterminer
la concentration
molaire d’une espèce chimique
M présente
dans un volume
donné et précis d’une solution.
L’outil de
détermination de cette quantité de matière est la
réaction chimique
:
C’est la réaction
de dosage ou de titrage.
Cette réaction
doit être rapide, totale, spécifique et
unique |
-
De plus cette
transformation doit présenter une caractéristique physique variant au cours du
dosage et facilement mesurable, ceci afin de suivre l’évolution du système.
|
Équivalence d’un
titrage :
À l’équivalence,
les réactifs sont dans les proportions
stœchiométriques définies
par les
coefficients de la réaction.
À l’équivalence,
il n’y a pas de réactif limitant. |
-
Lors d’un titrage,
le
réactif
titré A,
dont on cherche à
déterminer
-
la quantité de
matière
nA,
-
la masse
mA
ou
-
la concentration
CA
réagit avec le
réactif B
de concentration
CB
connue.
-
L’équation de la
réaction support du titrage s’écrit :
a A
+ b B
→ c C +
d D
►
Tableau d’avancement :
|
Équation |
a A |
+
b B |
→ |
c C |
+ d D |
|
|
État du
système |
Avancement |
n
(A)
|
n
(B) |
|
n
(C) |
n
(D) |
|
État initial
(mmol) |
x =
0 |
n0
(A)
= ? |
n
(B) (ajouté) |
0 |
0 |
|
|
État
intermédiaire |
0 ≤ x ≤ xf |
n0
(A)
–
a
. x |
n
(B)
–
b .
x |
c
.
x |
d . x |
|
|
État final
(mmol) |
x = xf
=
xmax |
n0
(A)
–
a . xf |
n
(B)
–
b .
xf |
|
c . xf |
d . xf |
-
Comme la réaction est
totale : xf
= xmax
-
On verse la solution
contenant le
réactif B
jusqu’à ce que l’équivalence
soit atteinte.
c)-
L’équivalence du titrage :
|
L’équivalence
d’un titrage est
atteinte lorsqu’on a réalisé
un mélange
stœchiométrique des réactifs titré et titrant. |
|
La relation à
l’équivalence permet de déterminer la quantité de
réactif titré. |
►
Relation à
l’équivalence :
|
Équation
de titrage :
|
a A |
+
b B |
→ |
c C |
+ d D |
|
Quantités de
matière
à l’équivalence |
n0
(A)
|
nE
(B) |
|
|
|
|
Coefficient
stœchiométriques
|
a |
b |
|
|
|
|
Relation à
l’équivalence |
|
|
|
|
|
►
Pour les volumes et
les concentrations :
-
Comme on travaille
avec des volumes et des concentrations, on peut affiner cette relation :
-
Quantité de matière
initiale du
réactif
titré A :
-
On connaît le
volume utilisé :
VA
-
La concentration du
réactif
titré A :
CA
= ?
-
n0 (A)
=
CA
.
VA
-
Quantité de matière
à l’équivalence du
réactif titrant B :
-
Volume versé à
l’équivalence du
réactif titrant B :
VB
=
VE
-
Le volume
VE
est le volume versé de solution titrante lorsque l’équivalence est atteinte.
-
La concentration du
réactif titrant est connue :
CB
-
nE (B)
=
CB
.
VE
-
En conclusion :
![]()
-
On en déduit la
concentration
CA
du réactif titré recherché :
-

-
Le réactif titré A est mis dans un bécher ou un erlenmeyer
-
Le réactif titrant B
est mis dans la burette de Mohr.

-
On
étudie le système
avant l’équivalence,
à
l’équivalence et
après l’équivalence.
|
Avant l’équivalence |
|
Le
réactif titrant
est
totalement consommé,
c’est le
réactif limitant
Il reste encore
du réactif titré :
il est en excès. |
|
À l’équivalence : |
|
Le
réactif titrant
et le
réactif titré
sont
totalement consommés.
Ils sont tous les deux limitants
(mélange stœchiométrique). |
|
Après
l’équivalence |
|
Le
réactif titré
est
totalement consommé :
c’est le
réactif limitant.
Maintenant, c’est
le réactif titrant
qui est en
excès. |
|
En
conclusion |
|
À
l’équivalence du titrage,
il y a changement de réactif limitant |
-
Tableau d’avancement :
-
On note
xE
l’avancement de la réaction à l’équivalence.
-
À l’équivalence, le
réactif titrant
et le
réactif titré
sont
totalement consommés :
-
CA
.
VA
–
a
. xE
= 0 et
CB
.
VE
–
b
. xE
= 0
-
On tire de ceci que :
-
![]()
|
|
Équation de la
réaction de titrage |
||||
|
Équation |
a A |
+ b B |
→ |
c C
+ d D |
|
|
État du
système |
Avanc. |
n
(A) |
n
(B) |
|
|
|
État initial
(mol) |
x =
0 |
n0
(A)
= CA
. VA |
n
(B) =
CB .
VB |
|
|
|
Au cours
de la
transformation |
x |
CA . VA – a . x |
CB
. VB –
b . x |
|
|
|
État pour
VB
< VE |
|
|
0
Réactif
limitant |
|
|
|
Équivalence
VB
= VE |
|
0 |
0 |
|
|
|
Mélange stœchiométrique |
|||||
|
État pour
VB
> VE |
|
0
Réactif
limitant |
|
||
f)-
Repérage
de l’équivalence :
-
Lors d’un titrage
colorimétrique, on repère l’équivalence par un changement de couleur du mélange
réactionnel.
-
C’est le cas
lorsque l’on teste une espèce colorée.
-
Il est parfois
possible d’utiliser un
indicateur de fin
de réaction
pour observer un changement de couleur à l’équivalence si les réactifs ne sont
pas colorés.
-
On ajoute alors un
indicateur coloré adapté à la réaction chimique.
2)-
Préparation de la solution titrante.
-
La
solution titrante, de concentration connue
CB
en réactif titrant, peut être préparée par dilution d’une solution commerciale.
-
Le
fabricant de la solution commerciale, peut donner la concentration de la
solution en mol . L–1, ou
la densité d
et le titre massique en pourcent
Pm en
réactif titrant.
-
La
densité d
d’un liquide, à une température donnée, est le rapport
-
de la
masse volumique du liquide
ρ
-
sur la
masse volumique ρeau
de l’eau.
|
|
|
|
d |
Densité sans
unité |
|
ρ |
Il faut
exprimer les deux masses volumiques
dans la même unité Le plus
souvent : (g . L–1) ou (kg . L–1) ou (kg . m–3) |
|
ρeau |
|
c)-
Le titre
massique en pourcent (ou pourcentage massique)
-
Le
titre massique en pourcent, noté
Pm (E) d’une espèce chimique
E
dans un liquide est le quotient :
-
De la
masse m
(E)
de cette espèce chimique
-
Par la
masse totale mtot
du liquide.
|
|
|
|
Pm
(E) |
Titre massique
en pourcent sans unité |
|
m
(E) |
Il faut
exprimer les deux masses dans la même unité Le plus
souvent : (g) ou (kg) |
|
mtot |
|
d)-
Densité
et titre massique.
-
La
densité d
et le titre massique en pourcent
Pm (E)
permettent de déterminer la concentration en réactif titrant d’une solution
commerciale.
-
Tableau :
►
Remarque :
-
Ne pas
confondre le titre massique en pourcent
Pm
(E) , grandeur sans unité avec
la concentration en masse (aussi titre massique), notée
t
(E).
|
|
|
|
t
(E) |
Concentration
en masse (g . L–1) |
|
m
(E) |
Masse de
l’espèce chimique E (g) |
|
Vsolution |
Volume de la
solution (L) |
II-
Les méthodes de suivi d’un titrage.
-
Un titrage peut être
suivi par :
-
colorimétrie ;
-
pH-métrie ;
-
conductimétrie.
-
Le suivi d’une
transformation chimique par titrage est une méthode destructive.
a)-
Réaction support de titrage :
►
Exemple :
-
La réaction support de
titrage est une réaction acido-basique.
-
Réaction entre une
solution aqueuse d’hydroxyde de sodium (soude) et une solution aqueuse d’acide
chlorhydrique.
-
Équation bilan :
H3O+
(aq) +
HO–
(aq)
→
2 H2O
(ℓ)
-
Cette réaction est
rapide, unique et totale.
-
Les
ions Na+
et Cℓ–
sont des ions spectateurs, ils sont indifférents du point de vue acide-base.
-
Comme
on effectue un suivi pH-métrique de la réaction, ils
n’interviennent pas.
►
Montage :

-
À un
volume VA
= 10,0 mL d’acide chlorhydrique de concentration
CA,
-
On
ajoute progressivement de la soude (solution aqueuse d’hydroxyde de sodium) de
concentration CB
= 1,0 × 10–1 mol . L–1.
-
On
mesure le pH de la solution initiale et
le pH de la solution obtenue après
chaque ajout de soude.
-
Tableau de valeurs :
|
VB
mL |
pH |
|
0,0 |
1,70 |
|
1,0 |
1,75 |
|
2,0 |
1,77 |
|
3,0 |
1,82 |
|
4,0 |
1,90 |
|
5,0 |
1,98 |
|
6,0 |
2,08 |
|
7,0 |
2,21 |
|
8,0 |
2,40 |
|
8,5 |
2,55 |
|
8,8 |
2,67 |
|
9,0 |
2,81 |
|
9,2 |
2,96 |
|
9,5 |
3,39 |
|
9,7 |
6,60 |
|
10,0 |
10,29 |
|
10,2 |
10,65 |
|
10,5 |
10,96 |
|
10,7 |
11,11 |
|
11,0 |
11,24 |
|
11,5 |
11,38 |
|
12,0 |
11,47 |
|
13,0 |
11,62 |
|
14,0 |
11,71 |
|
15,0 |
11,78 |
|
16,0 |
11,85 |
|
17,0 |
11,89 |
|
18,0 |
11,93 |
|
19,0 |
11,97 |
|
20,0 |
12,00 |
-
Représentation
graphique :
►
Caractéristiques du
graphe pH =
f (VB)
:
-
Le
pH
augmente lors de l’addition d’un volume
VB
de soude.
|
Partie AB de la
courbe : |
|
Au départ, le
pH est faible (la solution est acide) Il augmente
d’abord lentement car l’ion H3O+ est en excès par rapport à l’ion HO–. L’ion HO–
est le réactif limitant. |
|
Partie BC de la courbe
: |
|
Le pH
augmente d’autant plus que l’excès d’acide se réduit. On observe un
saut de pH de plusieurs unités. Ce saut de
pH provient du changement de réactif limitant. On est aux
alentours de l’équivalence. Dans la partie
BC, la courbe change de concavité, Elle possède
un point d’inflexion E. Ce point
particulier est appelé point équivalent, noté E. En ce point,
on change de réactif limitant. On passe d’un
excès d’ion H3O+ à un excès
d’ion HO–. |
|
Partie CD de la
courbe : |
|
Dans cette
zone, l’ion H3O+ est le réactif
limitant et l’ion HO– est le réactif en excès.
Cet excès
impose un pH dont la valeur est élevée Le pH
augmente à nouveau lentement puis se stabilise. |
►
Tableau d’avancement :
|
Équation de
la réaction de titrage |
|||||
|
Équation |
|
H3O+
(aq) |
+
HO–
(aq)
|
→ |
2
H2O (ℓ) |
|
État du
système |
Avanc. |
n (H3O+) |
n (HO–) |
|
|
|
État initial
(mol) |
x =
0 |
n0 (H3O+) = CA
. VA |
n (HO–)
= CB . VB |
|
|
|
Au cours
de la
transformation |
x |
CA . VA – x |
CB
. VB –
x |
|
|
|
État pour
VB <
VE |
CB
. VB < xE |
CA . VA – CB
. VB
> 0 |
0
Réactif
limitant
|
|
Avant
l’équivalence |
|
Équivalence
VB
= VE |
xE
= CA . VA
ou
xE
= CB . VE |
0 Mélange |
0 Stœchiométrique |
|
À
l’équivalence |
|
État pour
VB >
VE |
CB
. VB > xE |
0
Réactif
limitant |
CB
. VB – CA . VA
> 0 |
|
Après
l’équivalence |
-
Il y a équivalence
lorsque les réactifs ont été mélangés dans les proportions stœchiométriques de
la réaction.
-
À l’équivalence :
xE
= CA
. VA
= CB
. VE
-
Connaissant la valeur
du volume de
solution titrante
versée à l’équivalence, on peut en déduire la
concentration de la
solution titrée.
-
Les réactifs, l’ion
oxonium H3O+
et l’ion hydroxyde
HO–
ont
totalement été consommés.
-
On se retrouve avec
une solution aqueuse contenant les ions chlorure
Cℓ–
(aq) et les ions sodium
Na+
(aq) (c’est solution aqueuse de chlorure de sodium).
-
Les ions
Na+
et Cℓ–
sont des ions spectateurs, ils sont indifférents du point de vue acide-base.
-
Dans ce
cas, à l’équivalence, le
pH de la solution est égal à 7,0.
►
Remarque :
-
Dans le
cas présent, on prélève le volume
VA =
10,0 mL de la solution d’acide chlorhydrique.
-
Toutefois, il se peut
que le volume ne soit pas suffisant pour que la sonde pH-métrique soit
opérationnelle.
-
Dans ce cas, il faut
rajouter de l’eau distillée dans le bécher pour que la sonde soit bien immergée.
-
Cet
ajout d’eau distillée (dilution) dans le mélange réactionnel ne change pas la
valeur du volume VE
de solution d’hydroxyde de sodium versé à l’équivalence , mais influe sur la
valeur du saut de pH.
d)-
Repèrage de l'équivalence :
►
Le point équivalent
E :
-
Le
point équivalent est le point d’inflexion de la courbe
pH
= f (VB).
-
Au point équivalent,
on change de réactif limitant et la courbe change de concavité.
-
Le
point équivalent est caractérisé par ses coordonnées :
pHE
et VE.
-
On peut déterminer les
coordonnées du point équivalent par :
-
La méthode des
tangentes.
-
La méthode de la
courbe dérivée.
►
Méthode des
tangentes :
|
Elle
permet par une méthode graphique de déterminer les coordonnées du point
équivalent E. - On trace deux tangentes à la courbe pH = f (VB), parallèles et situées de part et d'autre du point équivalent (point d'inflexion de la courbe)
et suffisamment proche de l'équivalence.
-
On trace ensuite la
parallèle à ces deux tangentes, équidistantes de celles-ci.
-
Son
point d'intersection avec la courbe définit le point équivalent
E. |
-
Exploitation
graphique :
ZOOM

-
Coordonnées du point équivalent
E :
-
pHE
≈ 7,0
et
VE
≈ 9,8 mL
-
On peut déduire de
ceci la concentration de la solution titrée : solution d’acide chlorhydrique.
|
Solution titrante : Réactif B
Na+
(aq) + HO– (aq)
CB
= 1,0 × 10–1 mol . L–1
VB
= VE ≈ 9,8 mL |
|
Solution titrée : Réactif A
H3O+
(aq) + Cℓ– (aq)
CA
= ?
VA
= 10,0 mL |
-
À l’équivalence :
xE
= CA
. VA
= CB
. VE
-

►
La méthode de la
courbe dérivée.
-
Pour
repérer le point équivalent
E, on peut tracer la courbe
représentant le coefficient directeur
a
de la tangente à la courbe
pH =
f
(VB).
-
Le
coefficient a est défini par la relation :

-
L’abscisse VE
du point équivalent
E est l’abscisse de l’extremum de la
courbe représentant ![]() en fonction de
VB.
en fonction de
VB.
-
Exploitation
graphique :
-
On va
tracer avec le tableur Excel la courbe :![]()
-
Formule et tableau de
valeurs
-
Formule que l’on
recopie vers le bas autant que nécessaire.
|
VB
mL |
pH |
ΔpH / ΔVB |
|
0,0 |
1,70 |
0,00 |
|
1,0 |
1,75 |
0,05 |
|
2,0 |
1,77 |
0,02 |
|
3,0 |
1,82 |
0,05 |
|
4,0 |
1,90 |
0,08 |
|
5,0 |
1,98 |
0,08 |
|
6,0 |
2,08 |
0,10 |
|
7,0 |
2,21 |
0,13 |
|
8,0 |
2,40 |
0,19 |
|
8,5 |
2,55 |
0,30 |
|
8,8 |
2,67 |
0,40 |
|
9,0 |
2,81 |
0,70 |
|
9,2 |
2,96 |
0,75 |
|
9,5 |
3,39 |
1,43 |
|
9,7 |
6,60 |
16,05 |
|
10,0 |
10,29 |
12,30 |
|
10,2 |
10,65 |
1,80 |
|
10,5 |
10,96 |
1,03 |
|
10,7 |
11,11 |
0,75 |
|
11,0 |
11,24 |
0,43 |
|
11,5 |
11,38 |
0,28 |
|
12,0 |
11,47 |
0,18 |
|
13,0 |
11,62 |
0,15 |
|
14,0 |
11,71 |
0,09 |
|
15,0 |
11,78 |
0,07 |
|
16,0 |
11,85 |
0,07 |
|
17,0 |
11,89 |
0,04 |
|
18,0 |
11,93 |
0,04 |
|
19,0 |
11,97 |
0,04 |
|
20,0 |
12,00 |
0,03 |
-
Graphe :
-
L’abscisse VE
du point équivalent
E est l’abscisse de l’extremum de la
courbe représentant ![]() en fonction de
VB
en fonction de
VB
-
VE
≈ 9,8 mL
a)-
Dosage d’une solution d’acide
chlorhydrique.
►
Exemple :
-
On dose, par titrage
conductimétrique,
-
une
solution SA
d’acide chlorhydrique {H3O+ (aq) + Cℓ– (aq)},
-
par une
solution SB
d’hydroxyde de sodium, {Na+
(aq) + HO–
(aq)}.
-
L’équation de la
réaction de titrage est :
H3O+
(aq) + HO–
(aq) → 2 H2O (ℓ)
-
Le
suivi du titrage par conductimétrie permet de tracer le graphe
σ
= f
(VB)
ci-dessous.
- Dans le bécher, on verse VA = 10,0 mL de solution d’acide chlorhydrique et
- pour que l’effet de dilution soit
négligeable, lors de la manipulation, on ajoute environ
V =
250 mL d’eau distillée.
-
Conductivité molaire
ionique des différents ions.
|
Ions |
λ
(mS . m2
. mol– 1) |
|
Na+ |
5,01 |
|
H3O+ |
34,98 |
|
Cℓ– |
7,63 |
|
HO– |
19,86 |
►
Montage :

- À un volume VA = 10,0 mL d’acide chlorhydrique de concentration CA,
-
On
ajoute V
= 250 mL pour négliger le phénomène de dilution
-
Puis :
-
On
ajoute progressivement de la soude (solution aqueuse d’hydroxyde de sodium) de
concentration CB
= 1,0 × 10–1 mol . L–1.
-
On
mesure la conductivité σ de la solution initiale et la
conductivité σ de la solution obtenue après
chaque ajout de soude.
-
Le
suivi du titrage par conductimétrie permet de tracer le graphe
σ
= f
(VB).
-
Tableau de valeurs :
|
VB (mL) |
σ
(mS . cm–1) |
|
0,0 |
3,58 |
|
1,0 |
3,40 |
|
2,0 |
3,13 |
|
3,0 |
2,82 |
|
4,0 |
2,56 |
|
5,0 |
2,30 |
|
6,0 |
2,04 |
|
7,0 |
1,82 |
|
8,0 |
1,57 |
|
9,0 |
1,35 |
|
10,0 |
1,13 |
|
11,0 |
0,93 |
|
12,0 |
1,04 |
|
13,0 |
1,21 |
|
14,0 |
1,35 |
|
15,0 |
1,46 |
|
16,0 |
1,60 |
|
17,0 |
1,70 |
|
18,0 |
1,84 |
|
19,0 |
1,95 |
|
20,0 |
2,03 |
-
Représentation
graphique :
-
On peut réaliser une
étude statistique des deux parties de la courbe.
-
Tracer les deux
segments de droite et donner leurs équations (on utilise pour ce faire le
tableur Excel).
►
Caractéristiques du
graphe σ =
f (VB)
:
-
On observe une rupture
de pente.
-
La courbe est
constituée de deux segments de droite
-
Au
départ, la conductivité σ de la solution diminue.
|
Partie AE de la courbe : |
|
La
conductivité σ de la solution diminue.
-
Les ions
présents dans le mélange réactionnel sont :
-
Les ions oxonium H3O+, les ions chlorure Cℓ–, et les
ions sodium Na+.
-
Les ions hydroxyde HO–
ne sont pas présents car ils
sont totalement consommés.
-
Au cours de
la réaction, les ions oxonium disparaissent H3O
+
et ils sont remplacés par des ions sodium Na+.
- La concentration en ions oxonium H3O + diminue, la concentration en ion sodium Na+ augmente et la concentration en ions chlorure Cℓ–
ne varie pratiquement pas
(car l’effet de dilution est négligeable).
-
Comme λ
(H3O+) > λ (Na+),
la conductivité globale σ de la solution diminue.
-
L’ion
HO– est le
réactif limitant. |
|
Le point E de la courbe : |
|
-
C’est le
point de rupture de pente de la courbe.
-
Ce point
particulier est appelé point équivalent, noté E.
-
En ce
point, on change de réactif limitant.
-
On passe
d’un excès d’ion H3O+ à un excès
d’ion HO–. |
|
Partie EB de la courbe : |
|
La
conductivité σ de la solution augmente.
-
Après
l’équivalence :
-
Les ions
présents dans le mélange réactionnel sont :
-
Les ions hydroxyde HO–, les ions chlorure Cℓ–,
et les ions sodium Na+.
-
Le réactif
limitant est l’ion oxonium
H3O+,
il est totalement consommé. - La conductivité globale σ de la solution augmente après l’équivalence car on ajoute des ions hydroxyde HO–
et des ions sodium Na+ dans le mélange
réactionnel. |
c)-
Repérage de l’équivalence.
►
Le point équivalent
E :
-
Le
point équivalent est le point de rupture de la courbe de
σ
= f (VB).
-
Au point équivalent,
on change de réactif limitant et la courbe change de segment de droite.
-
Le
point équivalent est caractérisé par ses coordonnées :
σE
et VE.
ZOOM

-
Coordonnées du point équivalent
E :
-
σE
≈ 0,90
mS . cm–1
et
VE
≈ 10,8 mL
-
On peut déduire de
ceci la concentration de la solution titrée : solution d’acide chlorhydrique.
|
Solution titrante : Réactif B
Na+
(aq) + HO– (aq)
CB
= 1,0 × 10–1 mol . L–1
VB
= VE ≈ 10,8 mL |
|
Solution titrée : Réactif A
H3O+
(aq) + Cℓ– (aq)
CA
= ?
VA
= 10,0 mL |
-
À l’équivalence :
xE
= CA
. VA
= CB
. VE
-
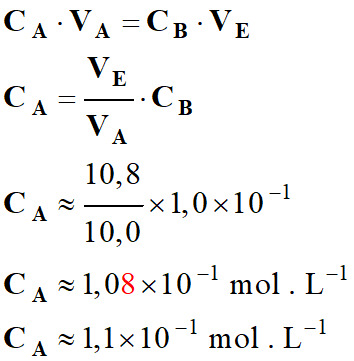
III-
La composition d’un système.
1)-
Composition d’un système lors d’un titrage.
|
Établir la composition d’un système, au
cours d’un titrage, consiste à déterminer les quantités de matière
des différentes espèces présentes
dans le milieu réactionnel |
b)-
Composition du système dans
le bécher.
-
Solution titrante :
-
Solution d’hydroxyde de sodium :
Na+
(aq) +
HO–
(aq)
-
Concentration de la solution :
CB
= 1,00 × 10–1 mol . L–1
-
Volume de la solution :
-
On établit la composition de la solution obtenue dans le bécher après un ajout
de la solution titrante d’un volume :
-
VB
= 5,0 mL, puis d’un volume
-
VB
= 15,0 mL
-
Solution titrée :
-
Solution
SA
d’acide maléique, noté
AH2
(aq).
-
Concentration de la solution :
CA
= 2,00 × 10–2 mol . L–1
-
Volume de la solution :
-
VA
= 20,0 mL
|
L’acide maléique : C’est un acide
dicarboxylique présentant une double liaison.
-
Formule
topologique :
-
Nom :
acide Z-but-2 ènedioïque
-
Il possède
un stéréoisomère : l’acide fumarique
-
Formule
topologique :
-
Nom :
acide E-but-2-ènedioïque. |
►
Équation de la
réaction support du titrage :
AH2
(aq) + 2
HO–
(aq)
→ A2–
(aq) + 2 H2O
(ℓ)
►
Tableau d’avancement
de la réaction :
-
À
partir des données, on peut déterminer la valeur du volume
VE
de solution d’hydroxyde de sodium qu’il faut verser pour atteindre
l’équivalence.
|
Équation de
la réaction de titrage |
||||||
|
Équation |
|
AH2
(aq) |
+
2 HO–
(aq)
|
→ |
A2–
(aq) |
+ 2
H2O
(ℓ) |
|
État du
système |
Avanc. |
n
(AH2) |
n
(HO–) |
|
n
(A2–) |
solvant |
|
État initial
(mol) |
x =
0 |
n0
(AH2) = CA
. VA |
n
(HO–)
= CB . VB |
|
0 |
solvant |
|
Au cours
de la
transformation |
x |
n0
(AH2) – x |
n
(HO–)
– 2 x |
|
x |
solvant |
|
Équivalence |
xE |
n0
(AH2) – xE = 0 |
n
(HO–)
– 2 xE = 0 |
|
xE |
solvant |
|
Équivalence
VB = VE
VE
≈ 8,00 mL |
|
|||||
-
D‘autre part :
-
xE
= CA
. VA
=
2,00 × 10–2
× 20,0 × 10–3
-
xE
≈ 4,0
× 10–4
mol
-
xE
≈ 0,40 mmol
c)-
Composition de la solution
contenue dans le bécher après ajout du volume
VB
= 5,0 mL d’hydroxyde de sodium :
-
Quantités de matière
initiales :
-
n0
(AH2) =
CA
. VA
-
n0
(AH2) ≈ 0,40
mmol
-
n0
(HO–)
= CB
. VB
=
1,00 × 10–1
× 5,0 × 10–3
-
n0
(HO–)
≈ 5,0
× 10–4
mol
-
n0
(HO–)
≈ 0,50 mmol
-
Le volume
VB
< VE
-
Dans ce cas, on se
situe avant l’équivalence.
|
Équation de
la réaction de titrage |
||||||
|
Équation |
|
AH2
(aq) |
+
2 HO–
(aq)
|
→ |
A2–
(aq) |
+ 2
H2O
(ℓ) |
|
État du
système |
Avanc. |
n
(AH2) |
n
(HO–) |
|
n
(A2–) |
solvant |
|
État initial
(mmol) |
x =
0 |
0,40 |
0,50 |
|
0 |
solvant |
|
Au cours
de la
transformation
(mmol) |
x |
0,40
– x |
0,50
– 2 x |
|
x |
solvant |
|
Avancement
Final
(mmol) |
xf |
n0
(AH2) – xf > 0 |
0 |
|
xf |
solvant |
|
0,25 |
0,15 |
0
Réactif
limitant |
|
0,25 |
solvant |
|
|
|
|
|||||

d)-
Composition de la solution
contenue dans le bécher après ajout du volume
VB
= 15,0 mL d’hydroxyde de sodium :
-
Quantités de matière
initiales :
-
n0
(AH2) =
CA
. VA
-
n0
(AH2) ≈ 0,40
mmol
-
n0
(HO–)
= CB
. VB
=
1,00 × 10–1
× 15,0 × 10–3
-
n0
(HO–)
≈ 1,5
× 10–3
mol
-
n0
(HO–)
≈ 1,50 mmol
-
Le volume
VB
>VE
-
Dans ce cas, on se
situe après l’équivalence.
|
Équation de
la réaction de titrage |
||||||
|
Équation |
|
AH2
(aq) |
+
2 HO–
(aq)
|
→ |
A2–
(aq) |
+ 2
H2O
(ℓ) |
|
État du
système |
Avanc. |
n
(AH2) |
n
(HO–) |
|
n
(A2–) |
solvant |
|
État initial
(mmol) |
x =
0 |
0,40 |
1,50 |
|
0 |
solvant |
|
Au cours
de la
transformation
(mmol) |
x |
0,40
– x |
1,50
– 2 x |
|
x |
solvant |
|
Avancement
Final
(mmol) |
xf |
n0
(AH2) – xE = 0 |
0,70 |
|
xf |
solvant |
|
0,40 |
0
Réactif
limitant |
0,70 |
|
0,40 |
solvant |
|
|
|
|
|||||

2)-
Courbe d’un titrage suivi par conductimétrie.
-
Lors d’un suivi d’un
titrage par conductivité, on ajoute un grand volume d’eau (V ≈ 250 mL environ),
pour pouvoir ainsi négliger le phénomène de dilution qui a lieu au cours du
dosage.
-
Règles :
-
Au cours d’un titrage,
si la quantité de matière d’une espèce chimique ionique :
-
Augmente, alors sa
contribution à la conductivité augmente.
-
diminue, alors sa
contribution à la conductivité diminue.
-
Reste constante ou
nulle, l’espèce n’intervient pas dans l’évolution de la conductivité de la
solution.
►
Exemple :
-
On
dose, par titrage conductimétrique, une solution
SA
d’acide chlorhydrique {H3O+
(aq) + Cℓ–
(aq)}, par une solution
SB
d’hydroxyde de sodium, {Na+
(aq) + HO–
(aq)}.
-
L’équation de la
réaction de titrage est :
H3O+
(aq) + HO–
(aq) → 2 H2O (ℓ)
-
Dans le
bécher, on verse VA
= 10,0 mL de solution d’acide chlorhydrique et
pour que l’effet de dilution soit
négligeable, lors de la manipulation, on ajoute environ
V =
250 mL d’eau distillée.
-
Conductivité molaire
ionique des différents ions.
|
Ions |
λ
(mS . m2
. mol– 1) |
|
Na+ |
5,01 |
|
H3O+ |
34,98 |
|
Cℓ– |
7,63 |
|
HO– |
19,86 |
►
Montage :

-
À un
volume VA
= 10,0 mL d’acide chlorhydrique de concentration
CA,
-
On
ajoute progressivement de la soude (solution aqueuse d’hydroxyde de sodium) de
concentration CB
= 1,0 × 10–1 mol . L–1.
-
Représentation
graphique :
-
Tableau
récapitulatif :
|
Avant l’équivalence |
||
|
Ions |
VB
< VE |
|
|
Na+ |
Ion spectateur
versé :
n
(Na+)
|
|
|
HO– |
Réactif limitant
n
(HO–)
= 0 |
0 |
|
H3O+ |
Réactif en
excès :
n
(H3O+)
|
|
|
Cℓ– |
Ion spectateur
contenu dans le bécher :
n
(Cℓ–) constante |
= |
|
Segment
de droite |
La courbe est
un segment de droite de coefficient
directeur négatif, Car λ (Na+) < λ (H3O+) Le coefficient directeur de la droite est proportionnel à :{ λ (Na+)
– λ (H3O+)} |
|
|
Après l’équivalence |
||
|
Ions |
VB
> VE |
|
|
Na+ |
Ion spectateur
versé :
n
(Na+)
|
|
|
HO– |
Réactif en
excès :
n
(HO–)
|
|
|
H3O+ |
Espèce
entièrement consommée :
n
(H3O+–) = 0 |
0 |
|
Cℓ– |
Ion spectateur
contenu
dans le bécher :
n
(Cℓ–) constante |
= |
|
Segment
de droite |
La courbe est un segment de droite de coefficient directeur positif. Car n (HO–)
et n (Na+) Le coefficient
directeur de la droite est proportionnel
à :{ λ (Na+) + λ (HO–)}
|
|
►
Additif :
-
Variation de la
concentration des ions chlorure au cours du titrage
-

-
La concentration
des ions chlorure diminue par effet de dilution.
-
Pour que l’effet de dilution soit négligeable, on
ajoute environ V
=
250 mL d’eau distillée.
-
Ainsi, la concentration en ions chlorure dans le
mélange réactionnel [Cℓ–]
est pratiquement constante.
-
Les ions chlorure
ne participent pas à la réaction de titrage : ions spectateurs.
-
Ainsi :
-
V >> VB
-
Au départ :
-

-
Après l’ajout du volume
VB
de solution d’hydroxyde de sodium, avec
V >>
VB
-
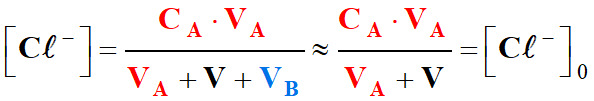
-
On peut négliger le
volume VB
devant
VA
+ V.
-
Données :
-
Solution titrée : Solution d’acide chlorhydrique :
-
CA
= 1,00 × 10–1 mol . L–1
et VA
= 10,0 mL
-
Volume d’eau distillée
ajoutée :
-
V
= 250 mL
-
Solution titrante :
solution d’hydroxyde de sodium :
-
CB
= 1,00 × 10–1 mol . L–1
et VB
= 5,0 mL
-
Concentration des ions
chlorure :
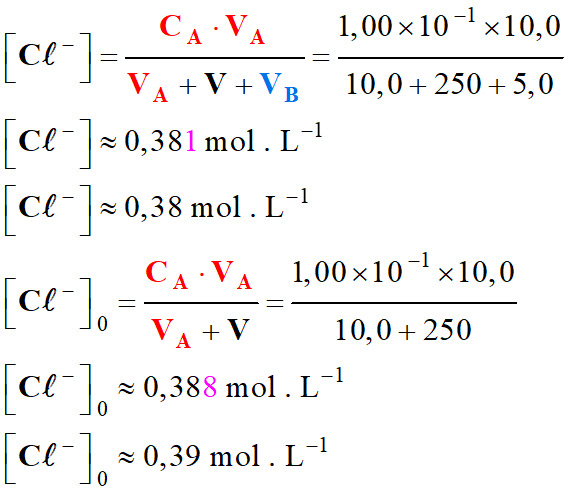
-
On peut négliger la
variation de la concentration des ions chlorure par dilution.
-
Maintenant pour
VB
= 15 mL :
-

-
On peut encore
négliger la variation de la concentration des ions chlorure par dilution.
►
Conductivité
σ du mélange
réactionnel en fonction du volume VB.
-
Avant l’équivalence :
VB
<
VE
-
On note :
Vtot =
VA
+ V
+
VB
-
Les
ions présents : Na+,
H3O+
et Cl–.
- ![]()
-
Or :
-
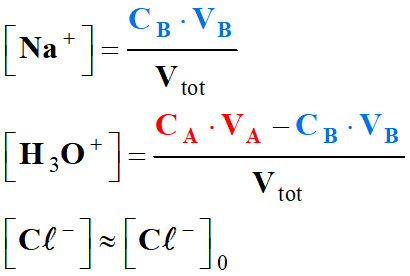
- 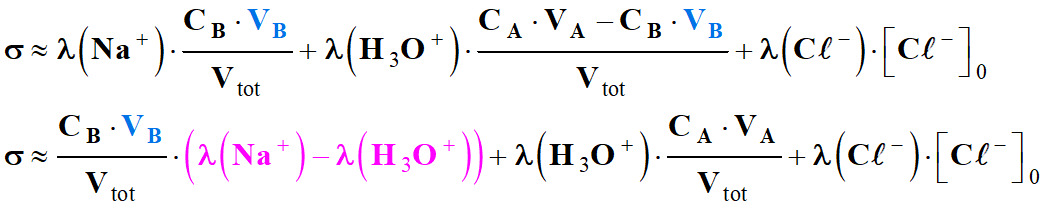
-
Les termes
 et
et
![]() varient
peu lors de l’ajout du volume
VB de
la solution d’hydroxyde de sodium.
varient
peu lors de l’ajout du volume
VB de
la solution d’hydroxyde de sodium.
-
On pose :
-
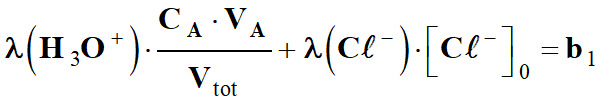
-
On est en présence
d’une équation du type :
-
σ
≈
a1 .
VB
+ b1
-
avec
a1
< 0
-

-
Lorsque l’effet de
dilution est négligeable, le coefficient directeur du segment de droite est
proportionnel à : {
λ (Na+)
– λ (H3O+)}
-
Ne pas oublier que le
volume
VB
intervient dans le volume
Vtot :
Vtot
=
VA
+ V
+ VB
-
Après l’équivalence :
VB >
VE
-
Les
ions présents : Na+,
HO–
et Cl–.
-
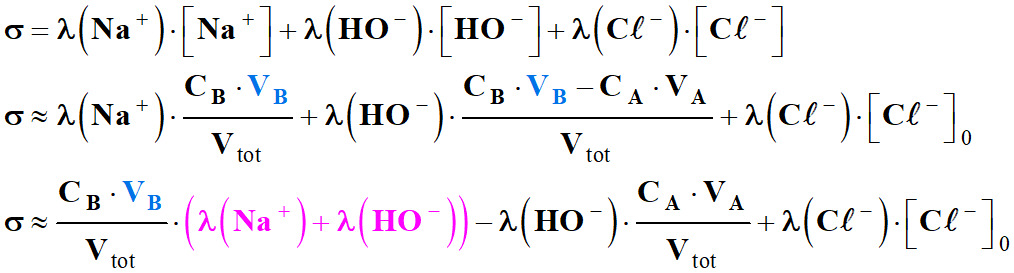
-
Les termes
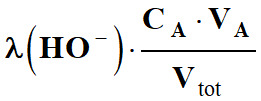 et
et
![]() varient
peu lors de l’ajout du volume
VB de
la solution d’hydroxyde de sodium.
varient
peu lors de l’ajout du volume
VB de
la solution d’hydroxyde de sodium.
-
On pose : 
-
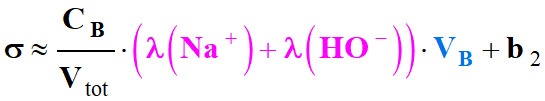
-
On est en présence
d’une équation du type :
-
σ
≈
a2 .
VB
+ b2
-
avec
a2
> 0
-
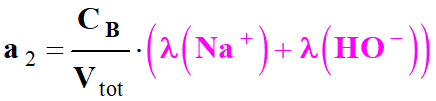
-
Lorsque l’effet de
dilution est négligeable, le coefficient directeur du segment de droite est
proportionnel à : {
λ (Na+)
+ λ (HO–)}
-
Ne pas oublier que le
volume
VB
intervient dans le volume
Vtot :
Vtot
=
VA
+ V
+ VB
1)-
Préparation d’une solution.
QCM r
Méthodes d’analyse chimique
Les méthodes de suivi d’un titrage
La composition d’un système
|
Exercices : énoncé avec correction Préparation à l’ECE : Les pastilles du bassin de Vichy
1)-
Exercice 03 page 62 : Déterminer une concentration. 2)-
Exercice 05 page 62 : Identifier une relation à
l’équivalence. 3)-
Exercice 06 page 62 : Établir une relation à
l’équivalence. 4)-
Exercice 09 page 63 : Repérer l’équivalence d’un
titrage conductimétrique. 5)-
Exercice 12 page 64 : Utiliser la méthode des
tangentes. 6)-
Exercice 13 page 64 : Établir la composition d’un
système. 7)-
Exercice 15 page 64 : Justifier l’évolution de la
conductivité. 8)-
Exercice 18 page 65 : Réaliser un contrôle de
qualité. 9)-
Exercice 21 page 67 : Algues et alimentation. 10)-
DS 01 : Traitement d’un effluent (35 min) : Exercice
24 page 68 11)-
DS 02 : Lutter contre le tartre (15 min) : Exercice
25 page 69.
|
|
|