|
De la structure à la polarité d'une espèce chimique. Cours |
|
|
|
|
|
|
I- Schéma de Lewis d’un atome, d’une molécule ou d’un ion. 2)- Schéma de Lewis d’un atome ou d’un ion monoatomique. 3)- Schéma de Lewis d’une molécule. 4)- Schéma de Lewis d’un ion polyatomique.
|
|
II- La
géométrie des édifices atomiques.
2)- Insuffisance du modèle de Lewis.
3)- Géométrie
d’une molécule et d’un ion polyatomique.
|
|
III-
Les molécules
polaires et apolaires.
2)- Polarité d’une liaison
covalente et moment dipolaire.
|
|
QCM réalisé avec
le logiciel Questy
Pour s'auto-évaluer
Configuration électronique et schéma de Lewis.
La formation d’une molécule ou d’un ion.
La géométrie des édifices chimiques.
Les molécules polaires et apolaires
|
|
|
|
1)-
Exercice 4 page 92 :
Déterminer un nombre d’électrons de valence. 2)-
Exercice 6 page 92 : Établir
le schéma de Lewis d’un atome. 3)-
Exercice 8 page 92 :Attribuer
à un atome son schéma de Lewis. 4)-
Exercice 8 page 92 : Établir
le schéma de Lewis d’une molécule. 5)-
Exercice 10 page
92 :Justifier la charge d’un ion. 6)-
Exercice 12 page 93 :
Représenter une lacune électronique. 7)-
Exercice 13 page 93 :
Justifier la présence d’une lacune électronique. 8)-
Exercice 14 page 93 :Proposer
le schéma de Lewis d’un ion. 9)-
Exercice 16 page 93 : Nommer
une figure géométrique. 10)-
Exercice 18 page 93 :
Justifier la géométrie d’une molécule. 11)-
Exercice 20 page 93 :Prévoir
la polarité d’une molécule. 12)-
Exercice 25 page 94 : Un
précurseur du nylon. 13)-
Exercice 27 page 95 : Un
agent de blanchiment. 14)-
Exercice 30 page 95 : Polaire
ou apolaire ? 15)- DS page 97 : Acide et base de Lewis : Une solution aqueuse : Des températures d’ébullition différentes.
|
I-
Schéma de Lewis d’un atome, d’une molécule ou d’un
ion.
-
Tableau périodique des
éléments des 3 premières périodes (simplifié) :
|
1 |
|
|
|
|
|
|
18 |
|
H
1s1 |
2 |
13 |
14 |
15 |
16 |
17 |
He
1s2 |
|
Li
…2s1 |
Be
…2s2 |
B
…2s22p1 |
C
…2s22p2 |
N
…2s22p3 |
O
…2s22p4 |
F
…2s22p5 |
Ne
…2s22p6 |
|
Na
…3s1 |
Mg
…3s2 |
Al
…3s23p1 |
Si
…3s23p2 |
P
…3s23p3 |
S
…3s23p4 |
Cl
…3s23p5 |
Ar
…3s23p6 |
-
Dans le tableau
simplifié, on ne fait apparaître que la couche électronique externe.
-
Rappels de seconde :
-
Les gaz nobles
(hélium, He, néon,
Ne, argon,
Ar,
.) possèdent une stabilité énergétique
remarquable.
-
Ils réagissent très
rarement avec d’autres éléments.
-
Leur configuration
électronique de valence est de la forme ns2np6.
-
Ou dans le cas de
l’hélium, 1s2.
-
Un atome d’hélium
possède 2 électrons sur sa couche de valence (duet).
-
Un atome de néon et un
atome d’argon possèdent 8 électrons sur la couche de valence (octet).
-
Règle de stabilité :
-
Au cours des
transformations chimiques, les atomes tendent à acquérir la même configuration
électronique que celle d’un gaz noble,
-
C’est-à-dire une
configuration électronique de valence en duet ou en octet.
-
Pour obtenir une
configuration électronique stable, les atomes forment :
-
Des ions
-
Ou des molécules.
-
En résumé :
-
Les atomes des
éléments des trois premières périodes tendent à obtenir une configuration
électronique identique à celle d’un gaz noble.
-
Pour cela, ils peuvent
former :
-
Des ions ou des
molécules.
-
Ainsi
leur dernière couche électronique
n (couche de valence) est saturée :
-
Soit à
deux
électrons si n
= 1 (règle du Duet)
-
Soit à
huit
électrons si
1 <
n ≤ 3 (règle de l’Octet)
2)- Schéma de Lewis d’un atome ou d’un ion
monoatomique.
a)-
Schéma de Lewis d’un atome :
-
Il permet de
représenter la structure électronique externe d’un atome.
![]() Règles :
Règles :
-
Chaque atome est
scindé formellement en deux :
-
Le noyau et les
électrons des couches internes sont représentés par le symbole de l’élément
chimique.
-
Les électrons de
valence sont représentés par
-
des points (●)
s’ils sont célibataires
-
ou par un tiret
(–)
s’ils forment un doublet.
![]() Remarque :
Remarque :
-
On admet :
-
Que jusqu’à 4
électrons de valence, l’atome est entouré d’électrons célibataires ;
-
Qu’au-delà, les
électrons supplémentaires s’ajoutent aux électrons célibataires pour former des
doublets.
-
Schéma de Lewis des
premiers atomes :
b)-
Schéma de Lewis d’un ion
monoatomique :
-
Pour représenter le
schéma de Lewis des ions, les mêmes règles s’appliquent :
-
Exemple : Quel est
l’ion obtenu à partir de l’atome d’oxygène ?
-
Atome
d’oxygène Z = 8
-
Configuration
électronique :
1s2
2s2 2p4
-
Configuration
électronique de valence :
2s2
2p4
-
L’atome d’oxygène tend
à gagner deux électrons pour obtenir configuration électronique du néon
1s2
2s2 2p6
|
|
Atome
d’oxygène |
|
Ions oxyde |
|
Configuration
électronique |
1s2
2s2 2p4 |
→ |
1s2
2s2 2p6 |
|
Schéma
de Lewis |
|
+ 2 électrons
|
|
3)-
Schéma de
Lewis d’une molécule.
-
Le
schéma de LEWIS précise l’enchaînement
des atomes et la position des doublets liants et non liants.
-
Dans le
schéma de LEWIS d’une molécule :
-
Le symbole de
l’élément représente le noyau de l’atome et les électrons internes,
-
Chaque doublet
d’électrons externes est figuré par un tiret.
-
On
distingue les doublets liants et les doublets non liants :
-
Un
doublet liant
est représenté par un tiret entre les symboles de deux atomes,
-
Un
doublet non liant
est représenté par un tiret situé autour du symbole d’un atome auquel il
appartient.
-
Une liaison simple est
notée A
– B,
une liaison double A
=
B et une liaison
triple A
≡ B.
►
Application : Schéma de Lewis de la molécule de
CO2.
-
Configuration
électronique de l’atome d’oxygène :
1s12s22p4
-
Il possède 6 électrons
sur sa couche électronique de valence (2s22p4)
-
Il peut mettre en
commun 2 électrons pour acquérir une configuration électronique de valence en
octet.
-
Configuration
électronique de l’atome de carbone :
1s12s22p2
-
Il possède 4 électrons
sur sa couche électronique de valence (2s22p2)
-
Il peut mettre en
commun 4 électrons pour acquérir une configuration électronique de valence en
octet.
-
Chaque atome d’oxygène
va mettre en commun deux électrons avec l’atome de carbone.
-
Chaque atome d’oxygène
est doublement lié à l’atome de carbone.
-
Chaque atome respecte
ainsi la règle de l’octet.

![]() Remarque :
Remarque :
-
Généralement :
-
Un atome forme autant
de liaisons qu’il a d’électrons célibataires sur l’atome central.
-
L’atome central est
souvent celui qui peut former le plus de liaisons.
4)- Schéma de Lewis d’un ion polyatomique.
►
Exemple : Établir les
schémas de Lewis des ion polyatomiques suivants :
-
L’ion
hydroxyde HO–
-
L’ion
oxonium H3O+
-
L’ion
ammonium NH4+
![]() Méthode :
Méthode :
-
On peut appliquer la
méthode suivante :
-
On écrit le schéma de
Lewis de chaque atome présent dans l’ion polyatomique.
-
Selon la charge de
l’ion :
-
On ajoute ou en retire
des électrons à l’un des atomes et on indique sa charge.
-
On relie les électrons
célibataires pour former des liaisons covalentes en respectant les règles de
stabilité.
-
L’ion
hydroxyde HO–
|
L’ion
hydroxyde
HO– |
Atome
d’hydrogène |
Atome
d’oxygène |
Schéma de
Lewis de
l’ion hydroxyde
HO– |
|
Schéma
de Lewis |
|
|
|
|
L’atome
d’oxygène
gagne
1 électron |
|
|
|
-
Remarque :
-
L’atome
d’oxygène possède 6 électrons sur sa couche
électronique de valence (2s22p4).
-
Dans
l’ion hydroxyde, l’atome d’oxygène possède
7 électrons
(en propre).
-
Il possède donc 1
électron en plus. Pour mettre ceci en évidence,
-
On lui attribue une
charge formelle négative, figurée par le signe
![]() .
.
-
L’ion
oxonium H3O+
|
L’ion oxonium H3O+ |
Atome
d’hydrogène |
Atome
d’oxygène |
Schéma de
Lewis de
l’ion oxonium
H3O+ |
|
Schéma
de Lewis |
|
|
|
|
L’atome
d’oxygène
perd
1 électron |
|
|
|
-
Remarque :
-
L’atome
d’oxygène possède 6 électrons sur sa couche
électronique de valence (2s22p4).
-
Dans
l’ion oxonium, l’atome d’oxygène possède
5 électrons
(en propre).
-
Il lui manque donc 1
électron. Pour mettre ceci en évidence,
-
On lui attribue une
charge formelle positive, figurée par le signe
![]() .
.
-
L’ion
ammonium NH4+
|
L’ion ammonium
NH4+ |
Atome
d’hydrogène |
Atome
d’azote |
Schéma de
Lewis de
l’ion ammonium
NH4+ |
|
Schéma
de Lewis |
|
|
|
|
L’atome
d’azote
perd
1 électron |
|
|
|
-
Remarque :
-
L’atome
d’azote possède 5 électrons sur sa couche
électronique de valence (2s22p3).
-
Dans
l’ion ammonium, l’atome d’azote possède
4 électrons
(en propre).
-
Il lui manque donc 1
électron. Pour mettre ceci en évidence,
-
On lui attribue une
charge formelle positive, figurée par le signe
![]() .
.
-
Une lacune
électronique indique un déficit de deux électrons par rapport à la règle de
stabilité.
-
Cette lacune
électronique est représentée par une case rectangulaire (![]() ) dans le schéma de
Lewis.
) dans le schéma de
Lewis.
-
Exemple :
-
Étude
de la molécule de borane de formule brute
BH3.
-
L’atome
de bore Z = 5
-
Donner la
configuration électronique du bore. En déduire sa couche de valence.
-
Donner le schéma de
Lewis de l’atome de bore et de l’atome d’hydrogène.
-
Proposer un schéma de
Lewis pour cette molécule. Quelle remarque peut-on faire ?
-
Configuration
électronique du bore :
-
1s2
2s2
2p1
-
Couche de valence :
2s2
2p1
-
Schéma de Lewis de
l’atome de bore : ![]()
-
Schéma de Lewis de
l’atome d’hydrogène : ![]()
-
Schéma de Lewis de la
molécule de borane BH3 :
 ; puis
; puis
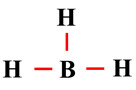
-
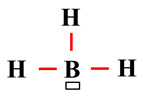
On remarque qu’il
manque un doublet d’électrons à l’atome de bore pour s’entourer de huit
électrons (règle de stabilité : règle de l’octet).
-
Il porte donc une
lacune électronique :
-
On ajoute une case
rectangulaire autour de l’atome de bore pour signaler la présence de cette lacune
électronique.
II-
La géométrie des édifices atomiques.
|
Nom |
Formule
brute |
Nombre de
doublets |
Représentation
de Lewis |
Caractéristiques
géométriques |
Représentation
plane |
|
Eau |
H2O |
2 doublets
liants
Et
2 doublets
non liants |
Ou
|
Molécule coudée
dH – O
≈ 96 pm
α
≈ 105 ° |
|
|
Ammoniac |
NH3 |
3 doublets
liants
Et
1 doublet
non liant |
|
Molécule
pyramidale
à base
triangulaire
dH – N
≈ 101 pm
α
≈ 107 ° |
|
|
Méthane |
CH4 |
4 doublets
liants |
|
Molécule
tétragonale
dC – H
≈ 109 pm
α
≈ 109 ° |
|
2)- Insuffisance du modèle de Lewis.
- La formule de Lewis ne
rend pas compte de la géométrie des molécules et du caractère dirigé des
liaisons covalentes.
-
La théorie de Lewis ne
fournit pas de renseignement sur la structure spatiale de la molécule.
-
La géométrie d’une
molécule a une influence majeure sur sa réactivité.
- Pour déterminer la géométrie d’une molécule, il faut utiliser la Méthode VSEPR.
-
C’est une
méthode assez récente (1960) que l’on doit à Ronald J. GILLEPSIE (chimiste
britannique)
-
Le sigle est
l’abréviation de VALENCE SHELL ELECTRON PAIR REPULSION
-
C’est-à-dire
répulsion des paires d’électrons de la couche de valence.
-
La méthode VSEPR
permet, après analyse du schéma de Lewis, de prévoir la géométrie des molécules
ou ions simples.
3)- Géométrie d’une molécule et d’un ion polyatomique.
|
- La structure spatiale d’une molécule ou d’un ion monoatomique correspond à celle dans laquelle les doublets d’électrons externes, liants et non liants, de chaque atome,
s’écartent
au maximum les uns des autres afin de minimiser au maximum leurs répulsions. |
-
Cas de quatre
doublets :
-
Pour minimiser leurs
répulsions mutuelles, quatre doublets adoptent une disposition tétraédrique.
-
Pour les molécules
d’eau, d’ammoniac et de méthane la répulsion des doublets impose une disposition
tétraédrique pour quatre doublets se repoussant dans la molécule.
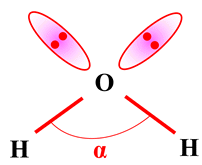 α
≈ 105 °
α
≈ 105 °
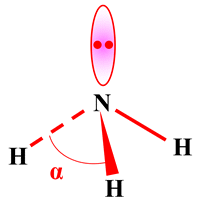 α
≈ 107 °
α
≈ 107 °
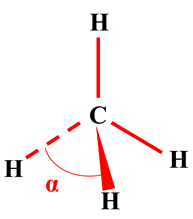 α
≈ 109 °
α
≈ 109 °
-
Les différences
proviennent du fait que la répulsion des doublets non liants est plus importante
que la répulsion des doublets liants.
-
Tableau
récapitulatif :
|
Nombre de liaisons (simples
ou
doubles)
+ nombre de
doublets
non
liants |
Répartition des doublets autour de
l’atome A |
Géométrie de
la molécule
autour
de l’atome
central A |
|
4 |
|
Premier cas : A
est lié à 4 atomes :
Molécule
tétraédrique
Exemple : le méthane :
CH4
α
≈ 109 ° Deuxième cas : A est lié à 3 atomes
et
possède 1 doublet non
liant : Molécule pyramidale à base triangulaire
Exemple :
l’ammoniac :
NH3
α
≈ 107 ° Troisdième cas : A est lié à 2 atomes
et possède 2 doublets non
liants :
Molécule coudée Exemple : La
molécule d’eau
α
≈ 105 ° |
|
3 |
|
Premier cas : A
est lié à 3 atomes :
Molécule
triangulaire Exemple :
la molécule de
méthanal CH2O
α
≈ 120 ° Deuxième cas : A est lié à 2 atomes
et possède 1
doublet non liant
Molécule coudée Exemple :
Le dioxyde de
soufre : SO2
α
≈ 120 ° |
|
2 |
|
A
est lié à 2 atomes : Molécule
linéaire Exemple : le
dioxyde de carbone CO2
α
≈ 180 ° |
-
Remarque :
-
Le dioxyde de soufre :
SO2
-
Schéma de Lewis :
-
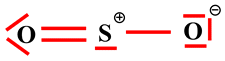
-
On peut proposer le
schéma de Lewis suivant :
-
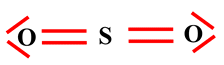
-
Il respecte les règles
de stabilité (règle de l’octet)
-
Mais ce schéma de
Lewis n’explique pas le fait que la molécule de dioxyde de soufre soit coudée.
III-
Les molécules polaires et apolaires.
-
L’électronégativité
χ d’un élément traduit la tendance d’un atome de cet élément à attirer le doublet
d’électrons d’une liaison covalente qu’il forme avec un autre atome.
-
Plus un élément est
électronégatif, plus il attire à lui le doublet d’électrons de la liaison
covalente.
-
L’électronégativité
varie selon la place de l’élément dans la classification périodique, ceci à
l’exception des gaz nobles.
-
Cette propriété est
liée à la règle du duet
et de l’octet.
-
Sur une même ligne, l’électronégativité
augmente de gauche à droite.
-
Dans une même colonne,
elle augmente de bas en haut.
-
Classification
périodique réduite :
- Les alcalins ont tendance à perdre des électrons, alors que les halogènes ont tendance à gagner des électrons.
- Ainsi, ils peuvent acquérir la structure des gaz nobles.
2)- Polarité d’une liaison covalente et moment
dipolaire.
►
Exemple : La molécule
de chlorure d’hydrogène.
-
Le chlorure
d’hydrogène est constitué de molécules HCℓ
dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore par une liaison
covalente.
|
Représentation
de Lewis |
Caractéristiques
géométriques |
|
|
|
|
dH – Cℓ
≈
127 pm |
-
Le chlore est beaucoup
plus électronégatif
que l’hydrogène.
-
Il attire vers lui le
doublet de liaison : on dit que la liaison H –
Cℓ est polarisée.
-
Cette polarisation
fait apparaître :
-
Un excédent de charge
négative, noté –
q,
sur l’atome de chlore (q
représente une charge partielle).
-
Un excédent de charge
positive, noté +
q,
sur l’atome d’hydrogène.
-
La molécule de
chlorure d’hydrogène a un caractère dipolaire : elle constitue un dipôle
électrique.
-
Elle peut être
représentée par un dipôle portant les charges
– q et
+
q
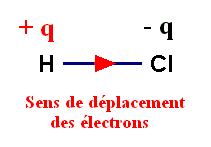
-
En conclusion :
-
Une
liaison covalente entre deux atomes
A
et B est polarisée si ces deux
atomes ont des électronégativités différentes.
- L’électronégativité χ d’un atome traduit sa capacité à attirer le doublet d’électrons
d’une liaison covalente dans laquelle il est engagé.
- Une liaison A – B est
polarisée si χA –
χB ≥ 0,4
-
Si cette condition est vérifiée :
- Alors, il apparaît une charge partielle
négative
–
q sur
l’atome A et une charge partielle positive
+
q
sur l’atome
B.
-
Représentation :
|
– q + q |
|
|
a)-
Molécules diatomiques :
-
Une molécule, entre
deux atomes A
et B, est
polarisée si ces deux atomes ont des électronégativités différentes.
-
Plus la différence
d’électronégativité est importante et plus la liaison est polarisée
-
Une molécule
diatomique constituée de deux atomes identiques est apolaire.
-
Une molécule
diatomique constituée de deux atomes différents est généralement polaire.
b)-
Molécules polyatomiques
possédant plus de deux atomes.
►
Cas de
la molécule d’eau :
H2O
|
Représentation
de Lewis |
Caractéristiques
géométriques |
|
|
|
|
Molécule coudée
dH – O
≈
96 pm
α ≈ 105 ° |
-
L’oxygène est plus électronégatif que l’hydrogène :
χ
(O)
= 3,44 et χ (H)
= 2,2
-
Les deux liaisons
covalentes O – H
d’une molécule d’eau sont polarisées.
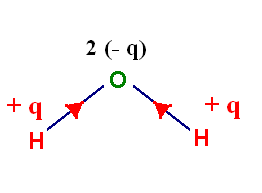
-
On note
G–,
la position moyenne des charges partielles négatives et
G+ la position moyenne des
charges partielles positives.
-
Représentation :

-
La molécule étant
coudée, les positions moyennes des charges partielles positives et négatives ne
sont pas confondues : la molécule d’eau est polaire.
►
Cas du dioxyde de
carbone :
-
La
molécule de dioxyde de carbone
CO2
est-elle polaire ou apolaire ? Justifier.
-
On donne une
indication :
-
L’atome d’oxygène est
plus électronégatif que l’atome de carbone.
|
Représentation
de Lewis |
Caractéristiques
géométriques |
|
|
|
|
molécule
linéaire
dC – O
≈ 116 pm |
-
L’oxygène est plus
électronégatif que le carbone.
-
Les deux liaisons
covalentes O = C
d’une molécule de dioxyde de carbone sont polarisées.
-
Il en résulte
l’apparition de charges partielles - q
sur chaque atome d’oxygène et d’une charge partielle
2 (+ q) sur
l’atome de carbone.
-
Mais la molécule de
dioxyde de carbone est une molécule linéaire.
-
Du fait
de la géométrie de la molécule, les positions moyennes des charges partielles
positives (G+) et négatives (G–)
sont confondues.
-
La molécule de dioxyde
de carbone est apolaire.
![]() Conclusion :
Conclusion :
-
Une molécule est
polaire si les positions moyennes des charges partielles positives et négatives
ne sont pas confondues.
-
Une molécule est
apolaire dans le cas contraire.
-
Une liaison hydrogène se forme lorsqu’un atome
d’hydrogène H, qui est lié à
un atome A très
électronégatif, interagit avec un atome B,
également très électronégatif et porteur d’un ou plusieurs doublets non liants.
-
Les atomes
A
et B qui interviennent
généralement sont : l’azote N,
l’oxygène O, le fluor
F et le chlore
Cl.
-
Les trois atomes qui participent à la liaison
hydrogène sont généralement alignés.
-
Les molécules qui possèdent le groupe
– O – H forment des liaisons
hydrogènes.
-
C’est le cas des alcools comme l’éthanol, de l’eau
dans la glace.
-
Ces liaisons hydrogènes participent à la cohésion
du cristal.
-
Dans ce cas, la cohésion du cristal est due aux
liaisons hydrogène et aux interactions de Van Der Waals.
-
Représentation de la liaison hydrogène :
►Cas de la molécule d’eau
H2O :
-
On a vu que la molécule d’eau
H2O
est une molécule coudée qui possède deux liaisons
O – H
polarisée car l’oxygène est plus électronégatif que l’hydrogène.
-
Il y la possibilité de formation de liaisons
hydrogène entre les molécules d’eau.
-
La cohésion de l’eau à l’état solide et à l’état
liquide est assurée par :
-
Des interactions de Van Der Waals
-
Et par des liaisons hydrogène.
-
Structure de la molécule d’eau à l’état solide
(glace) :
►Cas du méthane
CH4 :
-
Dans du méthane, il n’y a pas de liaisons hydrogène
car la liaison C – H est très
peu polarisée.
-
Les molécules de méthane sont des molécules
apolaires.
►Liaison hydrogène et
température de fusion et d’ébullition :
-
Température de fusion de l’eau :
Tfus
= 0,0 ° C (Passage de la glace à l’eau à l’état liquide)
- Température d’ébullition de l’eau sous la pression atmosphérique : Téb = 100 ° C
- (Passage de l’eau à l’état liquide à la vapeur d’eau).
- On précise la valeur de la pression car la température de
fusion dépend de la pression.
-
Température de fusion du méthane :
Tfus
= – 184 ° C
-
Température d’ébullition du méthane sous la
pression atmosphérique : Téb
= – 164 ° C
►Conclusion :
-
Dans l’eau, les liaisons hydrogène entre les
molécules d’eau augmente la cohésion des états solide et liquide.
-
Ce qui n’est pas le cas dans du méthane.
-
Ceci explique que les températures de changement
d’état soient plus élevées pour l’eau que pour le méthane.
-
Ceci est vrai pour toutes les molécules qui forment
des liaisons hydrogène.
QCM réalisé avec le logiciel Questy
pour s'auto-évaluer
Configuration électronique et schéma de
Lewis.
La formation d’une molécule ou d’un ion.
La géométrie des édifices chimiques.
Les molécules polaires et apolaires
|
1)-
Exercice 4 page 92 :
Déterminer un nombre d’électrons de valence. 2)-
Exercice 6 page 92 : Établir
le schéma de Lewis d’un atome. 3)-
Exercice 8 page 92 :Attribuer
à un atome son schéma de Lewis. 4)-
Exercice 8 page 92 : Établir
le schéma de Lewis d’une molécule. 5)-
Exercice 10 page
92 :Justifier la charge d’un ion. 6)-
Exercice 12 page 93 :
Représenter une lacune électronique. 7)-
Exercice 13 page 93 :
Justifier la présence d’une lacune électronique. 8)-
Exercice 14 page 93 :Proposer
le schéma de Lewis d’un ion. 9)-
Exercice 16 page 93 : Nommer
une figure géométrique. 10)-
Exercice 18 page 93 :
Justifier la géométrie d’une molécule. 11)-
Exercice 20 page 93 :Prévoir
la polarité d’une molécule. 12)-
Exercice 25 page 94 : Un
précurseur du nylon. 13)-
Exercice 27 page 95 : Un
agent de blanchiment. 14)-
Exercice 30 page 95 : Polaire
ou apolaire ? 15)- DS page 97 : Acide et base de Lewis : Une solution aqueuse : Des températures d’ébullition différentes.
|
|
|