|
De la structure à la polarité des espèces chimiques |
|
|
|
|
|
|
QCM N° 05
Configuration
électronique et schéma de Lewis.
La formation
d’une molécule ou d’un ion.
La géométrie
des édifices chimiques.
Les molécules
polaires et apolaires
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Un atome de
sodium
possède 11
électrons.
Sa
configuration
électronique
est : |
1s2
2s2 2p6 3s1 |
1s2
2s2 3s2 2p3 3p2 |
1s2
2s2 2p6 3p1 |
A |
|
2 |
Un atome de
configuration
électronique
1s2 2s2 2p2
possède : |
2 électrons
de valence |
4 électrons
de valence |
6 électrons de
valence |
B |
|
3 |
Le schéma de
Lewis du
dioxyde de
carbone est :
|
Chaque atome
de carbone
est entouré de
4 doublets
d’électrons |
Seul l’atome
de carbone
est entouré de
4 doublets
d’électrons |
Chaque atome
d’oxygène
possède
2 doublets
non liants |
AC |
|
4 |
Le schéma de
Lewis de
la molécule de
peroxyde
d’hydrogène
H2O2
peut être :
|
|
|
|
A |
|
5 |
Dans le schéma
de Lewis d’un atome , le point (●)représente
un électron :
|
De la couche
interne |
De la couche
de valence |
Susceptible
de former
une liaison
covalente |
BC |
|
6 |
L’atome
d’azote dont
le schéma de
Lewis est
donné
ci-dessous :
|
Peut s’entourer
de
3 atomes |
Peut s’entourer
de
2 atomes |
Peut former
3 liaisons
covalentes |
ABC |
|
7 |
Dans la molécule de dichlore, dont le schéma de Lewis est donné ci-dessous, un atome
de chlore est
entouré de :
|
4 électrons. |
7 électrons. |
8 électrons. |
C |
|
8 |
La molécule de disulfure de dihydrogène H2S2 est formée d’atomes, dont les schémas de Lewis sont
donnés
ci-dessous :
Le schéma de
la Lewis de
la molécule
est : |
|
|
|
B |
|
9 |
L’ion chlorure, dont le schéma de Lewis est donné,
ci-dessous,
est entouré de :
|
8 électrons. |
9 électrons. |
10 électrons. |
A |
|
10 |
Dans l’ion
hydroxyde, dont le schéma de Lewis est
donné
ci-dessous :
|
L’atome
d’hydrogène
est entouré de
2 électrons. |
L’atome
d’oxygène
est entouré de
8 électrons. |
L’atome
d’oxygène
est entouré de
9 électrons. |
AB |
|
11 |
La géométrie
de la molécule
de phosgène
dont le modèle
est représenté
ci-dessous,
est :
|
Pyramidale. |
Triangulaire. |
Tétraédrique. |
B |
|
12 |
La géométrie de
l’ion ammonium
NH4+ dont le schéma de Lewis est donné,
ci-dessous,
est :
|
Pyramidale. |
Triangulaire. |
Tétraédrique. |
C |
|
13 |
La géométrie de
l’ion ammonium
NH4+
est due à : |
La répulsion
entre les
doublets |
La répulsion
entre les
atomes |
La présence
de la charge
positive |
A |
|
14 |
L’électronégativité d’un atome traduit son
aptitude à :
|
Former une
liaison avec
un autre atome |
Attirer le
doublet qui
le lie avec un
autre atome |
Obtenir une
configuration
électronique
identique à
celle
d’un gaz noble |
B |
|
15 |
Les atomes de chlore Cℓ et d’hydrogène H ont pour électronégativité
respectives
3,2 et 2,2. |
La liaison
H – Cℓ
est polarisée |
La molécule
de chlorure
d’hydrogène
HCℓ
est
apolaire
|
Le doublet
d’électrons
est plus
proche
de l’atome
d’hydrogène H
que de l’atome
de chlore
Cℓ. |
A |
QCM réalisé avec le logiciel Questy:
Pour s’auto-évaluer
Configuration électronique :
Couche électronique de valence.
Schéma de Lewis d’une molécule.
Schéma de Lewis d’un ion polyatomique :
|
Ion
polyatomique |
Schéma
de
Lewis |
|
L’ion
hydroxyde HO– |
|
|
L’ion oxonium
H3O+ |
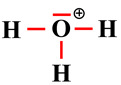 |
|
L’ion ammonium NH4+ |
|
Lacune électronique :
 )
dans le schéma de Lewis.
)
dans le schéma de Lewis.
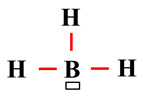
La géométrie des édifices atomiques :
|
Nombre de
liaisons (simples
ou
doubles)
+ nombre de
doublets
non
liants |
Répartition
des
doublets autour de
l’atome A |
Géométrie de
la molécule
autour
de l’atome
central A |
|
4 |
|
Premier cas : A
est lié à 4 atomes :
Molécule
tétraédrique
Exemple : le méthane :
CH4
α
≈ 109 ° Deuxième cas : A est lié à 3 atomes
et possède 1 doublet non
liant : Molécule pyramidale à base triangulaire Exemple : l’ammoniac : NH3
α
≈ 107 ° Troisième cas : A est lié à 2 atomes
et possède 2 doublets non
liants :
Molécule coudée Exemple :
La
molécule d’eau
α
≈ 105 ° |
|
3 |
|
Premier cas : A
est lié à 3 atomes :
Molécule
triangulaire Exemple :
la molécule de
méthanal CH2O
α
≈ 120 ° Deuxième cas : A est lié à 2 atomes
et possède 1
doublet non liant
Molécule coudée Exemple :
Le dioxyde de
soufre : SO2
α
≈ 120 ° |
|
2 |
|
A
est lié à 2 atomes :
Molécule
linéaire Exemple : le
dioxyde de carbone CO2
α
≈ 180 ° |
Les molécules polaires et apolaires :
Électronégativité.
Polarité d’une liaison covalente :
Exemples :
|
La molécule d’eau
H2O
La molécule étant coudée,
les position moyennes
des charges
partielles positives
et négatives
ne sont pas confondues :
la molécule
d’eau est polaire |
|
Molécule de dioxyde de carbone
CO2
|
|
Du fait de la
géométrie de la molécule,
les positions
moyennes des charges
partielles
positives (G+) et négatives (G–)
sont
confondues. La molécule de
dioxyde de
carbone est apolaire |
|
|