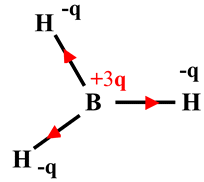
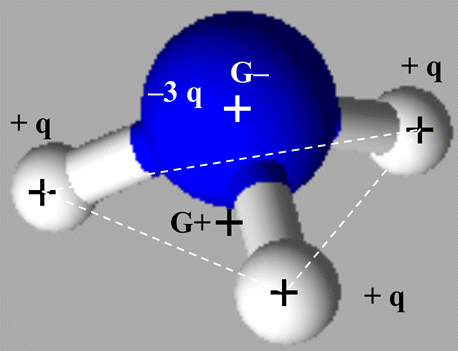
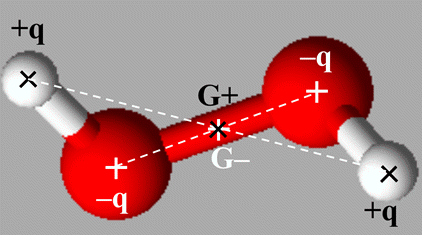
|
|
De la structure à la polarité d'une espèce chimique. Exercices |
|
|
|
|
1)- Exercice 4 page 92 : Déterminer un nombre d’électrons de valence :
|
Déterminer un nombre d’électrons de valence : On considère les éléments des colonnes 1,2,13
et 17 du tableau périodique des éléments. |
|
Déterminer un nombre d’électrons de valence :
- Couche
électronique de valence.
-
Pour Z ≤ 18, les électrons de
valence sont ceux qui occupent la couche électronique de nombre n le plus
élevé.
-
Cette dernière est appelée couche
électronique de valence, sa configuration électronique se nomme configuration
électronique de valence. Nombre d’électrons de valence des éléments des colonnes
1,2,13 et 17. Colonne 1 :
1 électron de valence Colonne 2 :
2 électrons de valence Colonne 13 :
3 électrons de valence Colonne 17 :
7 électrons de valence -
Tableau périodique des éléments des 3 premières
périodes (simplifié) : -
Configuration électronique de valence : -
Elle permet de déterminer le nombre d’électrons de
valence.
|
2)- Exercice 6 page 92 : Établir le schéma de Lewis d’un atome :
|
Établir le schéma de Lewis d’un atome : On considère les éléments de la deuxième ligne du tableau
périodique. 1.
Repérer ces éléments dans le tableau
périodique et déterminer le nombre d’électrons de valence
des atomes correspondants. 2.
Établir le schéma de Lewis de chacun des
atomes de ces éléments. |
|
Établir le schéma de Lewis d’un atome :
2.
Schéma de Lewis des atomes de la deuxième ligne.
-
Jusqu’à 4 électrons de valence,
l’atome est entouré d’électrons célibataires ;
-
Au-delà, les électrons
supplémentaires s’ajoutent aux électrons célibataires pour former
des doublets.
|
3)- Exercice 7 page 92 :Attribuer à un atome son schéma de Lewis :
|
Attribuer à un atome son schéma de Lewis : Choisir, parmi les représentations
suivantes, le schéma de Lewis de l’atome de soufre S (1s2
2s2 2p6
3s2 3p4). a. b.
c.
|
Attribuer à un atome son schéma de Lewis :
-
Donnée :
-
On connaît la configuration
électronique de l’atome de soufre !
-
(1s2
2s2 2p6
3s2 3p4)
-
Schéma de Lewis d’un atome :
-
Chaque atome est scindé formellement
en deux :
-
Le noyau et les électrons des couches
internes sont représentés par le symbole de l’élément chimique.
-
Les électrons de valence sont
représentés par
-
des points (●)
s’ils sont célibataires
-
ou par un tiret
(–)
s’ils forment un doublet.
-
À partir de la structure électronique
de valence, on peut connaître le nombre d’électrons de la couche de
valence.
-
Dans le cas du soufre :
-
La couche électronique de valence est
la suivante :
-
3s2
3p4
-
L’atome de soufre possède
6 électrons de valence.
-
Il faut répartir 6 électrons autour
du symbole de l’atome de soufre.
-
D’autre part :
-
Jusqu’à 4 électrons de valence,
l’atome est entouré d’électrons célibataires ;
-
Au-delà, les électrons
supplémentaires s’ajoutent aux électrons célibataires pour former
des doublets.
-
L’atome de soufre est entouré de
2 doublets d’électrons non liants et de 2
électrons célibataires :
-
![]() réponse b.
réponse b.![]()
4)- Exercice 8 page 92 : Établir le schéma de Lewis d’une molécule :
|
Établir le schéma de Lewis d’une molécule : On considère les éléments suivants appartenant à la 17e colonne du tableau périodique ; F , Cℓ et Br
-
Construire les schémas de Lewis des
molécules que chacun de ces
atomes peut former avec un atome d’hydrogène H (1s). |
Établir le schéma de Lewis d’une molécule :
-
Les éléments dont les atomes sont
disposés dans une même colonne,
constituent une famille
et ont le
même nombre d’électrons sur la couche électronique externe.
18
17
He
1s2
F
…2s22p5
Ne
…2s22p6
Cl
…3s23p5
Ar
…3s23p6
Br
…4s24p5
Kr
…4s24p6
-
C’est la famille des halogènes.
-
Ils possèdent 7 électrons sur leur
couche électronique de valence.
-
Chaque atome est entouré de 3
doublets d’électrons non liants et de 1 électron célibataire :
-
Schéma de Lewis de chaque atome :
-
-
Un atome forme autant de liaisons
qu’il a d’électrons célibataires.
-
Chaque atome peut donc former une
liaison covalente.
-
Schéma de Lewis de l’atome
d’hydrogène :
-
Schéma de Lewis des différentes
molécules formées :
-
Molécule de fluorure d’hydrogène :
-
Molécule de chlorure d’hydrogène :
-
Molécule de bromure d’hydrogène :
![]() ;
; ![]() et
et
![]() .
.![]()
![]()
![]()
![]()
![]()
5)- Exercice 10 page 92 : Justifier la charge d’un ion :
|
Justifier la charge d’un ion : Les éléments oxygène O (Z = 8) et chlore Cℓ
(Z = 17) appartiennent à la 16e
et la 17e colonne
du tableau périodique.
-
À partir de leurs schémas de Lewis,
justifier les charges portées par l’ion oxyde
a.
et l’ion chlorure b.. a.
b.
|
|
Justifier la charge d’un ion :
-
Structure électronique de l’oxygène
Z = 8 :
-
1s2
2s2 2p4
-
Structure électronique externe :
-
2s2
2p4
-
Il possède
6 électrons de valence (16e
colonne) :
-
Schéma de Lewis de l’atome
d’oxygène :
-
-
Schéma de Lewis de l’ion oxyde :
-
-
L’ion oxyde provient d’un atome
d’oxygène ayant gagné 2 électrons.
-
Il acquiert ainsi la structure en
Octet.
-
Il possède une stabilité analogue au
néon
-
Structure électronique de de chlore Z
= 17: - 1s2 2s2 2p6 3s2 3p5
-
Structure électronique externe :
-
3s2
3p5
-
Il possède
7 électrons de valence (17e
colonne) :
-
Schéma de Lewis de l’atome de
chlore :
-
-
Schéma de Lewis de l’ion chlorure :
-
-
L’ion chlorure provient d’un atome de
chlore ayant gagné 1 électron.
-
Il acquiert ainsi la structure en
Octet.
-
Il possède une stabilité analogue à
celle de l’argon
|
6)- Exercice 12 page 93 : Représenter une lacune électronique :
|
Représenter une lacune électronique :
-
À partir de la configuration
électronique de l’atome d’hydrogène H (1s1), déterminer le schéma de Lewis de l’ion hydrogène H+. |
|
Représenter une lacune électronique :
-
Schéma de Lewis de l’ion hydrogène
H+.
-
L’ion hydrogène provient d’un atome
d’hydrogène ayant perdu 1 électron.
-
Schéma de Lewis de l’atome
d’hydrogène :
-
L’atome d’hydrogène possède 1
électron de valence :
-
- L’atome d’hydrogène tend à acquérir la même configuration électronique du gaz noble qui le suit,
dans le cas présent l’hélium
He (règle de stabilité :
règle du Duet).
-
-
La perte de cet électron entraine
l’apparition d’une lacune électronique :
-
Une lacune électronique indique un
déficit de deux électrons
par rapport à la règle de stabilité.
-
Cette lacune électronique est représentée par une case
rectangulaire (
- |
7)- Exercice 13 page 93 : Justifier la présence d’une lacune électronique :
|
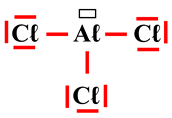
Justifier la présence d’une lacune
électronique : Justifier la présence de la lacune électronique
dans le schéma de Lewis de la molécule de chlorure d’aluminium.
|
|
Justifier la présence d’une lacune électronique :
-
La molécule de chlorure d’aluminium :
AℓCℓ3
-
Schéma de Lewis :
-
On remarque qu’il manque un
doublet d’électrons à l’atome d'aluminium pour s’entourer de huit électrons (règle de stabilité : règle de
l’octet).
-
Il lui manque 2 électrons pour
obtenir la même configuration électronique que le gaz rare le plus proche, l’argon
Ar :
-
Il porte donc une lacune
électronique :
-
On ajoute une case rectangulaire
autour de l’atome d'aluminium pour signaler la présence de cette lacune électronique. |
8)- Exercice 14 page 93 :Proposer le schéma de Lewis d’un ion :
|
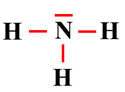
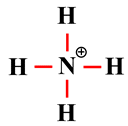
Proposer le schéma de Lewis d’un ion : Le schéma de Lewis de l’ion ammonium est proposé ci-dessous.
1.
Rechercher la place des éléments azote N
et phosphore P dans le tableau périodique. 2.
Proposer le schéma de Lewis de l’ion
phosphonium PH4+ et justifier la charge portée par
l’atome de phosphore. |
Proposer le schéma de Lewis d’un ion : Schéma de Lewis de l’ion ammonium NH4+ : 1.
Place des éléments azote N et
phosphore P dans le tableau périodique.
-
L’élément azote
N appartient à la 2e période et à la 15e
colonne
-
L’élément phosphore
P appartient à la 3e période et à la 15e
colonne.
-
En conséquence, les deux éléments
azote N et phosphore
P appartiennent à la même colonne.
-
Ils ont le même nombre d’électrons
sur la couche électronique externe :
-
Soit 5 électrons de valence.
-
Schéma de Lewis de l’atome d’azote :
-
Schéma de Lewis de l’atome de
phosphore : 2.
Schéma de Lewis de l’ion phosphonium PH4+. L’ion
phosphonium
PH4+
Atome
d’hydrogène
Atome
de
phosphore
Schéma de
Lewis
de l’ion
phosphonium
PH4+
Schéma
de
Lewis
L’atome
de
phosphore
perd
1
électron
-
Charge portée par l’atome de
phosphore :
-
L’atome de phosphore possède
5 électrons sur sa couche
électronique de valence (3s2
3p3).
-
Dans l’ion phosphonium
PH4+, l’atome de phosphore possède
4 électrons (en propre).
-
Il lui manque donc 1 électron. Pour
mettre ceci en évidence,
-
On lui attribue une charge formelle
positive, figurée par le signe
-
L’atome de phosphore est lié à 4
atomes d’hydrogène.
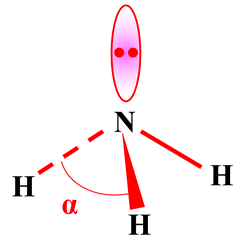
-
La molécule a une structure
tétraédrique : α ≈ 109 °
![]()
![]()
![]()
![]()


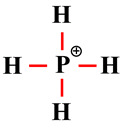
 .
.
![]()
9)- Exercice 16 page 93 : Nommer une figure géométrique :
|
Nommer une figure géométrique : Nommer la géométrie de la molécule de
chlorosilane : SiH3Cℓ.
|
Molécule de chlorosilane SiH3Cℓ.
L’atome de silicium Si est entouré de
4 atomes : On est en présence d’une Molécule tétraédrique Représentation plane Schéma de Lewis de la molécule : Représentation spatiale :




![]()
10)- Exercice 18 page 93 : Justifier la géométrie d’une molécule :
|
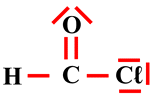
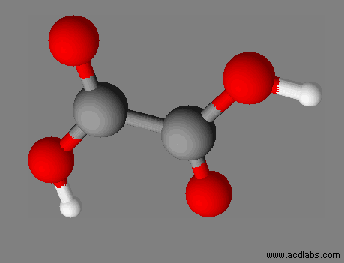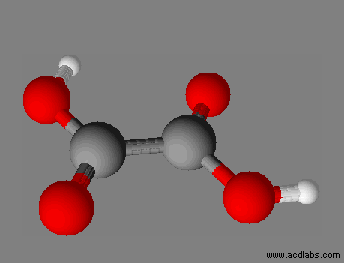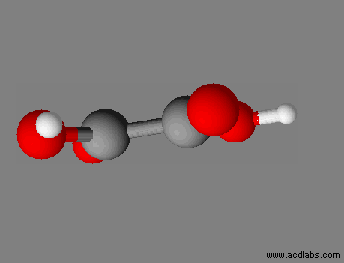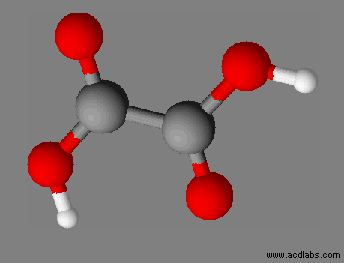
Justifier la géométrie d’une molécule : Les schémas de Lewis des molécules de sulfure d’hydrogène et de chlorure de méthanoyle sont donnés ci-après. Prévoir la géométrie des molécules de sulfure d’hydrogène et de chlorure de méthanoyle.
-
Sulfure d’hydrogène :
-
-
Chlorure de méthanoyle :
-
|
|
Justifier la géométrie d’une molécule :
-
Géométrie de la molécule de sulfure
d’hydrogène :
-
On connait de schéma de Lewis de
cette molécule :
-
-
L’atome de soufre
S est lié à 2 atomes
-
Et possède 2 doublets non liants.
-
On est en présence d’une
molécule coudée :
α ≈ 105 °
-
Représentation 3D :
-
Géométrie de la molécule de chlorure
de méthanoyle :
-
On connait le schéma de Lewis de
cette molécule :
-
-
L’atome de carbone
C est lié à 3 atomes
-
On est en présence d’une molécule
triangulaire plane.
-
Représentation 3 D :
|