|
Chim. N° 10 |
Estérification et hydrolyse : Exercices. Correction. |
|
|
|
|
Programme 2012 : Transformations en chimie organique : aspect macroscopique. Transformations en chimie organique : aspect microscopique. Programme 2012 : Physique et Chimie Programme 2020 : Physique et Chimie |
Pour aller plus loin :
|
Mots clés : Esters, estérification, Hydrolyse, évolution de l'équilibre , équilibre d'estérification et d'hydrolyse ; ... |
I-
Devoir.![]()
a)- Proportions d’acide et d’alcool.
- Quantité de matière d’acide éthanoïque :
|
n1 = |
m 1 |
||
|
|
|
|
|
|
M 1 |
|||
|
|
16 |
||
|
n1 = |
|
||
|
|
60 |
||
|
|
|||
|
n1 ≈ |
0,27 mol |
||
- Quantité de matière de 3–méthylbutan–1–ol :
|
n2 = |
m 2 |
||
|
|
|
|
|
|
M 2 |
|||
|
|
8,0 |
||
|
n2 = |
|
||
|
|
88 |
||
|
|
|||
|
n2 ≈ |
9,1 x 10 - 2 mol |
||
- équation de la réaction :
|
RCOOH |
+ |
R'OH |
= |
RCOOR' |
+ |
H2O |
|
Acide carboxylique |
|
Alcool |
|
Ester |
|
Eau |
- Les proportions ne sont pas stœchiométriques, il y a un excès d’acide éthanoïque.
b)- Rendement de la réaction.
- L’acide éthanoïque étant en excès, le rendement de la réaction se calcule par rapport au réactif limitant.
|
τ = |
Quantité de produit formé |
||
|
|
|
|
|
|
Quantité de produit obtenu pour une réaction totale |
- Masse molaire de l’ester ( éthanoate de 3 – méthylbutyle) : ME = 130 g / mol
- Quantité de matière d’ester formé en fin de réaction.
|
nEf = |
mEf |
||
|
|
|
|
|
|
ME |
|||
|
|
7,0 |
||
|
nEf = |
|
||
|
|
130,0 |
||
|
|
|||
|
nEf ≈ |
5,4 x 10 - 2 mol |
||
- Rendement de la réaction :
|
τ = |
nEf |
||
|
|
|
|
|
|
n2 |
|||
|
|
5,4 x 10 - 2 |
||
|
τ = |
|
||
|
|
9,1 x 10 - 2 |
||
|
|
|||
|
τ ≈ |
59 % |
||
- Le rendement est proche de 60 %.
- Remarque : Lorsqu’on fait réagir l’acide carboxylique et l’alcool dans les proportions stœchiométriques, le rendement est de la réaction est voisin de 67 % car on utilise un alcool primaire.
- Le fait d’utiliser un excès d’acide permet de déplacer l’équilibre dans le sens de l’estérification.
- On devrait obtenir un rendement supérieur à 67 % dans les conditions de l’exercice.
- L’énoncé indique que l’on recueille 7 g d’ester : soit, on a perdu de l’ester, soit au bout d’une heure la réaction n’est pas terminée et l’équilibre chimique n’est pas atteint.
c)- L’acide sulfurique ne permet pas d’augmenter le rendement de la réaction. Il catalyse aussi bien la réaction d’estérification que la réaction d’hydrolyse. Il permet d’accélérer la réaction mais ne déplace pas l’équilibre.
d)- L’ester obtenu est l’éthanoate de 3 – méthylbutyle.
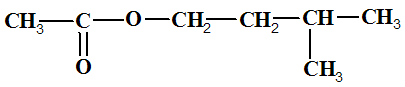
e)- La pierre ponce permet de réguler l’ébullition.
1)- Formule générale de l’acide carboxylique en fonction de n : CnH 2n+1COOH ou Cn+1H2n+2O 2
2)-
a)- Formule semi-développée de l’alcool B, C2H6O : CH3 ― CH2 ― OH
b)-
Formule semi-développée de l’ester :
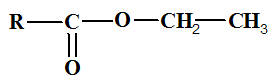
- Formule brute : Cn+3H2n+6O2
- À partir de la connaissance de la valeur de la masse molaire, on peut en déduire la valeur de n.
- 12 n + 36 +2 n + 6 + 32 = 102
- 14 n = 28
- n = 2
- L’acide carboxylique est l’acide propanoïque : CH3 ― CH2 ― COOH
-
L’ester obtenu est le propanoate d’éthyle :
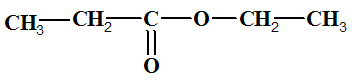
1)- Acide et alcool.
|
Acide éthanoïque |
Alcool isoamylique ou 3–méthylbutan–1–ol |
|
CH3 ― COOH |
|
2)- Réaction d’estérification.
- C’est une réaction limitée, lente et athermique.
3)- Volume d’acide nécessaire.
- Quantité de matière d’alcool utilisé.
|
n1 = |
m1 |
|
m1. V1 |
|
|
= |
|
|
|
V |
|
V |
- Comme : n1 = n2,
- 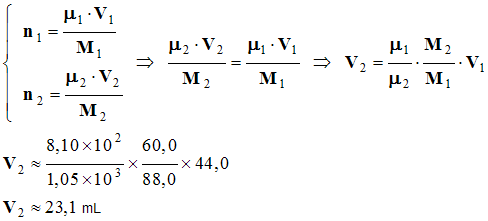
4)- La pierre ponce permet de réguler l’ébullition.
5)-
a)- L’acide sulfurique catalyse aussi bien la réaction d’estérification que la réaction d’hydrolyse.
Il permet d’accélérer la réaction mais il ne déplace pas l’équilibre.
b)- On chauffe le mélange car la température est un facteur cinétique.
Une élévation de la température permet d’accélérer la réaction, d’augmenter la vitesse de réaction.
c)- Le réfrigérant à boules permet la condensation des réactifs et des produits et évite ainsi les pertes.
Seconde étape :
1)- Schéma de l’ampoule à décanter :
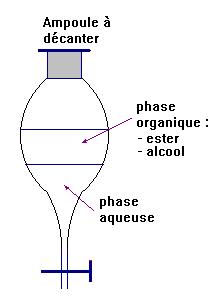
2)- Matériel utilisé.
|
C |
D |
E |
F |
G |
|
Chauffe-ballon |
Ballon |
Colonne
de Vigreux |
Réfrigérant |
Bécher
(filtrat) |
3)- Lors d’une distillation, on recueille en premier le constituant du mélange le plus volatil.
- Première phase : lorsque le thermomètre affiche la température θ = 128 ° C, la distillation de l’alcool commence.
- La température se stabilise sur cette valeur tant qu’il reste de l’alcool.
- Deuxième phase : lorsque la distillation de l’alcool est terminée, la température augmente et se stabilise sur θ = 148 ° C.
- On distille alors l’ester.
- Il faut surveiller la température pour pouvoir repérer les deux phases et séparer ainsi l’alcool et l’ester.
4)-
a)- Masse d’ester obtenu si la réaction est totale.
- Au départ, les réactifs ont été mélangés dans les proportions stœchiométriques. Le mélange est équimolaire.
- Quantité de matière d’alcool utilisé.
|
n1 = |
μ1. V1 | ||
|
|
|||
| V | |||
|
|
0,810 x 44,0 | ||
|
n1 = |
|
||
|
|
88 | ||
|
|
|||
|
n1 » |
0,405 mol |
||
- Si la réaction est totale,
- n Emax = n 1 ≈ 0,405 mol
- Masse d’ester obtenu.
- m Emax = n Emax . M E
- m Emax = 0,405 x 130
- m Emax ≈ 52,7 g
b)- rendement de la réaction.
|
τ = |
mE | |||
|
|
||||
| mEmax | ||||
|
|
26,3 | |||
|
τ = |
|
|||
|
|
52,7 | |||
|
|
||||
|
τ ≈ |
50 % |
|||
c)- le mélange étant équimolaire et l’alcool primaire, on peut obtenir un rendement de 67 %.
- La limite n’est pas atteinte.