Règles de nomenclature de l'U.I.C.P.A.
(union Internationale de Chimie Pure et Appliquée).
|
|
Les ressources |
|
I -Nomenclature des Alcanes à chaîne linéaire.
|
Les quatre premiers alcanes ont un nom consacré par
l'usage : méthane (CH4),
éthane (C2H6),
propane (C3H8),
butane (C4H10).
Pour les autres alcanes à chaîne linéaire, on utilise un préfixe grec indiquant le nombre d'atomes de carbone que l'on fait suivre du
suffixe -ane.
Le tableau ci-dessous donne
les préfixes des alcanes de n = 5 à n = 18. |
|
Nombre d'atomes de carbone : n |
Formule |
Préfixe |
Nom |
|
5 |
C5H12 |
pent- |
pentane |
|
6 |
C6H14 |
hex- |
hexane |
|
7 |
C7H16 |
hept- |
heptane |
|
8 |
C8H18 |
oct- |
octane |
|
9 |
C9H20 |
non- |
nonane |
|
10 |
C10H22 |
déc- |
décane |
|
11 |
C11H24 |
undéc- |
undécane |
|
12 |
C12H26 |
dodéc- |
dodécane |
|
13 |
C13H28 |
tridéc- |
tridécane |
|
14 |
C14H30 |
tétradéc- |
tétradécane |
|
15 |
C15H32 |
pentadéc- |
pentadécane |
|
16 |
C16H34 |
hexadéc- |
hexadécane |
|
17 |
C17H36 |
heptadéc- |
heptadécane |
|
18 |
C18H38 |
octadéc- |
octadécane |
|
Un alcane non cyclique peut s'écrire : CnH 2n + 1 ― ou R ― H.R ― est un groupement alkyle. On obtient un groupement alkyle en enlevant un atome d'hydrogène à la formule d'un alcane. Exemples : CH3
― groupe méthyle
; CH3
― CH2 ― groupe éthyle CH3
― CH2 ― CH2 ―
groupe propyle
|
III- Nomenclature des alcanes à chaîne ramifiée.
|
On obtient le nom de l'alcane de la manière suivante : - On cherche la chaîne carbonée la plus longue et le nom de l'alcane à chaîne linéaire comportant le même nombre d'atomes de
carbone. - L'alcane considéré est nommé comme un dérivé de
cet alcane linéaire. - La chaîne la plus longue s'appelle la
chaîne principale. - On identifie les groupes substituants sur cette
chaîne et leur place par
un indice de
position. - Cet indice s'obtient grâce à la numérotation des
atomes de carbone de la chaîne principale. - Deux sens de numérotation existent, pour trouver
le bon sens de numérotation : - On écrit tous les indices obtenus par ordre
croissant. - Le sens à retenir est celui pour lequel le premier chiffre différent est le plus petit ou bien on choisit celui pour lequel
la somme des indices est la plus petite.
Dans l'écriture du nom de l'alcane, on doit respecter deux règles : - Les indices de position des groupes alkyles se placent
devant le nom du groupe. - Les groupes alkyles s'écrivent avant le nom de
l'alcane. - (Deux chiffres sont séparés par une virgule et entre
un chiffre et une lettre, on place un tiret). - On fait élision du "e" du nom de l'alkyle. -
Les groupements alkyles sont placés par ordre alphabétique. - S'il existe plusieurs groupes identiques, en utilise
les préfixes : di, tri, tétra… - Les substituants halogènes se traitent comme les
groupes alkyles. |
|
- Le suffixe -ène caractérise les alcènes. - On obtient le nom d'un alcène de la manière
suivante :
- On cherche la chaîne
carbonée la plus longue contenant la double liaison.
- On compte le nombre d'atomes de carbone de cette chaîne principale et on obtient le nom de l'alcène grâce au
préfixe grec indiquant le nombre d'atomes de carbone suivi
du suffixe -ène.
- On numérote les atomes de carbone de la chaîne principale de façon à avoir les plus petits indices pour les atomes de carbone
doublement liés. - La place de la double liaison est indiquée par
son indice de position placé avant le
suffixe - ène. - C'est la place de la double liaison qui
impose le sens de numérotation. - Comme pour les alcanes, on indique les groupes substituants de la chaîne principale avec leur indice de position. |
|
Formule générale : R ― OH - On cherche la chaîne carbonée la plus longue contenant l’atome de carbone qui porte le groupe hydroxyle ― OH. - On met en place la numérotation qui donne à cet atome de carbone l’indice le plus petit. - On nomme l’alcool grâce au nom de l’alcane correspondant à cette chaîne avec élision du e final - que l’on fait suivre du
suffixe ol affecté de l’indice de position qui lui
correspond. |
|
Formule générale : R ― CHO - On cherche la chaîne carbonée la plus longue contenant le carbone fonctionnel. - On met en place la numérotation qui donne à cet atome de carbone le numéro 1. - On obtient le nom de l’aldéhyde en faisant suivre le nom de l’alcane avec élision du e, du suffixe al. |
|
Formule générale :
- On cherche la chaîne carbonée la plus longue contenant le carbone fonctionnel. - On met en place la numérotation qui donne à cet atome de carbone l’indice le plus petit. - On obtient le nom de la cétone en faisant suivre le nom de l’alcane avec élision du e, - du suffixe one affecté de l’indice de position correspondant. |
VIII- Les Acides
Carboxyliques.
Formule
générale : -
On cherche la chaîne carbonée la plus longue
contenant le carbone fonctionnel.
- On met en
place la numérotation qui donne à cet atome de
carbone le numéro
1.
- On obtient
le nom de l’acide en faisant suivre le nom de l’alcane
avec élision du
e,
du suffixe
oïque.
IX- Les
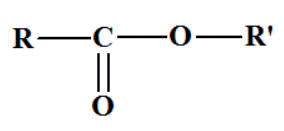
Esters.
Formule
générale :
R ― COO ―
R’ou
- On cherche le nom de
l’acide
RCOOH.
- On supprime le mot acide
et on remplace la terminaison
oïque
par la terminaison
oate
et - On ajoute
"de"
que l’on fait suivre du nom du
groupe alkyle
R' ―.
X- Les Chlorures
d’acyle.
Formule générale :
R ―
CO
― Cl ou
- Le nom du chlorure
dérive du nom de l’acide correspondant.
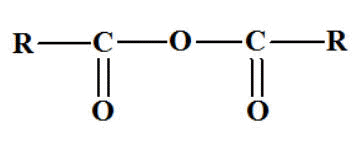
XI- Les Anhydrides
d’acide.
Formule
générale : - Un anhydride d’acide
résulte de l’élimination d’une
molécule d’eau entre
deux molécules
d’acide carboxylique.
- Son nom s’obtient en
remplaçant le mot
acide par
anhydride.
XII- Les
Amines.
Les Amines primaires. Formule
générale :
R
― NH2.
- On nomme l’amine à
partir du nom de l’alcane R
― H
correspondant, avec élision du
e,
- que l’on
fait suivre de la terminaison amine en précisant la position du groupe
― NH2
Les
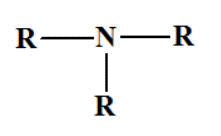
Amines secondaires et tertiaires
symétriques. Formule
générale :
R
―
NH
―R et
- On fait
suivre le nom de l’alkyle R
―,
précédé de di ou tri, de la
terminaison amine.
Les
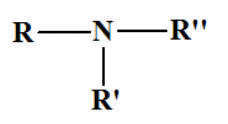
amines secondaires et tertiaires non
symétriques. Formule
générale :
R
―
NH
―R' et
- On les nomme comme des dérivés de
substitution sur l’azote de l’amine
R ― NH2
où R
― est le groupe le plus long. -
On écrit le ou les groupes substituants sur l’azote
dans l’ordre alphabétique,
précédés de la lettre
N et suivis du nom de l’amine
R ― NH2
XIII- Les
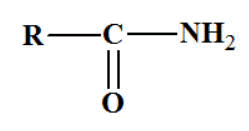
Amides.
Les amides primaires. Formule
générale :
On obtient le nom d’une
amide primaire à partir du nom de l’acide
correspondant
R ―
COOH,
en remplaçant la terminaison oïque par la
terminaison amide.
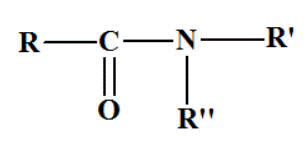
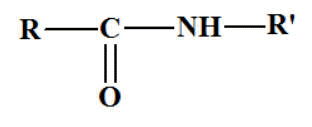
Les
amides substituées sur l'azote. Formule
générale :
- On énonce
d’abord les groupes substituants sur l’azote du
groupe
― NH2,
dans l’ordre alphabétique,
-
précédés de la lettre
N puis
du nom de l’acide correspondant R ―
COOH
dans
lequel
on remplace la terminaison
oïque
par la
terminaison amide. Les ressources
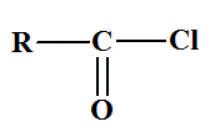
- On remplace le
mot
acide par
chlorure de et la terminaison
oïque par
oyle.
 et
et