|
Chim N° 11 :
|
|
|
|
|
1)- À
partir d’un anhydride d’acide. |
|
3)- Les
matières premières de la synthèse
industrielle de l’aspirine. |
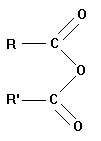
I- Anhydride d’acide et chlorure d’acyle.
a)- Formule générale :
|
Formule développée |
Groupement fonctionnel anhydride d’acide |
|
|
|
b)- nomenclature :
-
On remplace la terminaison acide par anhydride.
-
Un anhydride d’acide résulte de l’élimination d’une molécule d’eau entre
deux molécules d’acide carboxylique.
-
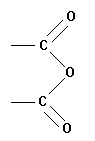
Exemples :
|
|
Anhydride éthanoïque |
-
Elle est obtenue par élimination d’une molécule d’eau entre deux
molécules d’acide éthanoïque :
|
|
Anhydride phtalique
|
c)- Préparation :
-
On utilise généralement un puissant déshydratant : le décaoxyde de
tétraphosphore P4O10.
-
On peut donner l’équation simplifiée de l’équation bilan :

a)- Formule générale:
|
|
Formule développée |
b)- Nomenclature :
-
On remplace le mot
acide
par
chlorure de et la
terminaison
oïque
par oyle.
-
Exemples :
|
Chlorure de propanoyle |
Chlorure de benzoyle |
|
|
|
c)- Préparation :
-
On part de l’acide carboxylique sur lequel on fait agir un agent
chlorurant comme le pentachlorure de phosphore
PCl5 ou
le chlorure de thionyle
SOCl2.
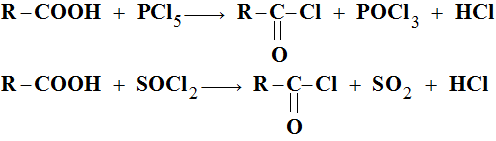
-
Leur coût de fabrication est élevé, on les utilise surtout pour quelques
synthèses pharmaceutiques.
-
Ils sont très réactifs et permettent de synthétiser des esters et des
amides.
1)-
À partir d’un anhydride d’acide.
a)- Équation bilan :
b)- Caractéristiques de la réaction :
-
La réaction se fait à température modérée (50 °C). Elle est totale et
rapide.
c)- Exercice :
-
On veut réaliser la synthèse de l’éthanoate de butyle à l’aide d’un
anhydride d’acide.
-
Quel anhydride faut-il choisir ? Quel alcool faut-il choisir ?
-
Équation bilan.
- Réponses :
- Il
faut choisir l’anhydride éthanoïque et le butanol ou butan-1-ol.
2)-
à
partir d’un chlorure d’acyle.
a)- Équation bilan :
b)- Caractéristiques de la réaction :
-
La réaction est rapide, totale, très exothermique.
-
Schéma de Lewis d’un alcool :
![]()
- L’atome d’oxygène possède 2 doublets d’électrons non liants.
- Il constitue un site riche en électrons : site nucléophile.
- C’est un
réactif nucléophile.
-
Schéma de Lewis d’un anhydride d’acide :

- Les liaisons C = et C – 0 sont polarisées car l’atome d’oxygène est plus électronégatif que l’atome de carbone.
- Les atomes de carbone du groupement fonctionnel constituent des sites appauvris en électrons : sites électrophiles.
- Ce sont des réactifs électrophiles.
- Les atomes
d’oxygène constituent des sites riches en électrons : sites
nucléophiles.

-
Schéma de Lewis d’un chlorure d’acyle :


-
L’atome de carbone constitue un site appauvri en électrons et les atomes
de chlore et d’oxygène des sites riches en électrons.
-
La réaction d’estérification résulte de l’attaque d’un réactif
électrophile (le carbone fonctionnel) par un réactif nucléophile
(l’oxygène ou le chlore).
1)- Introduction :
Les amines.
a)- L’ammoniac.
-
Schéma de Lewis :
-
Atome d’azote : ![]() ;
;
-
Molécule d’ammoniac : 
-
Les amines sont des corps obtenus par remplacement d’un ou plusieurs
atomes d’hydrogène par des groupes carbonés.
b)- Les différentes classes d’amines.

c)- Nomenclature :
-
Les amines comme l’ammoniac sont des réactifs nucléophiles. Ce sont
aussi des bases faibles.
-
Les amides dérivent des acides carboxyliques par remplacement du
groupement
– OH
par un groupe

-
Le groupement fonctionnel et les différentes formules générales :
Nomenclature :
-
Le nom découle de celui de l’acide correspondant en remplaçant la
terminaison
oïque
par la terminaison
amide.
-
Exemples :
-
Amides simples :
-
amides
substitués sur l’azote :
a)- Utilisation d’un chlorure d’acyle.
-
Les chlorures d’acyle réagissent avec l’ammoniac de façon rapide :

-
Cas général :
-
Chlorure d’acyle et amine primaire :

-
Chlorure d’acyle et amine secondaire :
-
Chlorure d’acyle et amine tertiaire : pas de réaction.
b)- Utilisation d’un anhydride d’acide.
-
Exemple : anhydride d’acide et amine primaire :
-
Une réaction acido-basique peut se produire entre l’acide carboxylique
et l’amine.
- L’aspirine est l’un des médicaments les plus consommés.
- En France et par
an, 32,2 millions d’unité d’aspirine sont absorbées.
-
C’est le paracétamol avec 130 millions d’unité qui est l’antalgique le
plus utilisé.
-
L’aspirine est :
-
un
anti-inflammatoire (elle calme les rhumatismes),
-
un
antipyrétique (elle provoque un abaissement de la température
corporelle),
-
Un antalgique (elle calme la douleur).
- L’usage des plantes est connu depuis longtemps.
- La tisane de fleurs de
reine-des-prés et les décoctions d’écorces de saule étaient bien connues
pour leur capacité à calmer la douleur.
-
Hippocrate (460 – 377 avant J.C) fondateur de la médecine prescrivait
des tisanes de feuilles de Saule pour calmer les douleurs.
-
En 1825, le pharmacien italien Francesco FONTANA isole le principe actif
du Saule blanc qu’il appelle : SALICINE.
-
En 1828, l’Allemand
Büchner
isole quelques cristaux jaunes de Salicine ou salicylate de glucose.
-
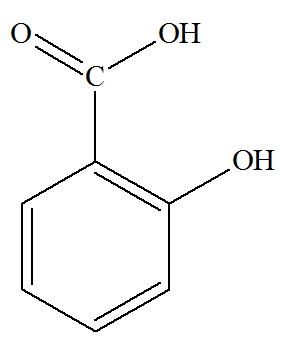
En 1829, l’Italien Rafael PIRIA prépare l’acide salicylique.


-
En 1835, un chimiste suisse K.J LöWIG
prépare à partir de la reine-des-prés un composé identifié comme l’acide
salicylique.
-
L’acide salicylique, produit industriellement par synthèse, possède des
propriétés thérapeutiques intéressantes.
-
Mais il possède un goût amer
et il a une réaction néfaste sur l’estomac.
-
Il provoque des brûlures et des ulcères.
-
Il était donc nécessaire de préparer
une nouvelle molécule ayant les mêmes propriétés que l’acide
salicylique, mais moins agressive pour l’estomac.
-
Un chimiste Allemand Félix HOFFMAN transforme la fonction phénol de
l’acide salicylique en fonction ester par acétylation.
- On obtient l’acide acétylsalicylique qui a les mêmes propriétés que l’acide salicylique mais qui est mieux toléré par l’organisme.
- Félix
HOFFMAN et Heinrich DASER (chimistes de la firme BAYER) déposent en 1899
le nom commercial de
ASPIRIN.
3)-
Les matières premières de la synthèse industrielle de l’aspirine.
-
L’industrie pharmaceutique utilise :
-
Le phénol, le dioxyde de carbone, l’anhydride éthanoïque ou acétique,
l’acide sulfurique et l’hydroxyde de sodium
4)-
Fabrication de l’aspirine.
a)- Préparation de l’acide salicylique.
-
Dans un réacteur, on mélange du phénol pur avec la quantité
stœchiométrique de lessive de soude à 50 %.
-
Au cours de cette réaction, le phénol est transformé en phénate de
sodium.
-
L’eau est soigneusement éliminée par évaporation sous vide.
-
On obtient le phénate de sodium solide de formule :
-
Formule :

- On introduit, dans un autoclave broyeur, le phénate de sodium solide. On injecte à une température θ = 150 °C du dioxyde de carbone gazeux à la pression de 5 bar.
- On obtient du salicylate de sodium.
- Cette réaction est appelée : réaction de
Kolbe.

-
L’ion salicylate est la base conjuguée de l’acide salicylique.
-
Traité par un acide fort, l’acide sulfurique à 60 % (pourcentage
massique), on obtient l’acide salicylique.
-
Passage à l’aspirine :
-
L’acide salicylique est traité par l’anhydride éthanoïque à une
température
θ = 98 °C.
-
Au bout de deux heures de traitement, le mélange est filtré pour
éliminer l’acide
salicylique n’ayant pas réagi.
-
La solution obtenue laisse précipiter par refroidissement à 0 °C
l’aspirine sous forme d’un solide blanc.
|
|
|
|