|
QCM N° 12 |
Les Espèces chimiques naturelles ou synthétiques |
|
|
|
|
Les espèces chimiques naturelles et synthètiques.
Pour chaque question, indiquer la (ou les) bonne(s)
réponse(s). |
|||||
|
Énoncé |
A |
B |
C |
R |
|
|
1 |
Les espèces chimiques de synthèse : |
Existent dans la nature |
Sont fabriquées au laboratoire |
Peuvent être des espèces n’existant pas dans la nature |
ABC |
|
2 |
La vitamine C est une espèce chimique présente dans les goyaves, par exemple. La vitamine C : |
Est une espèce naturelle |
Peut être synthétique |
Est une espèce artificielle |
AB |
|
3 |
La chimie de synthèse permet : |
D’économiser les ressources naturelles |
De fabriquer des espèces chimiques aux propriétés intéressantes |
De fabriquer des principes actifs de médicaments |
ABC |
|
4 |
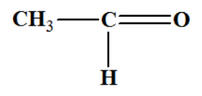
Le goupe caractéristique hydroxyle est présent dans : |
L’éthanol
|
Le méthoxyméthane
|
L’éthanal
|
A |
|
5 |
Le groupe caractéristique carboxyle est présent dans : |
L’éthanol
|
L’acide formique
|
L’éthanal
|
B |
|
6 |
La température de fusion d’une espèce chimique est : |
Caractéristique de cette espèce |
La température pour laquelle l’espèce fond |
La température pour laquelle l’espèce se dissout dans l’eau |
AB |
|
7 |
Dans cette solution, obtenue en ajoutant 2,0 g de diiode dans 100 mL d’eau, la solubilité du diiode est : |
Égale à 20 g / L |
Nulle |
Inférieure à 20 g / L |
C |
|
8 |
La chromatographie sur couche mince (CCM) est une techniquequi permet : |
La séparation d’espèces chimiques |
La synthèse d’espèces chimiques |
L’identification d’espèces chimiques |
AC |
|
9 |
Dans le chromatogramme suivant, la solution déposée en B1 :
|
Ne contient qu’une seule espèce chimique |
Contient l’espèce chimique C3. |
Contient l’espèce chimique C2. |
C |
| 10 |
Dans le chromatogramme suivant, la solution déposée en B1 :
|
Contient l’espèce chimique C1 |
est un mélange |
est un corps pur |
AB |
►
Formulation d’un médicament :
(Cours chimie N° 03 Les
molécules.)
-
La formulation d’un
médicament correspond :
-
À sa préparation
-
Au
choix de sa forme d’administration, dite forme galénique
(Comprimé, gélule, suppositoire, solution buvable, …)
-
À l’élaboration de sa
composition.
►
La forme galénique
-
La forme galénique d’un
médicament correspond :
-
À l’aspect sous lequel il est
présenté : comprimé, gélule, suppositoire, solution buvable
-
Mais aussi au mode d’absorption :
libération prolongée, gastrorésistant, voie orale, …
-
La galénique est l’étude des
modes d’administration d’un médicament.
-
Le but de la
galénique est d’assurer la
stabilité du principe actif,
faciliter son administration, optimiser son
efficacité
thérapeutique, améliorer sa conservation,
diminuer sa toxicité, favoriser le suivi correct du
traitement
(observance).
►
Composition d’un médicament :
-
Un médicament est un mélange. Il
est constitué de nombreuses espèces chimiques.
-
On entend par médicament toute
composition présentée comme possédant des propriétés curatives
ou préventives à l’égard des maladies humaines ou animales.
-
La formulation d’un
médicament correspond à sa préparation, détermine sa composition
et formule galénique.
►
Le principe actif :
-
Un principe actif possède un
effet thérapeutique qui permet de prévenir ou guérir une
maladie.
- Le principe actif est désigné par sa dénomination commune internationale (DCI) :
- c’est le plus
souvent le nom scientifique que l’on utilise dans tous les pays
du monde.
-
Exemple : l’ibuprofène, le
paracétamol et l’acide acétylsalicylique sont des principes
actifs.
►
Extrait de notice :

-
Le principe actif est le
paracétamol
-
Les excipients : le stéarate de
magnésium, le talc, l’amidon de blé, le lactose.
►
Espèces chimiques :
-
Les espèces chimiques naturelles
sont celles qui existent dans la nature.
-
Les espèces chimiques
synthétiques sont préparées par l’Homme à l’aide de
transformations chimiques.
-
Les espèces chimiques
artificielles sont des espèces chimiques synthétiques qui
n’existent pas dans la nature.
-
Les espèces chimiques
synthétiques qui sont identiques aux espèces chimiques
naturelles ont exactement les mêmes propriétés.
►
La chimie de synthèse.
-
Pour répondre aux besoins de
l ‘homme, l’industrie chimique synthétise un nombre considérable
de produits.
-
On distingue : la chimie lourde
et la chimie fine.
-
La chimie lourde synthétise, à
partir de matières premières simples des produits en grande
quantité :
-
Synthèse de matières plastiques
(polyéthylène,…)
-
Synthèse de l’ammoniac (NH3,…).
-
Synthèse de l’aluminium (bauxite
→ alumine)
-
La chimie fine synthétise des
substances plus complexes :
-
Synthèse de la vanilline (arôme
de vanille).
-
Synthèse de l’aspirine (acide
acétylsalicylique).
-
Elle permet de synthétiser en
grande quantité des espèces chimiques d’origine naturelle sans
épuiser les ressources naturelles.
►
Acide citrique :
-
Représentation 3D :

-
Formule semi-développée :
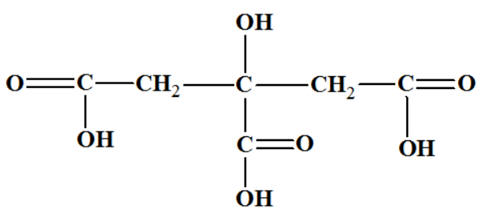
ou
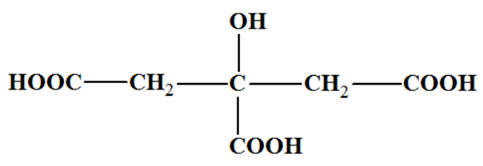
-
Nom : acide
2-hydroxypropane-1,2,3 tricarboxylique.
-
Formule brute :
C6H8O7
►
La température de fusion :
θfus.
-
On appelle température de fusion
d’une espèce chimique, notée θf, la
température de passage de l’état solide à l’état liquide de
cette espèce chimique.
-
L’unité : le degré Celsius : ° C
-
Instrument de mesure : le
thermomètre, le banc Kofler.
-
La température de fusion d’une
espèce chimique est caractéristique de cette espèce.
-
La détermination expérimentale
d’une température de fusion d’une substance permet d’identifier
cette substance par comparaison avec les valeurs répertoriées
dans des tables de données.
-
Elle permet aussi de vérifier si
la substance est pure.
►
La solubilité.
-
La solubilité
s (E)
d’une espèce chimique E dans un solvant donné est égale à
sa concentration massique dans une solution saturée à la
température considérée.
|
|
s (E) solubilité en g / L |
|
m masse du soluté en g |
|
|
V volume de la solution saturée obtenue en L |
-
La solubilité de l’acide
benzoïque est plus grande dans l’acétate d’éthyle que dans le
cyclohexane.
-
Dans le
bécher a la solution est
homogène. L’acide benzoïque a totalement disparu.
-
Dans le
bécher b la solution est
saturée. Il reste de l’acide benzoïque solide (solide blanc).
►
Chromatographie sur couche
mince(C.C.M).
-
La chromatographie permet de
séparer les espèces chimiques présentes dans un mélange
homogène.
-
Elle est basée sur la différence
de solubilité d’une substance dans deux phases non miscibles :
-
Pour effectuer une C.C.M, on
utilise :
-
Une phase fixe sur laquelle une
goutte de mélange à séparer est déposée.
-
La phase fixe est constituée
d’une mince couche de gel de silice déposée sur une plaque
d’aluminium.
-
Une phase mobile ou éluant.
-
C’est le solvant dans lequel les
constituants du mélange sont plus ou moins solubles.
-
L’éluant migre le long de la
phase fixe grâce au phénomène de capillarité.
-
Il entraîne les constituants du
mélange qui se déplacent à des vitesses différentes.
-
On peut ainsi les séparer.
►
Cas des espèces chimiques
incolores :
-
Les chromatogrammes d’espèces
chimiques incolores doivent être révélés afin de les exploiter.
-
En peut éclairer le
chromatogramme avec une lampe (U.V) pour les substances qui
absorbe ces radiations comme l’acide acétylsalicylique.
-
On peut utiliser des révélateurs
chimiques tels que le diiode ou le permanganate de potassium qui
permettent de révéler la présence de nombreuses espèces
chimiques.
|
|