|
Les Molécules. Cours |
|
|
Mots clés : Cours de chimie seconde les molécules,espèces chimiques , modélisation des atomes, modélisation des molécules, modéles moléculaires, formule brute, formule développée, formule semi-développée, isomères, ... |
|
|
|
II- Représentation
d’une molécule. |
|
TP Les modèles moléculaires. Enoncé Les molécules sont réalisées avec un logiciel gratuit
|
|
Exercices : énoncé avec correction a)- Exercice 1 : écrire la formule brute d’une molécule. b)- Exercice 3 : établir les formules à partir d’un modèle. c)- Exercice 5 : Comparer la formule d’une molécule et son modèle. d)- Exercice 6 : Interpréter des propriétés chimiques. e)- Exercice 7 : Lire une étiquette de médicament. f)- Exercice 8 : Décrire la formulation d’un médicament. g)- Exercice 12 : des modes d’administration différents. h)- Exercices 13 : les parabènes. |
|
1)- Exercice 5 page
125 :
Décrire une molécule. 2)- Exercice 10 page
125 : Utiliser une formule semi-développée. 3)- Exercice 12 page
126 : Identifier des isomères. 4)- Exercice 15 page
226 : Nommer des groupes caractéristiques. 5)- Exercice 19 page
127 : Des molécules aux propriétés différentes. 6)- Exercice 20 page
128 : La naissance d’un médicament. |
- Une molécule est une entité chimique électriquement neutre.
- Elle est formée d’un nombre limité d’atomes liés entre eux par des liaisons de covalence.
- C’est le cas de la molécule d’eau qui renferme deux atomes d’hydrogène et un atome d’oxygène.
2)- Modélisation des atomes et des molécules.
a)- La formule brute d’une molécule.
-
La formule brute
d’une molécule est l’écriture la plus compacte décrivant la nature et le nombre
d’atomes de cette molécule.
- Un atome est désigné par un nom et un symbole chimique : l’atome d’hydrogène H, l’atome d’azote N,…
- À chaque molécule est attribuée un nom et une formule brute.
|
Formule brute Dans la formule brute d’une molécule, les symboles des éléments présentsdans la molécule sont écrits côte à côte avec, en indice, en bas à droite, le nombre d’atomes de chaque élément |
- L’indice 1 n’est jamais spécifié.
- La nature et le nombre des atomes présents dans une molécule sont donnés par sa formule brute.
-
Exemple : formule brute de la molécule d’eau :
H2O et formule
brute de la molécule de saccharose : C12H22O
11
- Le nombre d’atomes d’une molécule est son atomicité.
- Donner l’atomicité de chaque molécule :
- Eau 3 et saccharose 45.
b)- Exemple de molécules :
- On peut représenter les molécules à l’aide de modèles moléculaires.
- Au lycée, on utilise le modèle compact ou le modèle éclaté.
|
- Modèle éclaté : - Chaque atome est représenté par une sphère (une boule). - Les sphères sont liées les unes aux autres par des tiges représentant les doublets de liaisons (les doublets liants) ou les liaisons covalentes. - La longueur des tiges est proportionnelle à la distance entre les noyaux des atomes liés entre eux. |
|
- Modèle compact : - Dans ce modèle, plus proche de la réalité, les sphères sont en contact les unes avec les autres,
mais on ne peut pas distinguer le nombre de
liaisons
que deux atomes forment entre eux. |
|
Élément
chimique |
H |
O |
N |
Cl |
C |
S |
|
Couleur |
Blanc |
Rouge
|
Bleu |
Vert |
Noir |
Jaune |
|
Représentation |
|
|
|
|
|
|
|
Nom de la molécule |
Constitution |
Formule chimique |
Modèle moléculaire compact |
|
Dihydrogène |
2 atomes d’hydrogène |
H2 |
|
|
Chlorure d’hydrogène |
1 atome d’hydrogène 1 atome de chlore |
HCl |
|
|
Dioxygène |
2 atomes d’oxygène |
O2 |
|
|
Eau |
2 atomes d’hydrogène 1 atome d’oxygène |
H2O |
|
|
Dioxyde de carbone |
1 atome de carbone 2 atomes d’oxygène |
CO2 |
|
|
Ammoniac |
1 atome d’azote 3 atomes d’hydrogène |
NH3 |
|
|
Méthane |
1 atome de carbone 4 atomes d’hydrogène |
CH4 |
|
3)- Les liaisons entre les atomes :
a)- Nombre de liaisons d’un atome dans une molécule.
- Dans les molécules, les atomes des éléments d’une même colonne forment le même nombre de liaisons.
- Les atomes des éléments situés :
- Dans la 14e colonne (celle du carbone) forment 4 liaisons ;
- (4 simples liaisons ou 2 simples liaisons et une double liaison ou 2 doubles liaisons ou une simple liaison et une triple liaison)
- Dans la 15e colonne (celle de l’azote) forment 3 liaisons
- (3 simples liaisons ou 1 simples liaisons et une double liaison ou une triple liaison) ;
- Dans la 16e colonne (celle de l’oxygène) forment 2 liaisons
- (2 simples liaisons ou une double liaison);
- Dans la 17e colonne (celle du fluor) forment 1 liaison simple.
b)- Pour aller plus loin : La liaison covalente. (ancien programme)
- Lorsqu’ils forment des molécules, les atomes mettent en commun certains des électrons de leurs couches électroniques externes de façon à s’entourer de 2 ou 8 électrons.
- En conséquence, dans une molécule, les atomes sont liés par des liaisons covalentes ou des liaisons de covalence.
|
Liaison Covalente La liaison covalente consiste à la mise en commun par deux atomes d’un ou plusieurs doublets d’électrons appelés doublets de liaison ou doublets liants. |
|
- Remarque : - Les électrons mis en commun appartiennent à chacun des deux atomes et doivent être pris en compte dans le total des électrons de chaque atome. - En formant des liaisons de covalence, chaque atome acquiert, en général, une structure électronique en octet ou en DUET, semblable à celle du gaz noble qui le suit dans la classification périodique. |
|
- Le nombre de liaisons covalentes qu’établit un atome est
généralement égal |
c)- Nombre de liaisons. (découle du paragraphe précédent)
- Dans les molécules de dihydrogène, de chlorure d’hydrogène et d’eau chaque atome d’hydrogène est lié aux autres atomes par une simple liaison.
- Dans la molécule de dioxygène et de dioxyde de carbone, les atomes sont liés entre eux par deux liaisons.
- On parle de double liaison.
- Dans la molécule de diazote N2, trois liaisons s’établissent entre les atomes.
- On est en présence d’une triple liaison.
|
Nom de la molécule |
Constitution |
Formule chimique |
Modèle moléculaire éclaté |
|
Dihydrogène |
2 atomes d’hydrogène |
H2 |
|
|
Chlorure d’hydrogène |
1 atome d’hydrogène 1 atome de chlore |
HCl |
|
|
Dioxygène |
2 atomes d’oxygène |
O2 |
|
|
Eau |
2 atomes d’hydrogène 1 atome d’oxygène |
H2O |
|
|
Dioxyde de carbone |
1 atome de carbone 2 atomes d’oxygène |
CO2 |
|
|
Diazote |
2 atomes d’azote |
N2 |
|
II- Représentation d’une molécule.
1)- Formules développée et semi-développée.
a)- Formule développée :
|
Formule développée Les atomes sont représentés par leur écriture symbolique. - Une liaison simple est symbolisée par un tiret entre les atomes. - Une liaison multiple est symbolisée par plusieurs tirets. - Dans la formule développée d’une molécule, toutes les liaisons sont représentées. |
|
Nom de la molécule |
Constitution |
Formule chimique |
Formule développée |
|
Dihydrogène |
2 atomes d’hydrogène |
H2 |
H — H |
|
Chlorure d’hydrogène |
1 atome d’hydrogène 1 atome de chlore |
HCl |
H — Cl |
|
Dioxygène |
2 atomes d’oxygène |
O2 |
O
= O |
|
Eau |
2 atomes d’hydrogène 1 atome d’oxygène |
H2O |
H — O — H |
|
Dioxyde de carbone |
1 atome de carbone 2 atomes d’oxygène |
CO2 |
O
= C = O |
|
Diazote |
2 atomes d’azote |
N2 |
N ≡ N |
b)- Formule semi-développée.
|
Formule semi-développée - Les atomes sont représentés par leur écriture symbolique. - Une liaison simple est symbolisée par un tiret entre les atomes. - Une liaison multiple est symbolisée par plusieurs tirets. - Dans la formule développée d’une molécule, toutes les liaisons sont représentées. |
-
Dans la formule
semi-développée d’une molécule, on ne représente pas les liaisons engagées par
les atomes d’hydrogène.
- Cette écriture est très utile en chimie organique pour représenter les molécules d’hydrocarbures, …
|
Nom |
Formule
brute |
Formule développée |
Formule semi-développée |
|
Éthane |
C2H6 |
|
CH3 — CH3 |
|
Éthylène |
C2H4 |
|
CH2 = CH2 |
|
Éthanol |
C2H6O |
|
HO
— CH2
— CH3 |
|
Méthoxyméthane |
C2H6
O |
|
H3C — O — CH3 |
|
Butane |
C4H10 |
|
CH3 — CH2
—CH2 — CH3 |
|
Isobutane |
C4H10 |
|
|
- La formule brute ne renseigne pas sur l’enchainement des atomes qui constituent la molécule.
- De plus, à partir d’une formule brute, on peut obtenir plusieurs molécules différentes.
- C’est le cas de l’éthanol et du méthoxyméthane d’une part et du butane et de l’isobutane d’autre part.
|
Définition d’isomères
la même formule brute, mais des enchaînements d’atomes différents.
et constituent des espèces chimiques distinctes. |
|
Exercice : Écrire des formules semi-développées 1)- Rappeler la définition d’isomères. 2)- On considère la formule brute C3H8O. - Sachant que les liaisons entre les différents atomes ne sont que des liaisons simples - écrire les formules semi-développées des trois isomères correspondant à cette formule brute. |
|
Correction : - Deux molécules isomères ont même formule brute mais des enchaînements d’atomes différents. 2)- Formule brute : C3H8 O - Formules semi-développées :
|
III- Groupes caractéristiques.
|
Groupe Caractéristique
autres que les seuls atomes de carbone et d’hydrogène, présent dans la formule d’une espèce chimique.
et physiques particulières aux molécules qui le possèdent. |
- Remarque : une espèce chimique peut posséder plusieurs groupes caractéristiques.
2)- Quelques groupes caractéristiques :
|
Nom |
Alcool |
Carbonyle |
Carboxyle |
Étheroxyde |
|
Formule |
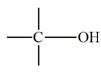 |
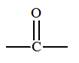 |
 |
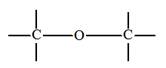 |
|
Exemple |
CH3
―CH2―OH
Alcool éthylique
(Éthanol) Phénol |
Acétone
(Propan-2-one) |
Acide acétique
(Acide éthanoïque) |
Éther méthylique
(méthoxyméthane) |
|
Nom |
Ester |
Amine |
Amide |
Hydroxyle |
|
Formule |
|
|
|
―OH |
|
Exemple |
Acétate de
méthyle
Éthanoate de
méthyle |
Méthanamine |
Acétamide
Éthanamide
|
Phénol
|
- Remarque : Certaines molécules peuvent renfermer plusieurs groupes :
|
Acide salicylique : groupe acide et groupe hydroxyle (phénol) |
|
|
Acide acétylsalicylique groupe acide et groupe ester |
|
|
Paracétamol : groupe amide et groupe hydroxyle |
|
![]() Un corps pur est constitué d’une seule espèce chimique et peut
être représenté par sa formule chimique.
Un corps pur est constitué d’une seule espèce chimique et peut
être représenté par sa formule chimique.
- Un corps pur possède des constantes physiques spécifiques : température de fusion, température d’ébullition, masse volumique, indice de réfraction,…
- Exemple : l’eau H2O est un corps pur, le méthane CH4, le butane C4H10, le dioxygène O2, ….
![]() Un mélange est constitué d’espèces chimiques différentes.
Un mélange est constitué d’espèces chimiques différentes.
- Il ne peut pas être représenté par une formule chimique.
- Ainsi l’air est un mélange de dioxygène O2, de diazote N2, d’argon Ar,…
- On ne donne pas de formule chimique à l’air.
- On peut donner la formule chimique des constituants de l’air
3)- Formulation et principe actif.
a)- Le médicament.
- Un médicament est un mélange.
- Il est constitué de nombreuses espèces chimiques.
- On entend par médicament toute composition présentée comme possédant des propriétés curatives ou préventives à l’égard des maladies humaines ou animales.
- Il contient :
- Un ou plusieurs principes actifs
- Des excipients.
b)- Le principe actif :
- Un principe actif possède un effet thérapeutique qui permet de prévenir ou guérir une maladie.
- Le principe actif est désigné par sa dénomination commune internationale (DCI) :
- C’est le plus souvent le nom scientifique que l’on utilise dans tous les pays du monde.
- Exemple : l’ibuprofène, le paracétamol, l’acide acétylsalicylique sont des principes actifs.
c)- Les excipients :
- Les excipients sont souvent dépourvus d’activité thérapeutique.
- Ils permettent de rendre le principe actif plus efficace.
- Les excipients permettent aussi de présenter le médicament sous une forme donnée.
- Exemple : sur la notice, on peut lire souvent excipient q.s.p un comprimé (q.s.p : quantité suffisante pour)
- Il est important de lire la notice car la présence de certains excipients (saccharose, lactose,..) peut avoir un impact sur des patients allergiques.
- Dans ce cas, on parle d’excipients à effets notoires.
d)- La formulation.
- La formulation consiste à déterminer la nature et les proportions des différents ingrédients qui le composent
Elle permet :
- De présenter le médicament sous une forme adaptée pour la voie d’administration souhaitée
- De modifier le goût ou l’odeur du médicament
- De moduler la vitesse de libération du principe actif dans l’organisme
- D’améliorer la conservation du médicament.
- Ce sont les excipients qui permettent cette mise en forme.
- Exemples :
- Les comprimés secs contiennent souvent de la cellulose, de l’amidon qui permettent au cacher de se déliter
- L’hydrogénocarbonate de sodium est présent dans les comprimés effervescents.
- En présence d’eau, il se dégage du dioxyde de carbone et permet ainsi une meilleure dispersion du principe actif avant administration.
- Remarque : un même principe actif peut être associé à différents excipients.
e)- Princeps et génériques.
- Le médicament original est appelé princeps.
- Les laboratoires pharmaceutiques effectuent des recherches pour mettre au point des médicaments.
- Lorsqu’une espèce chimique qui possède un principe actif susceptible d’aboutir à un médicament est découverte ou synthétisée, un brevet est déposé.
- Des recherches sont ensuite menées pour étudier les effets de l’espèce chimique sur des organismes vivants (cellules animaux).
- Puis des études cliniques doivent être réalisées afin d’obtenir une autorisation de mise sur le marché (AMM) délivré par un organisme d’état :
- Agence française de sécurité sanitaire des produits de santé (Afssaps).
- Jusqu’à expiration du brevet le laboratoire garde l’exclusivité de la commercialisation du médicament original, appelé princeps (environ 10 ans d’exploitation).
- Après cette date, d’autres laboratoires peuvent commercialiser une copie du produit original : c’est le médicament générique.
- Un médicament générique contient le même principe actif que celui d’une marque.
- Le médicament générique est souvent commercialisé sous sa dénomination commune internationale (DCI).
- Son aspect ou sa présentation peuvent changer et les excipients peuvent être différents.
- Il faut faire attention à la présence d’excipients à effets notoires.
- Un médicament générique est moins cher qu’un princeps car les coûts de recherche et de développement n’entrent pas dans le prix.
|
Énoncé |
A |
B |
C |
R |
|
|
1 |
La molécule d’eau, de formule H2O, contient : |
1 atome d’oxygène |
2 atomes d’oxygène |
2 atomes d’hydrogène |
AC |
|
2 |
Une molécule de dioxyde d’azote est formée d’un atome d’azote et de 2 atomes d’oxygène. Sa formule est : |
NO2 |
N2O |
N2O |
A |
|
3 |
Une molécule de peroxyde d’hydrogène est formée de 2 atomes d’hydrogène et de 2 atomes d’oxygène. Sa formule s’écrit : |
2H O |
H2O2 |
HO2 |
B |
|
4 |
Une molécule d’ozone à pour formule O3.. Deux molécules
d’ozone s’écrivent : |
O6 |
6 O |
2 O3 |
C |
|
5 |
CH3 F est une : |
Formule brute |
Formule semi-développée |
Formule développée |
A |
|
6 |
est une :
|
Formule brute |
Formule semi-développée |
Formule développée |
B |
|
7 |
Ces deux molécules sont celles d’espèces : |
Différentes |
Identiques |
Isomères |
B |
|
8 |
Ces deux molécules sont celles d’espèces : |
Différentes |
Identiques |
Isomères |
AC |
|
9 |
Le dioxyde de carbone CO2 est : |
Une espèce chimique |
Un corps pur |
Un mélange |
AB |
|
10 |
L’air est : |
Une espèce chimique |
Un corps pur |
Un mélange |
C |
|
11 |
Un principe actif : |
Possède un effet thérapeutique |
Rend l’action de l’excipient plus efficace |
Peut être associé à différents excipients |
AC |
|
12 |
Un excipient : |
Possède toujours un effet thérapeutique |
Rend l’action du principe actif plus efficace |
Peut être associé à différents principes actifs |
BC |
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 1 : écrire la formule brute d’une molécule.
b)- Exercice 3 : établir les formules à partir d’un modèle.
c)- Exercice 5 : Comparer la formule d’une molécule et son modèle.
d)- Exercice 6 : Interpréter des propriétés chimiques.
e)- Exercice 7 : Lire une étiquette de médicament.
f)- Exercice 8 : Décrire la formulation d’un médicament.
g)- Exercice 12 : des modes d’administration différents.
h)- Exercices 13 : les parabènes.
|
|