|
TP Chimie N° 06 |
Suivi pH-métrique d'une réaction acido-basique. Correction |
|
|
|
|
Programme 2012 : Programme 2020 : |
|
I - Réaction entre l'acide chlorhydrique et la soude. 5)- Étude des courbes obtenues. II - Réaction entre l'acide éthanoïque et la soude. |
Cours :
Chap N° 01 Transformations acido-basiques
Chap N° 13 Réaction chimique par échange de proton
Chimie N° 05 Réactions acido-basiques
Chimie N° 06 Dosages acido-basiques
Chap N° 02 Réaction entre un acide fort et une base forte
|
Matériel : |
burette graduée 25 mL - pipette jaugée de 10 mL - pH-mètre – solutions tampons ( 7 et 4) - béchers et erlenmeyers - agitateur magnétique - eau distillée, solution d’acide chlorhydrique 0,10 mol / L, soude 0,10 mol / L et acide éthanoïque
0,10 mol / L |
|
But
|
tracer et analyser les courbes de variation du pH lors de réactions acide-base. |
I- Réaction entre l’acide
chlorhydrique et la soude (rangée 1).![]()
![]() Écrire
l’équation de la réaction entre l’acide chlorhydrique et l’eau.
Écrire
l’équation de la réaction entre l’acide chlorhydrique et l’eau.
HCl (g)
+
H2O
(ℓ)
→
![]() Quelles
sont les espèces présentes dans la solution d’acide chlorhydrique ?
Quelles
sont les espèces présentes dans la solution d’acide chlorhydrique ?
- Espèces présentes : H3O+ (aq) et Cl – (aq)et HO – (aq) (ultra minoritaire).
- On note (H3O+ (aq) + Cl – (aq)) la solution d’acide chlorhydrique.
![]() La soude est une solution aqueuse d’hydroxyde de sodium.
La soude est une solution aqueuse d’hydroxyde de sodium.
- L’hydroxyde de sodium est un composé ionique (solide blanc) qui réagit totalement avec l’eau.
- On donne l’équation simplifiée :
|
|
H2O |
|
|
NaOH
(s) |
|
Na+ (aq)
+ HO –
(aq)
|
- Il découle de ceci que l’espèce NaOH n’existe pas en solution aqueuse.
- L’ion sodium Na+ ne réagit pas avec l’eau.
- Il n’a pas de propriété acide.
- On dit que l’ion sodium Na+ est un ion indifférent, il est spectateur.
- Faire un schéma légendé du dispositif expérimental

![]() Étalonner le pH-mètre.
Étalonner le pH-mètre.
- Mettre la solution de soude dans la burette graduée (repère 0).
- Verser dans un bécher un certain volume de la solution d'acide chlorhydrique.
- En prélever un volume VA = 10 mL de la solution à l'aide de la pipette jaugée (10 mL) et les verser dans un autre bécher ou un erlenmeyer.
- Ajouter environ 10 mL d'eau distillée pour que la sonde du pH-mètre soit totalement immergée.
- Ajouter quelques gouttes d’un indicateur coloré (B.B.T, phénolphtaléine ou hélianthine).
- Placer le barreau aimanté et maintenir une agitation douce.
- Verser progressivement la solution de soude dans la solution d'acide et relever la valeur du pH après chaque ajout.
- Adapter les volumes VB versés aux variations de pH
- Placer les résultats dans un tableau du type ci-dessous. Il est conseillé de prendre une feuille de brouillon.
|
VB
mL |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
8,5 |
8,8 |
9 |
9,2 |
|
pH |
1,70 |
1,75 |
1,77 |
1,82 |
1,90 |
1,98 |
2,08 |
2,21 |
2,40 |
2,55 |
2,67 |
2,81 |
2,96 |
|
VB
mL |
9,5 |
9,7 |
10 |
10,2 |
10,5 |
10,7 |
11 |
11,5 |
12 |
13 |
17 |
18 |
20 |
|
pH |
3,39 |
6,60 |
10,29 |
10,65 |
10,96 |
11,11 |
11,24 |
11,38 |
11,47 |
11,62 |
11,89 |
11,93 |
12,0 |
5)- étude des courbes obtenues.
![]() Tracer
le graphe
pH
= f
(VB) sur papier millimétré pour les deux
acides étudiés.
Tracer
le graphe
pH
= f
(VB) sur papier millimétré pour les deux
acides étudiés.
- Commenter les courbes obtenues.
- Montrer que l’on peut décomposer chaque graphe en trois parties distinctes.
- Donner les caractéristiques de chaque partie et justifier l’aspect de chaque partie en indiquant quel est le réactif en excès et le réactif limitant.
- Caractéristiques du graphe pH = f (VB) :
- Le pH augmente lors de l’addition d’un volume VB de soude.
![]() Partie
AB de la courbe :
au départ, le
pH est faible.
Partie
AB de la courbe :
au départ, le
pH est faible.
- Il augmente d’abord lentement car l’acide est en excès par rapport à la base.
- La base est le réactif limitant.
![]() Partie
BC de la courbe :
Partie
BC de la courbe :
- Le pH augmente d’autant plus que l’excès d’acide se réduit.
- On observe un saut de pH de plusieurs unités.
- Ce saut de pH provient du changement de réactif limitant.
- On est aux alentours de l’équivalence.
- Dans la partie BC, la courbe change de concavité, elle possède un point d’inflexion E.
- Ce point particulier est appelé point d’équivalence, noté E.
- En ce point, on change de réactif limitant.
- On passe d’un excès d’acide à un excès de base.
![]() Partie
CD de la courbe :
Partie
CD de la courbe :
- Dans cette zone, l’acide est le réactif limitant et la base est le réactif en excès.
- Cet excès impose un pH dont la valeur est élevée.
- Le pH augmente à nouveau lentement puis se stabilise.
a)- Équation de la réaction.
![]() Écrire
l’équation de la réaction entre l’acide chlorhydrique et la soude.
Écrire
l’équation de la réaction entre l’acide chlorhydrique et la soude.
- il se produit la réaction :
H3O+ (aq) + HO – (aq) = 2 H2O (ℓ)
![]() Calculer
la constante d’équilibre de cette réaction. Cette réaction convient-elle pour
un dosage ? Justifier.
Calculer
la constante d’équilibre de cette réaction. Cette réaction convient-elle pour
un dosage ? Justifier.
- C’est la réaction inverse de l’autoprotolyse de l’eau.
- La constante d’équilibre de cette réaction est :
- 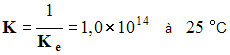
- cette réaction est quasi totale car K > 10 4 .
- On peut écrire :
H3O+
(aq)
+
HO
– (aq)
→
- Cette réaction convient pour un dosage car elle est rapide, unique, quasi totale.
- Remarque :
À l’équivalence, la solution obtenue est une solution de chlorure de sodium.
- Cette solution est neutre car elle contient des ions indifférents Na+ et Cl –
b)- Tableau d’avancement de la réaction : dresser le tableau d’avancement de la réaction.
|
Équation |
H3O+ (aq) + |
HO– (aq) |
|
2 H2O (ℓ) |
|
|
état |
Avancement
x (mol) |
|
|
|
|
|
État initial
(mol) |
0 |
C A.VA |
CB.VB |
|
excès |
|
Avancement
final |
xf |
CA.VA
– xf |
CB.VB
– xf |
excès |
|
|
Avancement
maximal |
xmax |
CA.VA
– xmax
|
C B.V B
– xmax
|
|
excès |
- Au départ, c’est l’acide qui est en excès (partie du graphe AB).
- Lorsque les réactifs sont pratiquement dans les proportions stœchiométriques on observe un saut de pH (partie BC de la courbe).
- Puis la soude est en excès (partie CD de la courbe).
c)- Volume de soude versée à l’équivalence :
![]() Définir
l’équivalence et calculer le volume
V
BE de
soude versée à l’équivalence.
Définir
l’équivalence et calculer le volume
V
BE de
soude versée à l’équivalence.
- il y a équivalence lorsque les réactifs ont été mélangés dans les proportions stœchiométriques de la réaction.
![]() Que
se passe-t-il lorsque le volume de soude versée est égal à
V
BE sur le
graphe ?
Que
se passe-t-il lorsque le volume de soude versée est égal à
V
BE sur le
graphe ?
- lorsque le volume de soude versée est égal à V BE , on observe un saut de pH.
- À la goutte près, le système évolue d’un milieu franchement acide, à un milieu franchement basique.
d)- Détermination graphique du point d’équivalence E :
Le point d’équivalence est le point d’inflexion de la courbe pH = f (V B).
- On utilise la méthode des tangentes
ou la fonction dérivée
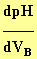 pour déterminer ses coordonnées.
pour déterminer ses coordonnées.
- Au point d’équivalence, on change de réactif limitant et la courbe change de concavité.
- Le point d’équivalence est caractérisé par ses coordonnées : pHE et VBE.
- La méthode des tangentes donne les résultats suivants :
- Remarque : il y a un problème avec la concentration de la solution d’acide chlorhydrique.
e)- Valeur du pH à l’équivalence : donner la valeur du pH à l’équivalence pHE à l’aide du graphe.
- Valeur du pH à l’équivalence : pHE = 7,0 à 25 °C.
II- Réaction entre l’acide éthanoïque et la soude (rangée 2).
![]() Écrire
l’équation de la réaction entre l’acide éthanoïque et l’eau.
Écrire
l’équation de la réaction entre l’acide éthanoïque et l’eau.
CH3COOH (aq) + H2O (ℓ) = H3O+ (aq) + CH3COO – (aq)
- Quelles sont les espèces présentes dans la solution d’acide éthanoïque sachant que le pK A = 4,8 ?
- pKA = 4,8 => KA = 10 – 4,8 => KA ≈ 1,6 x 10 – 5
- La réaction entre l’acide éthanoïque et l’eau est une réaction limitée.
- La solution contient principalement des molécules d’acide éthanoïque et un peu des ions éthanoate et des ions oxonium.
- On note la solution d’acide éthanoïque : CH3COOH (espèce majoritaire).
![]() La soude est une solution aqueuse d’hydroxyde de sodium.
La soude est une solution aqueuse d’hydroxyde de sodium.
- L’hydroxyde de sodium est un composé ionique (solide blanc) qui réagit totalement avec l’eau.
- On donne l’équation simplifiée :
|
|
H2O |
|
|
NaOH
(s) |
→ |
Na+ (aq) + HO– (aq) |
- Il découle de ceci que l’espèce NaOH n’existe pas en solution aqueuse.
- L’ion sodium Na + ne réagit pas avec l’eau.
- Il n’a pas de propriété acide.
- On dit que l’ion sodium Na + est un ion indifférent, il est spectateur.
- Faire un schéma légendé du dispositif expérimental

![]() Étalonner le pH-mètre.
Étalonner le pH-mètre.
- Mettre la solution de soude dans la burette graduée (repère 0).
- Verser dans un bécher un certain volume de la solution d'acide éthanoïque.
- En prélever un volume VA = 10 mL de la solution à l'aide de la pipette jaugée (10 mL) et les verser dans un autre bécher ou un erlenmeyer.
- Ajouter environ 10 mL d'eau distillée pour que la sonde du pH-mètre soit totalement immergée.
- Ajouter quelques gouttes d’un indicateur coloré (B.B.T, phénolphtaléine ou hélianthine).
- Placer le barreau aimanté et maintenir une agitation douce.
- Verser progressivement la solution de soude dans la solution d'acide et relever la valeur du pH après chaque ajout.
- Adapter les volumes VB versés aux variations de pH.
- Placer les résultats dans un tableau du type ci-dessous. Il est conseillé de prendre une feuille de brouillon.
|
VB
mL |
0 |
0,5 |
1 |
2 |
3 |
5 |
7 |
8 |
8,5 |
9 |
9,5 |
10 |
10,5 |
|
pH |
2,71 |
3,17 |
3,48 |
3,89 |
4,18 |
4,6 |
5,03 |
5,33 |
5,5 |
5,75 |
6,11 |
6,85 |
9,85 |
|
VB
mL |
10,8 |
11,2 |
11,4 |
11,6 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
pH |
10,4 |
11,1 |
11,4 |
11,6 |
11,9 |
12,3 |
12,4 |
12,6 |
12,7 |
12,7 |
12,8 |
12,8 |
12,9 |
5)- étude des courbes obtenues.
![]() Tracer
le graphe
pH = f (VB) sur papier millimétré pour les deux
acides étudiés.
Tracer
le graphe
pH = f (VB) sur papier millimétré pour les deux
acides étudiés.
![]() Commenter
les courbes obtenues. Montrer que l’on peut décomposer chaque graphe en
trois parties distinctes.
Commenter
les courbes obtenues. Montrer que l’on peut décomposer chaque graphe en
trois parties distinctes.
- Donner les caractéristiques de chaque partie et justifier l’aspect de chaque partie en indiquant quel est le réactif en excès et le réactif limitant.
- Caractéristiques du graphe pH = f (V B) :
- Le pH augmente lors de l’addition d’un volume VB de soude.
![]() Partie
AB de la courbe :
au départ, le
pH est faible,
l’acide est en excès par rapport à la base.
Partie
AB de la courbe :
au départ, le
pH est faible,
l’acide est en excès par rapport à la base.
- La base est le réactif limitant.
- Dans la partie AB, la courbe change de concavité.
![]() Partie
BC de la courbe :
Partie
BC de la courbe :
- le pH augmente d’autant plus que l’excès d’acide se réduit.
- On observe un saut de pH. Ce saut de pH provient du changement de réactif limitant.
- On est aux alentours de l’équivalence.
- Dans la partie BC, la courbe change de concavité, elle possède un point d’inflexion E.
- Ce point particulier est appelé point d’équivalence, noté E.
- En ce point, on change de réactif limitant.
- On passe d’un excès d’acide à un excès de base.
![]() Partie
CD de la courbe :
Partie
CD de la courbe :
- Dans cette zone, l’acide est le réactif limitant et la base est le réactif en excès.
- Cet excès impose un pH dont la valeur est élevée.
- Le pH augmente à nouveau lentement puis se stabilise.
a)- Équation de la réaction entre l’acide éthanoïque et la soude.
![]() Écrire
l’équation de la réaction entre l’acide éthanoïque et la soude.
Écrire
l’équation de la réaction entre l’acide éthanoïque et la soude.
- il se produit la réaction :
CH3COOH (aq) + HO – (aq) = CH3COO – (aq) + H2O (ℓ)
![]() Calculer
la constante d’équilibre de cette réaction. Cette réaction convient-elle pour
un dosage ? Justifier.
Calculer
la constante d’équilibre de cette réaction. Cette réaction convient-elle pour
un dosage ? Justifier.
- 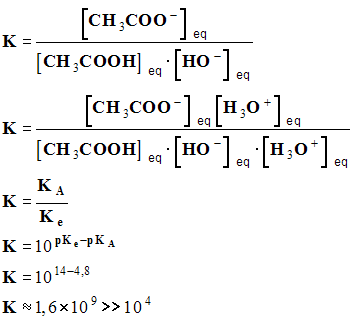
- cette réaction est quasi totale car K > 10 4 .
- On peut écrire :
CH3COOH (aq) +
HO –
(aq) →
- Cette réaction convient pour un dosage car elle est rapide, unique, quasi totale.
- Remarque :
À l’équivalence, la solution obtenue est une solution d’éthanoate de sodium de sodium.
- Cette solution est basique car elle contient des ions éthanoate CH3COO – (base) et les ions Na + qui sont indifférents.
b)- Tableau d’avancement de la réaction :
- dresser le tableau d’avancement de la réaction.
|
Équation |
CH3COOH (aq) + |
HO – (aq) |
→ |
CH3COO– (aq) |
+ H2O (ℓ) |
|
|
état |
Avancement
x (mol) |
|
|
|
|
|
|
État initial
(mol) |
0 |
CA.VA |
CB.VB |
|
0 |
excès |
|
Avancement
final |
xf |
CA.VA
– xf |
CB.VB
– xf |
xf |
excès |
|
|
Avancement
maximal |
xmax |
CA.VA
- xmax
|
CB.VB
– xmax
|
|
xmax |
excès |
- Au départ, c’est l’acide qui est en excès (partie du graphe AB).
- Lorsque les réactifs sont pratiquement dans les proportions stœchiométriques on observe un saut de pH ( partie BC de la courbe).
- Puis la soude est en excès (partie CD de la courbe).
c)- Volume de soude versée à l’équivalence :
![]() Définir
l’équivalence et calculer le volume
VBE de
soude versée à l’équivalence.
Définir
l’équivalence et calculer le volume
VBE de
soude versée à l’équivalence.
- Il y a équivalence lorsque les réactifs ont été mélangés dans les proportions stœchiométriques de la réaction.
![]() Que
se passe-t-il lorsque le volume de soude versée est égal à
VBE sur le graphe ?
Que
se passe-t-il lorsque le volume de soude versée est égal à
VBE sur le graphe ?
- lorsque le volume de soude versée est égal à VBE , on observe un saut de pH.
- À la goutte près, le système évolue d’un milieu franchement acide, à un milieu franchement basique.
d)- Détermination graphique du point d’équivalence E :
Le point d’équivalence est le point d’inflexion de la courbe pH = f (VB).
- On utilise la méthode des tangentes ou la fonction dérivée
![]() pour déterminer les coordonnées du point équivalent
E.
pour déterminer les coordonnées du point équivalent
E.
- Les coordonnées du point d’équivalence sont obtenues grâce à la méthode des tangentes.
e)- Valeur du pH à l’équivalence : donner la valeur du pH à l’équivalence pHE à l’aide du graphe.
- pHE ≈
À l’équivalence, la solution obtenue est une solution d’éthanoate de sodium.