|
|
|
Réaction chimique par échange de proton Contrôle de qualité par dosage. Programme 2012 : Programme 2020 |
|
Chim. N° 06 |
Dosages acido-basiques. Cours. |
|
|
|
|
Réaction chimique par échange de proton Contrôle de qualité par dosage. Programme 2012 : Programme 2020 |
|
Exercices : |
|
Pour aller plus loin :
|
Mots clés : Réaction de dosage ; dosages acido-basiques ; titrage acido-basique ; point d'équivalence ; détermination graphique du point d'équivalence ; ... |
I-
Évolution du pH lors de l’addition d’une base à un acide.
![]()
TP Chimie N° 06 : Suivi pH-métrique d'un réaction acido-basique.
1)- Réaction entre l’acide chlorhydrique et la soude.
a)- Expérience :
- à un volume VA = 10 mL d’acide chlorhydrique de concentration CA = 1,0
x 10 – 1 mol / L,- on ajoute progressivement de la soude (solution aqueuse d’hydroxyde de sodium) de concentration CB = 1,0 x 10 – 1 mol / L.
![]() On
mesure le
pH
de la solution initiale et le
pH de la solution obtenue
après chaque ajout de soude.
On
mesure le
pH
de la solution initiale et le
pH de la solution obtenue
après chaque ajout de soude.
b)- Exploitation :
- on trace le graphe : pH = f (VB).
- Le
pH augmente lors de
l’addition d’un volume
VB
de soude. - Partie
AB de la courbe :
-
au départ, le
pH est faible. - Il
augmente d’abord lentement car l’acide est en excès
par rapport à la base.
- La
base est le réactif limitant.
|
- Partie BC de la courbe : - le pH augmente d’autant plus que l’excès d’acide se réduit. - On observe un saut de pH de plusieurs unités. - Ce saut de pH provient du changement de réactif limitant. - On est aux alentours de l’équivalence. - Dans la partie BC, la courbe change de concavité, - Elle possède un point d’inflexion E. - Ce point particulier est appelé point d’équivalence, noté E. - En ce point, on change de réactif limitant. - On passe d’un excès d’acide à un excès de base. |
|
- Partie CD de la courbe : - Dans cette zone, l’acide est le réactif limitant et la base est le réactif en excès. - Cet excès impose un pH dont la valeur est élevée. - Le pH augmente à nouveau lentement puis se stabilise. |
2)- Réaction entre l’acide éthanoïque et la soude.
a)- Expérience :
![]() à
un volume VA = 10
mL d’acide éthanoïque de concentration
CA = 1,0
à
un volume VA = 10
mL d’acide éthanoïque de concentration
CA = 1,0
- On ajoute progressivement de la soude (solution aqueuse d’hydroxyde de sodium) de concentration CB = 1,0 x 10 –1 mol / L.
- On mesure le pH de la solution initiale et le pH de la solution obtenue après chaque ajout de soude.
b)- Exploitation : on trace le graphe : pH = f (VB).
- Le pH augmente lors de l’addition d’un volume VB de soude.
|
- Partie AB de la courbe : - Au départ, le pH est faible, l’acide est en excès par rapport à la base. - La base est le réactif limitant. - Dans la partie AB, la courbe change de concavité. |
|
- Partie BC de la courbe : - le pH augmente d’autant plus que l’excès d’acide se réduit. - On observe un saut de pH. - Ce saut de pH provient du changement de réactif limitant. - On est aux alentours de l’équivalence. - Dans la partie BC, la courbe change de concavité, - Elle possède un point d’inflexion E. - Ce point particulier est appelé point d’équivalence, noté E. - En ce point, on change de réactif limitant. - On passe d’un excès d’acide à un excès de base. |
|
- Partie CD de la courbe : - Dans cette zone, l’acide est le réactif limitant et la base est le réactif en excès. - Cet excès impose un pH dont la valeur est élevée. - Le pH augmente à nouveau lentement puis se stabilise. |
a)- Définition :
- il y a équivalence lorsque les réactifs ont été mélangés dans les proportions stœchiométriques de la réaction.
b)- Le point d’équivalence E :
- Le point d’équivalence est le point d’inflexion de la courbe pH = f (VB).
- Au point d’équivalence, on change de réactif limitant et la courbe change de concavité.
- Le point d’équivalence est caractérisé par ses coordonnées : pHE et VBE.
c)- Influence de la dilution.
- La dilution de l’acide et de la base dans les mêmes proportions ne change pas le volume de base versée à l’équivalence (VBE).
- La dilution influe sur le saut de pH. L’amplitude du saut de pH diminue lorsque l’on dilue.
II- Repérage du point d’équivalence E.![]()
1)- Détermination graphique de VBE.
a)- Méthode des tangentes.
- elle permet par une méthode graphique de déterminer les coordonnées du point d'équivalence E.
- On trace deux tangentes à la courbe pH = f (VB), parallèles et situées de part et d'autre du point d'équivalence (point d'inflexion de la courbe) et suffisamment proche de l'équivalence.
- On trace ensuite la parallèle à ces deux tangentes, équidistantes de celles-ci.
- Son point d'intersection avec la courbe définit le point d'équivalence E.
b)- Méthode de la fonction dérivée.
- Pour repérer le point d’équivalence E, on peut tracer la courbe représentant le coefficient directeur a de la tangente à la courbe pH = f (VB).
- Le coefficient a est défini par la relation :
- 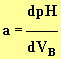
- L’abscisse
VBE
du point
d’équivalence
E est l’abscisse de l’extremum
de la courbe représentant
 en fonction de
VB.
en fonction de
VB.
|
Acide
éthanoïque |
|||
|
|
pKA1 |
4,8 |
|
|
Concentration |
CA |
8,00
x 10 – 3 |
mol
/ L |
|
|
|||
|
Volume d'acide : |
VA |
25 |
mL |
|
Volume d'eau |
Veau |
10 |
mL |
|
|
|||
|
Solution
titrante : la soude |
|||
|
Concentration |
CB |
1,00
x 10 – 2 |
mol
/ L |
|
pKe |
14 |
1,00
x 10 – 14 |
Ke |
2)- Détermination de VBE à l’aide d’un indicateur coloré.
- C’est le principe du dosage colorimétrique.
- Ce sont des indicateurs dont la teinte dépend du pH de la solution. Ils possèdent une zone de virage.
|
|
3,1 |
4,4 |
||
|
Hélianthine |
rouge |
Zone de Virage
orange |
Jaune |
|
|
|
6,0 |
7,6 |
||
|
B.B.T |
jaune |
Zone de Virage
vert |
Bleu |
|
|
|
8,2 |
10 |
||
|
Phénolphtaléine |
Incolore |
Zone de virage
Rose très pâle |
Rose fuchsia |
|
|
|
|
|
|
|
- Un indicateur coloré convient pour un dosage acido-basique si sa zone de virage contient la valeur du pH à l’équivalence.
- L’indicateur est convenablement choisi si l’ajout d’une seule goutte de solution titrante s’accompagne à la fois du passage par l’équivalence et d’un changement de couleur de l’indicateur.
- Exemple 1 : dosage de l’acide chlorhydrique par la soude.
|
Acide
chlorhydrique |
|||
|
Concentration |
CA |
1,00
x 10 – 1 |
mol
/ L |
|
|
|||
|
Volume
d'acide : |
VA |
10 |
mL |
|
Volume
d'eau |
Veau |
10 |
mL |
|
|
|||
|
Solution
titrante : la soude |
|||
|
Concentration
|
CB |
1,00
x 10 – 1 |
mol
/ L |
|
pKe
|
14 |
1,00
x 10 – 14 |
Ke |
Fichier Excel.zip
- L’hélianthine qui change de couleur avant l’équivalence ne convient pas mais nous renseigne sur le début de l’équivalence.
- Le B.B.T vire à l’équivalence.
- Le B.B.T convient pour ce type de dosage.
- La phénolphtaléine vire après l’équivalence.
- Elle nous renseigne sur la fin de l’équivalence.
- Exemple 2 : dosage de l’acide éthanoïque par la soude.
|
Acide
éthanoïque |
|||
|
|
pKA1 |
4,8 |
|
|
Concentration |
CA |
1,00
x 10 – 1 |
mol
/ L |
|
|
|||
|
Volume d'acide : |
VA |
10 |
mL |
|
Volume d'eau |
Veau |
10 |
mL |
|
|
|||
|
Solution
titrante : la soude |
|||
|
Concentration |
CB |
1,00
x 10 – 1 |
mol
/ L |
|
pKe |
14 |
1,00
x 10 – 14 |
Ke |
- L’hélianthine qui change de couleur nettement avant l’équivalence ne convient pas.
- Le B.B.T nous renseigne sur le début de l’équivalence.
- La phénolphtaléine convient pour ce dosage.
3)- Détermination d’une concentration inconnue.
- Un dosage consiste à déterminer la concentration d’une solution à l’aide d’une réaction avec une solution titrée.
- Lorsque l’on dose un acide à l’aide d’une base, il se produit la réaction suivante entre deux couples acide / base :
- HA
/ A–
et
BH
+ /
B :
HA + B = A– + BH +
- On connaît :
|
Acide
HA |
|
|
Concentration |
CA |
|
Volume d'acide : |
V
A |
|
|
|
|
Solution
titrante : Base B |
|
|
Concentration |
CB
|
|
Volume de base |
VBE = ? |
- On détermine la valeur de VBE , à l’aide d’une méthode graphique ou à l’aide d’un indicateur coloré.
- Par définition, à l’équivalence, l’acide et la base ont été mélangés dans les proportions stœchiométriques de la réaction.
- En conséquence, à l’équivalence, la quantité de matière d’acide apporté est égale à la quantité matière de base apportée :
- nA
- CA
.
VA
- Cette dernière relation permet de calculer la concentration inconnue.
|
|
III- Caractéristiques de la réaction de titrage acido-basique.
1)- Taux d’avancement final des réactions acido-basiques.
- Application : étude de la réaction entre l’acide éthanoïque et la soude. On donne :
|
Acide
éthanoïque |
Valeur du pH de la solution :
pH
= 4,8 |
|||
|
|
pK
A1 |
4,8 |
|
|
|
Concentration |
CA |
1,00
x 10 – 1 |
mol
/ L |
|
|
|
||||
|
Volume d'acide : |
VA |
10 |
mL |
|
|
Volume d'eau |
Veau |
10 |
mL |
|
|
|
||||
|
Solution
titrante : la soude |
||||
|
Concentration |
CB |
1,00
x 10 – 1 |
mol
/ L |
|
|
Volume de soude
: |
VB |
5 |
mL |
|
- En déduire la valeur τ du taux d’avancement de la réaction et conclure.
- Réponse :
- Tableau d’avancement de la réaction.
|
Équation |
AH
(aq)
|
+ HO
–(aq)
|
= |
A–(aq)
|
+
H2O
(ℓ)
|
|
|
état |
Avancement
x
(mol) |
|
|
|
|
|
|
État initial
(mol) |
0 |
CA
. VA |
CB
.
VB |
|
0 |
excès |
|
Avancement
final |
xf |
CA
.
VA
– xf |
CB
. VB
– xf |
xf |
excès |
|
|
Avancement
maximal |
xmax |
CA
. VA
– xmax
>
0 |
CB
. VB
– xmax
=
0 |
|
xmax |
excès |
-
Connaissant
CA, VA
et
CB ,on peut en déduire
la valeur de
VBE.
- À l’équivalence :
|
nA |
||||||||||||||
|
CA
.
VA |
||||||||||||||
|
.
V
A |
|
x 10 |
=> |
VBE ≈ 10 mL |
|||||||||
- Conclusion : VB < VBE.
- La base est le réactif limitant.
- Avancement maximal :
- xmax = CB. VB = 5,0 x 10 – 4 mol
- Avancement final :
- La valeur du pH permet de connaître la concentration en ions oxonium mais aussi la concentration en ions hydroxyde HO – .
- Pour la détermination de l'avancement final, c'est la valeur de la concentration en ions hydroxyde qui est utile.
- [HO
–]f = 10
pH
– pKe
avec
n (HO
–)
f
= CB.
VB
– xf
- xf =
CB. VB
–
n
(HO –)f
- xf =
CB. VB
– [HO
–]f . (VA
+ VB +
Veau)
- xf = CB. V B – 10 pH – pKe . (VA + VB + Veau)
- xf = (1,0 x 10 – 1 x 5,0 x 10 – 3) – 10 4,8 – 14 x (10 + 5,0 + 10) x 10 – 3
- xf ≈ 5,0 x 10 – 4 mol
- Taux d’avancement de la réaction :
|
=> |
|
=> |
τ ≈ 1,0 |
- La transformation est quasi totale.
2)- Caractéristiques de la réaction entre l’acide chlorhydrique et la soude.
- Le chlorure d’hydrogène réagit totalement sur l’eau.
- Il découle de ceci que l’espèce HCℓ n’existe pas en solution aqueuse.
- On écrit :
HCℓ (g) + H2O (ℓ) → H3O+ (aq) + Cℓ–(aq)
- L’ion chlorure Cℓ– ne réagit pas avec l’eau.
- Il ne capte pas de proton pour redonner l’acide HCℓ.
- On dit que l’ion chlorure Cℓ– est un ion indifférent, il est spectateur.
- La soude est une solution aqueuse d’hydroxyde de sodium.
- L’hydroxyde de sodium est un composé ionique (solide blanc) qui réagit totalement avec l’eau.
- On donne l’équation simplifiée :
|
H2O |
||
|
NaOH (s) → Na+ (aq) + HO–(aq) |
||
- Il découle de ceci que l’espèce NaOH n’existe pas en solution aqueuse.
- L’ion sodium Na+ ne réagit pas avec l’eau.
- Il n’a pas de propriété acide.
- On dit que l’ion sodium
- Na+ est un ion indifférent, il est spectateur.
- La réaction entre l’acide chlorhydrique et la soude fait intervenir les couples acide / base de l’eau :
- H3O+(aq) / H2O (ℓ) et H2O (ℓ) / HO –(aq)
- il se produit la réaction :
H3O+(aq) + HO–(aq) → 2 H2O (ℓ)
- C’est la réaction inverse de l’autoprotolyse de l’eau. La constante d’équilibre de cette réaction est :
|
=> |
|
- cette réaction est quasi totale car K > 10 4 .
- À l’équivalence, la solution obtenue est une solution de chlorure de sodium.
- Cette solution est neutre car elle contient des ions indifférents.
- À 25 °C, le pH à l’équivalence pHE = 7.
- Conclusion :
- La réaction d’un acide de pKA inférieur à 0 sur une base de pKA supérieur à 14 a pour équation :
- il se produit la réaction :
H3O+(aq) + HO–(aq) → 2 H2O (ℓ)
- À 25 °C, le pH à l’équivalence pH E = 7.
3)- Caractéristiques de la réaction entre l’acide éthanoïque et la soude.
- La réaction de l’acide éthanoïque sur l’eau conduit à un équilibre chimique :
CH3COOH (aq) + H2O (ℓ) = CH3COO– (aq) + H3O+ (aq)
- Avec pK A = 4,8
- La solution d’acide éthanoïque de concentration CA = 1,0 x 10 – 1 mol / L à un pH ≈ 2,9.
- Alors : pH < pKA : c’est l’espèce acide qui prédomine.
- La soude est une solution aqueuse d’hydroxyde de sodium.
- L’hydroxyde de sodium est un composé ionique (solide blanc) qui réagit totalement avec l’eau.
- On donne l’équation simplifiée :
|
H2O |
||
|
NaOH (s) → Na+ (aq) + HO–(aq) |
||
- Il découle de ceci que l’espèce NaOH n’existe pas en solution aqueuse.
- L’ion sodium Na + ne réagit pas avec l’eau.
- Il n’a pas de propriété acide.
- On dit que l’ion sodium
- Na + est un ion indifférent, il est spectateur.
- La réaction acido-basique fait intervenir les couples acide / base :
- CH3COOH (aq) / CH3COO – (aq) et H2O (ℓ) / HO –(aq)
- Il se produit la réaction :
CH3COOH (aq) + HO–(aq) = CH3COO– (aq) + H2O (ℓ)
- On peut calculer la constante l’équilibre de cette réaction :
|
K = |
[CH3COO–] eq |
|
|
|
|
[CH3COOH] eq . [HO–] eq |
- On multiplie le numérateur et le dénominateur par la concentration en ions oxonium à l’équilibre.
|
K = |
[CH3COO–] eq . [H3O+] eq [CH3COOH] eq . [HO –] eq . [H3O+] eq |
K = |
KA Ke |
|||
|
=> |
|
|
||||
|
K = |
10 – pKA |
K = 10 pKe – pKA |
=> |
|||
|
|
=> |
K = 10 14 – 4,8 |
|
|||
|
10 – pKe |
||||||
|
K = 1,6 x 10 9 |
||||||
- cette réaction est quasi totale car K > 10 4.
CH3COOH (aq) + HO–(aq) → CH3COO– (aq) + H2O (ℓ)
- L’acide éthanoïque réagit quantitativement avec les ions hydroxyde.
- À l’équivalence, l’acide éthanoïque est presque totalement transformé en ion éthanoate.
- On obtient une solution d’éthanoate de sodium. L’ion éthanoate est la base conjuguée de l’acide éthanoïque.
- À l’équivalence, la solution est basique : pHE ≈ 8,7.
- Il faut utiliser la phénolphtaléine comme indicateur coloré. Le pH du point d’équivalence appartient à la zone de virage de l’indicateur coloré.
- Conclusion :
- La réaction d’un acide de pKA supérieur à 0 sur une base d’un couple de pKA supérieur à 14 a pour équation :
- Il se produit la réaction :
HA(aq) + HO–(aq) → A–(aq) + H2O (ℓ)
- À 25 °C, le pH à l’équivalence pH E > 7.
4)- Caractéristiques de la réaction entre l’ammoniac et l’acide chlorhydrique.
- Application : On donne :
|
Ammoniac
NH3 |
|||
|
|
pKA1 |
9,2 |
|
|
Concentration |
CB
|
1,00
x 10 – 1 |
mol
/ L |
|
|
|||
|
Volume : |
VB |
10 |
mL |
|
Volume d'eau |
Veau |
10 |
mL |
|
|
|||
|
Solution
titrante : Acide chlorhydrique |
|||
|
Concentration |
CA |
1,00
x 10 – 1 |
mol
/ L |
|
pKe |
14 |
1,00
x 10 – 14 |
Ke |
- Donner les couples acide / base qui interviennent.
- Écrire l’équation de la réaction entre l’ammoniac et l’acide chlorhydrique.
- Calculer la valeur du volume VAE d’acide versé à l’équivalence.
- Écrire et calculer la constante d’équilibre K de cette réaction. Conclure.
- Que peut-on dire de la valeur du pH de la solution obtenue à l’équivalence ? Justifier.
- Réponses :
- H3O+(aq) / H2O (ℓ) et H2O (ℓ) / HO–(aq)
- Couples acide / base : NH4+(aq) / NH3 (aq) et H3O+(aq) / H2O (ℓ)
- Équation de la réaction :
H3O+(aq) + NH3 (aq) = NH4+(aq) + H2O (ℓ)
- À l’équivalence :
|
nB |
||||||||||||||
|
CB
.
VB |
||||||||||||||
|
.
VB |
|
x 10 |
=> |
VAE ≈ 10 mL |
|||||||||
|
K = |
[NH4+] eq |
|
|
|
|
[NH3] eq . [H3O+] eq |
- 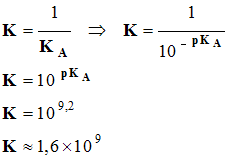
- cette réaction est quasi totale car K > 10 4 .
H3O+(aq) + NH3 (aq) → NH4+(aq) + H2O (ℓ)
- À l’équivalence, on est en présence d’une solution de chlorure d’ammonium.
- L’ion chlorure est un ion indifférent et l’ion ammonium est un acide : pHE < 7. (pH ≈ 5,3)