|
Chimie N° 02 |
Suivi temporel d'une réaction chimique : Exercices. |
|
|
|
|
Programme 2012 : Temps et évolution chimique : Cinétique et catalyse. Programme 2012 : Physique et Chimie Programme 2020 : Physique et chimie |
Pour aller plus loin :
|
Mots clés : méthode chimique d'analyse ; dosage ; temps de demi-réaction ; absorbance d'une solution ; loi de Beer-Lambert ; ... |
On réalise la courbe d’absorbance d’une solution de permanganate de potassium dans une cuve d’épaisseur 1 cm.
On obtient les résultats suivants :
|
[MnO4 –] mol / L |
1,0 × 10 – 4 |
3,0 × 10 – 4 |
5,0 × 10 – 4 |
|
Absorbance |
0,225 |
0,681 |
1,126 |
1)- Tracer la droite d’étalonnage A = f (C).
Cliquer sur l'image pour l'agrandir
- De la droite d’étalonnage, on peut déduire que :
- A (λ) = k . C
- A (λ) = 2,25 x 10 3 . C
2)- En déduire la valeur du coefficient d’absorption molaire de l’ion permanganate.
L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle à la concentration (effective) C de cette espèce et à l’épaisseur ℓ (cm) de la solution traversée par le faisceau lumineux. A (λ) = ε (λ) . ℓ . C |
- ε (λ) est appelé coefficient d’extinction molaire ou coefficient d’absorption molaire.
- Il dépend de la nature de l’espèce dissoute et de la longueur d’onde de la radiation utilisée.
- Il dépend également du solvant et de la température. (mol – 1.L.cm
– 1).
- 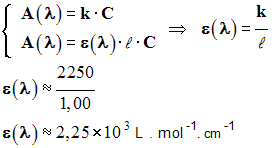
- Pour vérifier, on peut avec le tableur Excel, tracer la courbe de tendance et demander, l'équation de la courbe et le coefficient de détermination R2.
3)- Une solution de concentration C inconnue présente une absorbance égale à 0,500. Déterminer C en mol / L.
- On peut faire une lecture graphique ou un calcul.
- Lecture graphique :
Cliquer sur l'image pour l'agrandir
- Calcul :
- 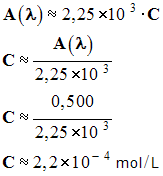
- Graphe de [ I2 ] en fonction de t :
Cliquer sur l'image pour l'agrandir
1)- Déterminer la concentration en ions iodure à l’instant t = 0.
- Concentration initiale en ions iodure.
- On mélange :
- V2 = 70 mL d’eau oxygénée de concentration C2 = 2,0 × 10 – 1 mol / L.
- V1 = 20 mL d’iodure de potassium de concentration C1 = 5,0 × 10 – 2 mol / L.
- V3 = 10 mL d’acide sulfurique de concentration C3 = 5,0 × 10 – 1 mol / L..
-
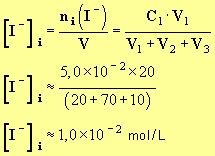
2)- Définir la vitesse volumique de réaction.
|
Définition : La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps, - Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel. - - Lorsque l’on travaille à volume constant, on obtient la relation suivante : - Relation :
- Avancement de la réaction : x : mol - volume du milieu réactionnel : V : L - Vitesse volumique de réaction : v (t) : mol / L / s |
3)- Déterminer graphiquement la valeur de la vitesse v0 en mol / L / s.
- Le graphe :
Cliquer sur l'image pour l'agrandir
- La valeur de la vitesse au temps t = 0 est donnée par la valeur du coefficient directeur k de la tangente T0.
|
Δ[I2] |
5,0 |
|||||
|
v (0) = |
|
≈ |
|
|
|
|
|
Δt |
2,5 |
|||||
|
v (0) ≈ 2,0 mmol / L / min |
||||||
|
v (0) ≈ 3,3 × 10 – 5 mol / L / s |
||||||
4)- Quelle est la valeur du temps de demi-réaction ?
- Valeur du temps de demi-réaction.
- Le temps de demi-réaction, noté t1/2, est la durée au bout de laquelle l’avancement de la réaction est égal à la moitié de sa valeur finale.
- Le temps de demi-réaction est atteint lorsque l’avancement de la réaction est égal à la moitié de l’avancement final.
|
H2O2
(aq)
+
2
H
+(aq)
+
2
I
–
(aq)
→
2
H2O |
|
Réaction lente |
- Tableau d’avancement de la réaction :
|
Équation |
H2O2 (aq) |
+ 2 I – (aq) |
+
2
H
+(aq)
|
→ |
I2
(aq) + |
2
H2O |
||
|
état |
Avanc.
x (mol) |
|
|
|
|
nt
(I2)
|
|
|
|
État initial
(mol) |
0 |
C2.
V2 |
C1.
V1 |
excès |
|
0 |
|
|
|
Au
cours de la
transformation |
x
(t) |
C2.
V2
– x (t) |
C1. V1
– x (t) |
|
x
(t) |
|
||
|
Avancement
final (mol) |
xf |
C2. V2
– xf |
C1. V1
– xf |
|
xf |
|
||
- Si :
- 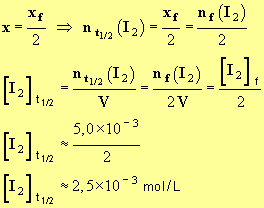
Cliquer sur l'image pour l'agrandir
- Graphiquement, on trouve que : t1/2 ≈ 2 min.
|
Le temps de demi-réaction, noté t1/2, est la durée au bout de laquelle l’avancement de la réaction est égal à la moitié de sa valeur finale. |
- Le temps de demi-réaction fournit une échelle des temps caractéristique du système étudié.
|
- L’expérience montre qu’un système siège d’une réaction caractérisée par le temps de réaction t1/2 cesse pratiquement d’évoluer au bout d’une durée de l’ordre de quelques t1/2 (4 à 7 suivant la précision recherchée). - Le temps de demi-réaction permet d’évaluer la durée nécessaire à l’achèvement de la transformation chimique étudiée. |
- On peut considérer que la réaction est pratiquement terminée au bout de 8 min.
On introduit une masse m = 1,00 g de zinc en poudre dans un ballon contenant un volume V1 = 40,0 mL d’acide chlorhydrique de concentration C1 = 0,500 mol / L.
On recueille le gaz dihydrogène formé au cours du temps et on mesure son volume V.
|
t
s |
[ I2
]
mol / L |
|
0 |
0,000 |
|
50 |
0,030 |
|
100 |
0,060 |
|
150 |
0,088 |
|
200 |
0,105 |
|
250 |
0,124 |
|
300 |
0,136 |
|
350 |
0,150 |
|
400 |
0,160 |
|
450 |
0,170 |
|
500 |
0,178 |
|
550 |
0,186 |
|
600 |
0,193 |
|
650 |
0,198 |
|
700 |
0,203 |
|
800 |
0,210 |
|
900 |
0,216 |
|
1000 |
0,220 |
L’ensemble des résultats de cette expérience permet de tracer le graphe représentant les variations de la concentration en ions Zn 2+ en fonction du temps.
Cliquer sur l'image pour l'agrandir
- Donnée : le volume molaire dans les conditions de l’expérience est Vm = 24,0 L.mol – 1 .
1)- Écrire l’équation de la réaction d’oxydoréduction se produisant entre les couples : H + (aq) / H2 (g) et Zn 2+ (aq) / Zn (s)
|
Zn (s) + 2 H +(aq) → Zn 2+ (aq) + H 2 (g) |
2)- Quelle est la relation entre la concentration en ions zinc II et le volume de dihydrogène formé ?
- On peut travailler avec le tableau d’avancement de la ré action.
|
Équation |
Zn (s) + 2 H +(aq) → Zn 2+ (aq) + H2 (g) |
|||||||||
|
état |
Avanc.
x (mol) |
|
|
|
nt (Zn 2+)
|
nt (H
2)
|
||||
|
État
initial (mol) |
0 |
|
|
|
0 |
0 |
||||
|
Au
cours de la
transformation |
x
(t) |
n
- x (t)
|
C1 . V1 – 2 x (t) |
x
(t) |
x
(t) |
|||||
|
Avancement
final (mol) |
xf |
n
- xf
|
C1
. V1
–
2 xf
|
xf |
xf |
|||||
- À chaque instant :
-
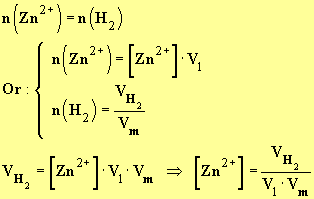
- Valeur de la concentration :
- 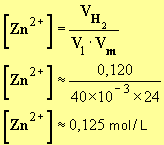
3)- Définir la vitesse volumique de la réaction.
Déterminer les valeurs de v aux dates t = 0 s, 300 s, 600 s et 1000 s.
|
Définition : La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps, - Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel. - - Lorsque l’on travaille à volume constant, on obtient la relation suivante : - Relation :
- Avancement de la réaction : x : mol - volume du milieu réactionnel : V : L - Vitesse volumique de réaction : v (t) : mol / L / s |
- Valeur de la vitesse t = 0 s.
Cliquer sur l'image pour l'agrandir
- La valeur de la vitesse au temps t = 0 est donnée par la valeur du coefficient directeur k de la tangente T0.
|
Δ [Zn 2 +] |
0,200 |
|||||
|
v (0) = k = |
|
≈ |
|
|
|
|
|
Δt |
320 |
|||||
|
v (0) ≈ 6,3 x 10 – 4 mol / L / s |
||||||
- Valeur de la vitesse t = 300 s.
Cliquer sur l'image pour l'agrandir
|
Δ [Zn 2 +] |
0,150 |
|||||
|
v (300) = k' = |
|
≈ |
|
|
|
|
|
Δt |
540 |
|||||
|
v (300) ≈ 2,8 × 10 – 4 mol / L / s |
||||||
- Valeur de la vitesse t = 600 s.
Cliquer sur l'image pour l'agrandir
|
Δ [Zn 2 +] |
0,080 |
|||||
|
v (600) = k'' = |
|
≈ |
|
|
|
|
|
Δt |
650 |
|||||
|
v (600) ≈ 1,2 × 10 – 4 mol / L / s |
||||||
- Valeur de la vitesse t = 1000 s.
Cliquer sur l'image pour l'agrandir
|
Δ [Zn 2 +] |
0,035 |
|||||
|
v (1000) = k = |
|
≈ |
|
|
|
|
|
Δt |
1000 |
|||||
|
v (1000) ≈ 3,5 × 10 – 5 mol / L / s |
||||||
4)- Comment évolue la vitesse au cours du temps ? Justifier.
- La vitesse volumique de réaction diminue au cours du temps.
- La courbe tend vers une asymptote horizontale et le coefficient directeur de la tangente à la courbe tend vers zéro.
5)- Quel est le réactif limitant ? Quelle est la valeur de la concentration en ions zinc II quand t tend vers l’infini ?
- Le réactif limitant : On travaille avec une partie du tableau d’avancement.
|
n
(Zn) |
n
(H+) |
|
n
- x (t)
|
C1 . V1 - 2 x (t) |
|
1,53
× 10
– 2 –
x
|
2,00 × 10 – 2 – 2 x |
- La réaction est finie par manque d’un des réactifs : en conséquence, il faut résoudre :
|
1,53 × 10 – 2 – x ≥ 0 (1) et 2,00 × 10 – 2 – 2 x ≥ 0 (2) |
|||
|
{ |
(1) => 0 ≤ x ≤ 1,53 × 10 – 2 |
||
|
et |
=> |
|
|
|
(2) => 0 ≤ x ≤ 1,00 × 10 – 2 |
|||
|
Conséquence : xmax = 1,00 × 10 – 2 mol |
|||
|
On en déduit que Zn (s) est en excès et H+ (aq) est en défaut |
|||
- Valeur de la concentration en Zn2+.
- En fin de réaction, on peut considérer que tous les ions H + ont réagi.
- D‘après le bilan de quantité de matière de l’équation de la réaction :
|
Équation |
Zn (s) + 2 H +(aq) → Zn 2+ (aq) + H 2 (g) |
|||||||||
|
état |
Avanc.
x (mol) |
|
|
|
nt (Zn 2+)
|
n
t (H
2)
|
||||
|
État
initial (mol) |
0 |
|
|
|
0 |
0 |
||||
|
Au
cours de la
transformation |
x
(t) |
n
- x (t)
|
C1 . V1- 2 x (t) |
x
(t) |
x
(t) |
|||||
|
Avancement
max (mol) |
x
max |
n
- xmax
|
C1
. V1
-
2 xmax
|
xmax |
xmax |
|||||
- Avec : xmax = 1,00 × 10 – 2 mol
- 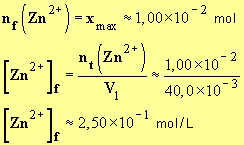
6)- En déduire le temps de demi-réaction.
- Temps de demi-réaction : il est atteint lorsque :
-
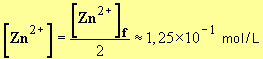
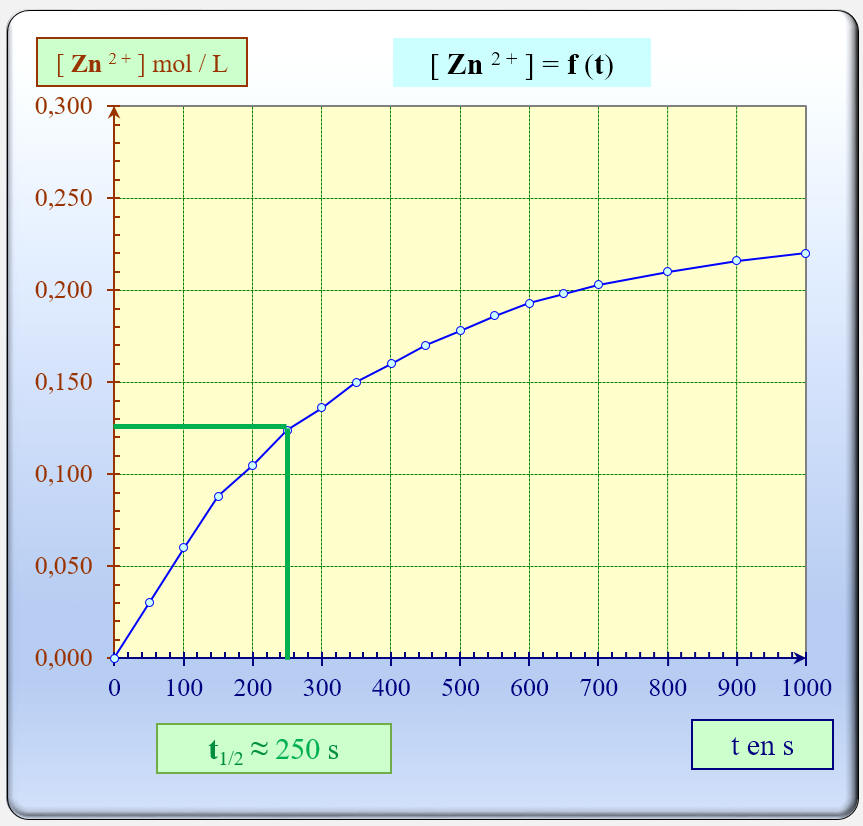
Cliquer sur l'image pour l'agrandir
- La lecture graphique donne : t1/2 = 250 s.
Préparation des Solutions.
1)- Masse de peroxodisulfate d’ammonium nécessaire.
- On donne :
- volume de la solution : V = 100 mL
- concentration de la solution C = 1,0 × 10 –1 mol / L.
- Masse molaire du peroxodisulfate d’ammonium :
- M ((NH4)2S2O 8) = M = 18,0 x 2 + 32,1 x 2 + 16,0 x 8
- M ((NH4)2S2O8) = M ≈ 228 g / mol
|
(NH4)2S2O8 |
→ |
2 NH4+ |
+ |
S2O82 – |
|
|
E.I |
n |
0 |
0 |
||
|
E.F |
0 |
2 n |
n |
||
|
Concentration |
C |
2 C |
C |
- Équation de dissolution : Par définition :
|
C = |
n |
|
|
|
|
V |
- En conséquence :
- La concentration en soluté est : C,
- La concentration en ions ammonium est :
- [NH4 +] = 2 C
- La concentration en ions peroxodisulfate est :
- [S2O8 2 –] = C
- Quantité de matière utilisée : n = C . V
- Masse de peroxodisulfate nécessaire : m = n . M = C . V . M
- Application numérique :
- m = C . V . M
- m = 1,0 x 10 – 1 x 0,100 x 228
- m ≈ 2,3 g
2)- Préparation de la solution S’.
- Il s’agit d’une dilution :
|
S 0 |
{ |
C 0 = 1,0 mol / L |
dilution |
S' |
{ |
C' = 0,20 mol / L |
|
V 0 = ? |
→ |
V' = 100 mL |
||||
|
n 0 = C . V |
n' = C' . V' |
- Au cours de la dilution, il y a conservation de la quantité de matière de soluté :
|
n 0 |
= |
n' |
=> |
C . V |
= |
C' . V' |
|
|
||||||
|
C' |
|
0,20 |
||||
|
V = |
|
V' |
=> |
V = |
|
× 100 |
|
C |
|
1,0 |
||||
|
V ≈ 20 mL |
||||||
- Matériel nécessaire : fiole jaugée de 100 mL et pipette jaugée de 20 mL avec sa propipette.
- On verse 25 mL de solution d’iodure de potassium dans un bécher.
- On prélève 20 mL à l’aide de la pipette munie de sa propipette.
- On les verse dans une fiole jaugée de 100 mL.
- On ajoute de l’eau distillée ( 3 /4).
- On mélange puis on ajoute de l’eau distillée jusqu’au trait de jauge et on homogénéise.
étude de la réaction.
1)- Concentration molaire volumique en ions S2O8 2 – à t = 0.
- On a mélangé 100 mL de solution S avec 100 mL de solution S’.
-
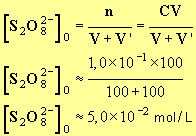
2)-
a)- On refroidit pour arrêter la réaction à la date t. La température est un facteur cinétique.
b)- Relation entre n (I2) et n (S2O32 –).
- On utilise une solution titrée de thiosulfate de sodium de concentration C2 = 1,0 × 10 – 2 mol / L.
- A l’équivalence, le volume de solution de thiosulfate de sodium est V2.
|
Équation |
2 S2O82 – (aq) |
+ I2 (aq) |
→ |
2 I – (aq) + |
S4O62 – (aq) |
|
|
état |
Avanc.
x (mol) |
|
|
|
|
|
|
État
initial (mol) |
0 |
n
(S2O3 2
–)
|
n
(I2)
|
|
0 |
0 |
|
Au
cours de la
transformation |
x |
n (S2O3 2 –) – 2 x |
n
(I2)
- x
|
2 x |
x |
|
|
Av.
max. (mol)
Équivalence |
xmax |
n
(S2O3 2
–)
– 2
xmax
|
n
(I2)
- xmax
|
2
xmax |
xmax |
|
|
|
0 |
0 |
|
|
|
|
- Relation à l’équivalence :
n
(S2O32
–) –
2 x
max
= 0 et
n
(I2)
–
x
max = 0
- Cette relation permet de déterminer la quantité de matière de diiode présente dans le volume V0 à partir de la quantité de matière d’ions thiosulfate versé.
- On peut écrire :
- n (S2O3 2 –) = 2 nt (I2)
c)- relation donnant la concentration de I2 dans chaque prélèvement de volume V1.
- ![]()
- 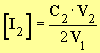
3)- tracé du graphe :
|
t
min |
V2
mL |
[ I2 ]
mmol / L |
[ I 2 ] mol / L
théorique |
|
0,0 |
0,0 |
0,0 |
0,0000 |
|
4,5 |
1,8 |
0,9 |
0,0009 |
|
8 |
2,4 |
1,2 |
0,0012 |
|
16 |
4 |
2,0 |
0,0020 |
|
20 |
4,8 |
2,4 |
0,0024 |
|
25 |
5,6 |
2,8 |
0,0028 |
|
30 |
6,1 |
3,1 |
0,0031 |
|
36 |
6,9 |
3,5 |
0,0035 |
|
44 |
7,4 |
3,7 |
0,0037 |
|
54 |
8,4 |
4,2 |
0,0042 |
|
69 |
9,2 |
4,6 |
0,0046 |
Cliquer sur l'image pour l'agrandir
4)-
a)- Vitesse volumique de la réaction.
|
Définition : La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps, - Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel. - - Lorsque l’on travaille à volume constant, on obtient la relation suivante : - Relation :
- Avancement de la réaction : x : mol - volume du milieu réactionnel : V : L - Vitesse volumique de réaction : v (t) : mol / L / s |
b)- Valeur de la vitesse aux dates t = 20 min et t = 40 min.
- La définition donne :
-

- La vitesse volumique de la réaction correspond à la dérivée par rapport au temps de la concentration en diiode par rapport au temps.
- Sachant que
 , on utilise le graphe
[I2]
t =
f (t)
, on utilise le graphe
[I2]
t =
f (t)
- La vitesse volumique de la réaction à la date t1 = 20 min est égale au coefficient directeur de la tangente à la courbe C au point M1 d’abscisse t1.
Cliquer sur l'image pour l'agrandir
|
Δ [I2] |
2,7 |
|||||
|
v (20) = |
|
≈ |
|
|
|
|
|
Δt |
30 |
|||||
|
v (20) ≈ 9,0 × 10 – 2 mmol / L / s |
||||||
- La vitesse volumique de la réaction à la date t2 = 40 min est égale au coefficient directeur de la tangente à la courbe C au point M2 d’abscisse t2.
Cliquer sur l'image pour l'agrandir
|
Δ [I2] |
2,2 |
|||||
|
v (20) = |
|
≈ |
|
|
|
|
|
Δt |
50 |
|||||
|
v (20) ≈ 4,4 × 10 – 2 mmol / L / s |
||||||
c)- Au cours du temps, la vitesse de la réaction diminue pour s’annuler lorsque la réaction est finie.