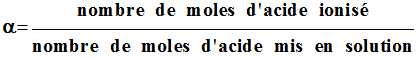|
Contrôle N° 02 Novembre 2000 |
|
|
|
Correction |
I- Newton et le mouvement de la Lune (1642 - 1727)
|
En 1666, Newton étudie les caractéristiques du vecteur accélération d’un mobile animé d’un mouvement circulaire uniforme, puis les utilise pour le mouvement de la Lune, qui décrit une orbite circulaire de rayon : r = 382800 km en 27 jours 7 heures 43 minutes et 11 secondes. 1)- Tester nos connaissances sur le mouvement circulaire uniforme. Étude préliminaire. a)- Représenter la trajectoire d’un mobile de centre d’inertie G animé d’un mouvement circulaire uniforme. Représenter le repère de FRENET. b)- Donner les coordonnées du vecteur vitesse du point G, du mobile dans le repère de FRENET. c)- Donner les coordonnées du vecteur accélération dans le repère de FRENET. 2)- Tester nos connaissances sur le mouvement circulaire uniforme. Répondre par Vrai ou Faux et justifier de façon détaillée votre réponse. a)- L’accélération est nulle car la vitesse est constante ? b)- Le vecteur accélération est normal car la norme du vecteur vitesse ne change pas ? c)- Le vecteur accélération est constant ? d)- La valeur de l’accélération ne change pas ? e)- La norme du vecteur accélération ne change pas si la valeur de la vitesse est multipliée par deux ainsi que le rayon de l’orbite ? 3)- Calculer la valeur de la vitesse v de la Lune sur son orbite et en déduire la valeur de son accélération. 4)- En utilisant la deuxième loi de Newton, en déduire la valeur de l’intensité du champ de gravitation créé par la Terre au niveau de la Lune. |
|
Une bobine, assimilable à un solénoïde théorique, a une longueur ℓ = 50 cm et comporte N = 200 spires. 1)- Calculer la valeur du champ magnétique à l’intérieur de ce solénoïde lorsque l’intensité du courant qui le traverse vaut : I = 0,20 A (on donne µ0 = 4 π × 10 –7 S.I) - L’axe de la bobine est placé horizontalement et perpendiculairement au méridien magnétique. Une petite aiguille aimantée est placée à l’intérieur de la bobine au voisinage de son centre. 2)- Faire un dessin schématisant l’ensemble du système dans un plan horizontal, lorsque aucun courant ne circule dans la bobine. On figurera les points cardinaux (Nord, Sud, Est et Ouest) et on indiquera les pôles de l’aiguille aimantée. On peut représenter la bobine par un rectangle. - On fait passer un courant constant d’intensité I = 0,20 A dans la bobine. L’aiguille aimantée dévie alors d’un angle α vers l’Est. 3)- Faire un schéma du dispositif à l’équilibre et indiquer : le sens du courant dans la bobine (il suffit de représenter une spire), les faces de la bobine. 4)- Calculer la valeur de l’angle α (en degrés) dont l’aiguille a dévié (composante horizontale du champ magnétique : bh = 2,0 × 10 –5 T. |
|
1)- On désire préparer par dilution un volume V = 100 mL d’une solution d’acide chlorhydrique de concentration CA = 1,0 × 10–2 mol / L en partant d’une solution mère de concentration C0 = 2,5 x 10– 1 mol / L. Quel volume V0 de solution mère doit-on utiliser et quel est le matériel nécessaire à la préparation de la solution ? Justifier. 2)- Afin de vérifier si la dilution est correcte, on effectue un dosage colorimétrique. On dose un volume VA = 20 mL de la solution ainsi préparée par une solution d’hydroxyde de sodium (soude) de concentration CB = 1,0 x 10 –2 mol / L et on constate qu’il faut verser un volume VB = 24 mL de base pour atteindre l’équivalence acido-basique. a)- Définir l’équivalence acido-basique. b)- Écrire l’équation-bilan de la réaction de dosage. Quelles sont les caractéristiques de cette réaction ? c)- Pour repérer l’équivalence, on utilise un indicateur coloré. Lequel ? pourquoi ? Justifier. d)- Calculer la concentration CA de la solution d’acide chlorhydrique dosée. e)- Quel volume de solution mère a-t-on en fait réellement utilisé si l’on suppose que les autres manipulations sont correctes ? 3)- Lors du dosage précédent, le pH est de 2,4 après un ajout de la solution d’hydroxyde de sodium de volume V’B = 12,0 mL. Recenser toutes les espèces présentes dans la solution et calculer la concentration de tous les ions présents. |
|
Un acide AH, de concentration C = 1,0 × 10–2 mol / L, a un pH égal à 3,4. 1)- Calculer la concentration des différentes espèces présentes dans l'eau. 2)- Calculer le coefficient d'ionisation α de cet acide. 3)- Comment peut-on qualifier cet acide ? Écrire l'équation bilan de la réaction entre l'acide et l'eau. On donne : pKe = 14 ;
|
|
|
|
|