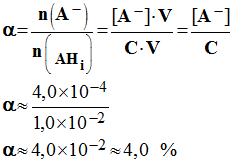|
Contrôle N° 02 Novembre 2000 Étude d'un acide Correction |
|
|
|
1)-
concentration des différentes espèces
présentes dans l'eau.
2)-
coefficient d'ionisation
α de cet acide.
3)-
équation bilan de la réaction entre l'acide et l'eau et
qualificatif |
|
1)- concentration des différentes espèces présentes dans l'eau. - Espèces présentes : : H3O+ ; OH – ; AH ; A – - Concentration des ions hydronium - pH = 3,4 - Par définition : - [H3O+] = 10 – pH mol / L - [H3O+] ≈ 10 – 3,4 mol / L - [H3O+] ≈ 4,0 × 10 – 4 mol / L - Concentration des ions hydroxyde
-
[OH–]
= 10 pH – pKe mol / L - [OH–] ≈ 10 3,4 – 14 mol / L - [OH–] ≈ 2,5 × 10 – 11 mol / L - Électroneutralité : - [H3O+] = [OH –] + [A –] - Or : [H3O+] >> [OH–] - En conséquence : - [H3O+] ≈ [A–] ≈ 4,0 x 10 – 4 mol / L - Conservation de la matière : - [AH] + [A–] = C => [AH] = C – [A–] - [AH] ≈ 1,0 × 10 – 2 – 4,0 x 10 – 4 - [AH] ≈ 9,6 × 10 – 4 mol / L 2)- coefficient d'ionisation α de cet acide. - On peut négliger la réaction d’autoprotolyse de l’eau.
- Quantité de matière d’acide ionisé : - n (A –) = [A –] . V = n . α - Quantité de matière initiale d’acide : - n = n (AHi) = C . V - Coefficient d’ionisation :
-
3)- équation bilan de la réaction entre l'acide et l'eau et qualificatif
- Acide faible : la réaction avec l’eau est limitée : pH > – log C
|
|
|
|
|