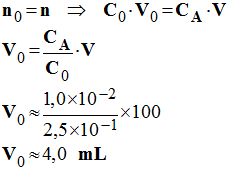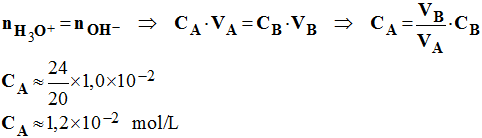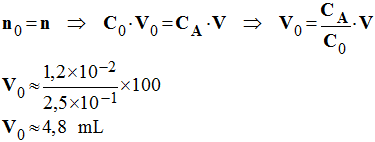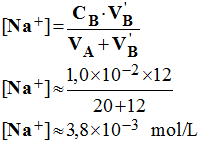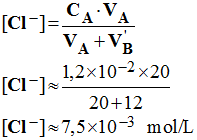|
Contrôle N° 02 Novembre 2000 Dosage Correction |
|
|
|
1)-
volume V0
de solution mère nécessaire et matériel nécessaire à la préparation
de la solution.
3)-
espèces présentes dans la solution et
concentration de tous
les ions présents. |
|
1)- volume V0 de solution mère nécessaire et matériel nécessaire à la préparation de la solution. - On utilise le fait qu’au cours de la dilution, il y a conservation de la quantité de matière du soluté.
-
- Matériel : pipette jaugée de 4 mL et fiole jaugée de 100 mL a)- Définition de l’équivalence acido-basique. - Il y a équivalence lorsque les réactifs ont été mélangés dans les proportions définies par les coefficients de l’équation bilan. À l’équivalence, d’après le bilan de matière, la quantité de matière d’ions hydronium initialement présente est égale à la quantité de matière d’ions hydroxyde ajoutée. b)- L’équation-bilan de la réaction de dosage et caractéristiques de cette réaction. - La réaction fait intervenir un acide fort et une base forte : H3O+ + OH– → 2 H2O - La réaction est quasi totale, rapide, unique et exothermique. c)- indicateur coloré. - La réaction fait intervenir un acide fort et une base forte. - À l’équivalence, le pH = 7. - On utilise le B.B.T comme indicateur coloré car la zone de virage (6,0 - 7,6) de cet indicateur contient le point d’équivalence E.
d)- Valeur de la concentration CA de la solution d’acide chlorhydrique dosée. - À l’équivalence, d’après le bilan de matière, la quantité de matière d’ions hydronium initialement présente est égale à la quantité de matière d’ions hydroxyde ajoutée.
-
e)- Volume de solution mère réellement utilisé si l’on suppose que les autres manipulations sont correctes.
-
3)- espèces présentes dans la solution et concentration de tous les ions présents. - Espèces présentes : H3O+ ; OH – ; Na+ ; Cl – - Concentrations des différentes espèces présentes : - Concentration des ions sodium :
-
- Concentration des ions chlorure
-
- Concentration des ions hydronium - pH = 2,4 - Par définition : - [H3O+] = 10 –pH mol / L - [H3O+] ≈ 10– 2,4 mol / L - [H3O+] ≈ 4,0 × 10– 3 mol / L - Concentration des ions hydroxyde
-
[OH–]
= 10 pH – pKe mol / L - [OH–] ≈ 10 2,4 – 14 mol / L - [OH–] ≈ 2,5 × 10– 12 mol / L - Vérification : - Électroneutralité : [H3O+] + [Na+] = [OH –] + [Cl –]
-
[H3O+]
+ [Na+]
≈ 7,8
× 10– 3 mol / L - Et :
-
[OH–]
+ [Cl–]
≈ [Cl–] ≈ 7,5
×
10– 3
mol / L - Il y a un écart de 4 % environ qui vient certainement de la précision sur la valeur du pH de la solution. |
|
|
|
|