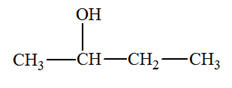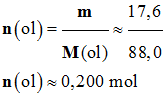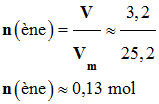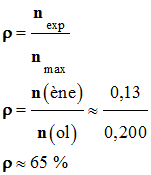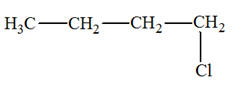|
Chap. N° 11 |
Transformations en chimie organique : Aspect macroscopique. Exercices. |
|
I-
Exercice 6 page 292 : étudier le vapocraquage.
|
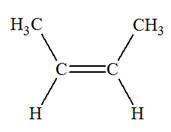
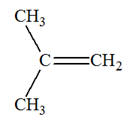
- La première donne du
propène et un alcane B
-
La seconde donne du
pent-2-ène et du dihydrogène. 1)-
Déterminer le nom et la formule des alcanes A
et B. 2)-
Écrire les équations de ces deux réactions. 3)-
La chaîne carbonée est-elle modifiée dans chacune de
ces réactions ? |
|
-
À partir de la
seconde réaction, qui est une déshydrogénation, on
peut affirmer que l’alcane A est le pentane
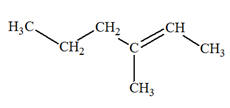
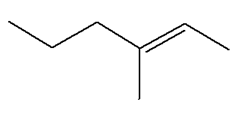
linéaire. - L’alcane A possède une chaîne carbonée comprenant 5 atomes de carbone.
- La première réaction donne du propène (3
atomes de carbone) et l’alcane B qui est
l’éthane (2 atomes de carbone).
-
Alcane A :
pentane : C5H12
ou CH3 – CH2 –
CH2 – CH2 –
CH3
- Alcane B :
C2H6 ou CH3–
CH3 2)-
Équations de ces deux réactions.
- Première réaction :
- Seconde réaction :
3)-
La chaîne carbonée est-elle modifiée dans chacune de
ces réactions ? - Première réaction :
- La chaîne carbonée a été raccourcie. La chaîne
carbonée a été modifiée. - Seconde réaction :
- La
chaîne carbonée comprend toujours 5 atomes de
carbone. La chaîne carbonée n’a pas été modifiée. |
II-
Exercice 7 page 292 : étudier une modification de
structure.
|
- Il peut donner du
2,2-diméthylbutane ou du méthylcyclopentane. 1)-
Écrire les équations des deux réactions considérées. 2)-
Quelle modification de structure a lieu lors de la
première réaction ? S’agit-il d’un reformage ? 3)- Quelle modification de structure a lieu lors de la seconde réaction ? S’agit-il d’un reformage ? |
|
- Première réaction :
- Seconde réaction :
2)-
Modification de structure qui a lieu lors de la
première réaction : - Lors de la première réaction, la longueur de la chaîne a été raccourci, la formule brute reste la même, c’est une isomérisation.
- Il s’agit d’un reformage. 3)-
Modification de structure qui a lieu lors de la
seconde réaction : - Lors de la seconde réaction, on obtient une molécule cyclique et le nombre d’atome de la chaîne carbonée est inchangée : c’est une cyclisation.
- Il s’agit d’un
reformage. |
III- Exercice 10 page 292 : Utiliser le nom d’une espèce
chimique.
|
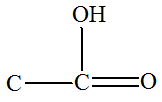
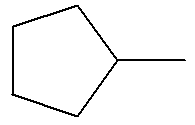
1)-
Quel(s) est (sont) le(s) groupe(s)
caractéristique(s) présent(s) ? 2)- Identifier sa formule topologique parmi celles proposées ci-dessous.
|
|
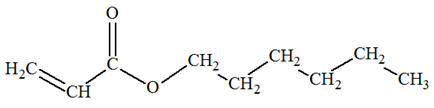
- La molécule
d’hexanoate de prop-2-ényle possède les groupes
caractéristiques suivants :
- Le groupe ester
- Le groupe alcène
2)-
Formule topologique :
|
|
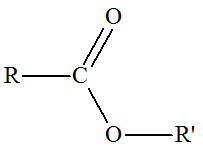
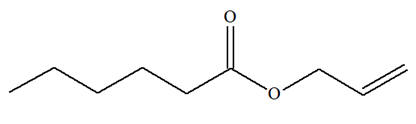
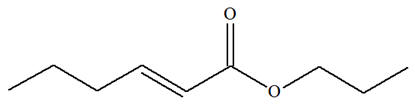
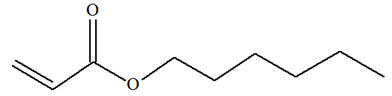
On donne les équations de trois
réactions :
1)- Les modifications observées sont-elles des modifications de chaînes ou des modifications de
groupes caractéristiques ? 2)- Lorsque le changement de structure est dû à un changement de groupe caractéristique, préciser la
nature des groupes caractéristiques mis en jeu. |
|
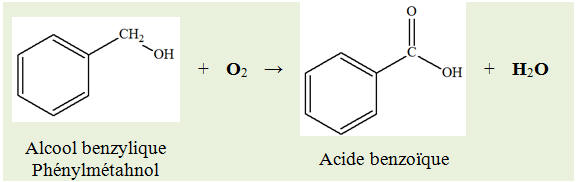
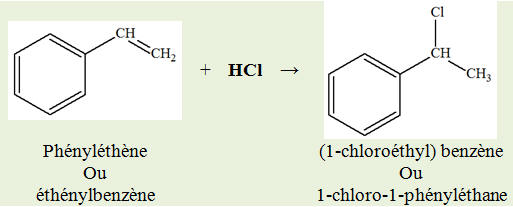
1)- Modification de chaîne ou modification de groupes caractéristiques.
2)-
Nature des groupes caractéristiques mis en jeu :
-
Réaction (2) : groupe
hydroxyle
-
Réaction (3) : groupe
alcène
|
V-
Exercice 17 page 293 : Rechercher la catégorie d’une
réaction.
|
Le dichlorométhane CH2Cl2 est un solvant industriel très utilisé. Il est synthétisé à partir du méthane et du dichlore. Le chlorure d’hydrogène HCl alors formé est valorisé en le faisant réagir avec du méthanol pour donner du chlorométhane et de l’eau. Le chlorométhane ainsi obtenu réagit avec le
dichlore pour donner du dichlorométhane. 1)-
Écrire l’équation de chaque réaction envisagée. 2)-
À quelle(s) catégorie(s) appartiennent ces
réactions ? |
2)- Catégorie des réactions :
- Ce sont des réactions
de substitution. |
VI-
Exercice 20 page 294 : Parfums.
|
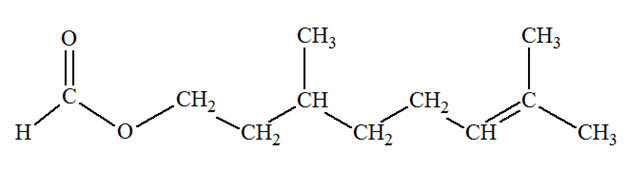
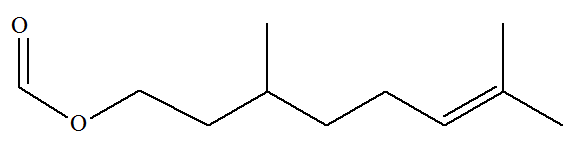
Le méthanoate de
3,7-diméthyloct-6-ényle à l’odeur de rose est
utilisé dans les parfums. 1)-
Déterminer son (ou ses) groupe(s)
caractéristique(s). 2)-
Déterminer sa (ou ses) chaîne(s) carbonée(s). 3)-
En déduire sa formule semi-développée. |
|
- Le groupe ester
- Le groupe alcène
2)-
Chaîne carbonée.
- La molécule est du
type :
- La chaîne carbonée
principale R’ :
- Elle comprend 8
atomes de carbone (octa) et une double liaison entre
les atomes de carbone 6 et 7.
- Les atomes de carbone
3 et 7 portent un groupe méthyle – CH3.
- Le groupe R
est un atome d’hydrogène H. 3)- Formule
semi-développée.
- Formule topologique :
|
VII- Exercice 20 page 295 : Déshydratation d’alcools.
|
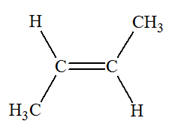
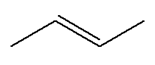
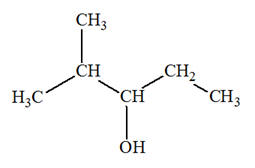
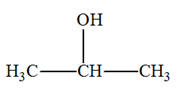
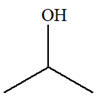
1)- Donner les formules semi-développée et topologique de tous les alcènes qui peuvent être obtenus lors de
la déshydratation des alcools suivants : a)-
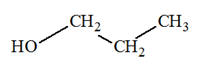
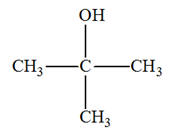
Butan-2-ol ; b)-
2-méthylpentan-3-ol ; c)-
3-méthylhexan-3-ol 2)- Donner les formules semi-développée et topologique du (des) alcool(s) qui peuvent donner l’un des
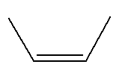
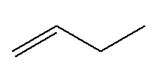
alcènes ci-dessous par déshydratation : a)-
Propène ; b)-
Méthylpropène ; c)-
(E)-but-2-ène. |
|
a)-
Butan-2-ol ;
c)-
3-méthylhexan-3-ol :
2)-
Formules semi-développée et topologique du (des)
alcool(s) : a)-
Propène ;
b)-
Méthylpropène ;
c)-
(E)-but-2-ène.
|
VIII- Exercice 28 page 296 : Déshydratation.
|
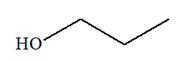
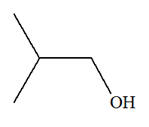
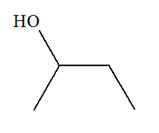
Une masse m = 17,6 g de pentan-1-ol passe sur de l’alumine chauffée vers 400 ° C. Le volume de gaz obtenu vaut
V = 3,2
L dans des conditions telles que le volume occupé
par une mole de gaz vaut
Vm = 25,2
L.
1)-
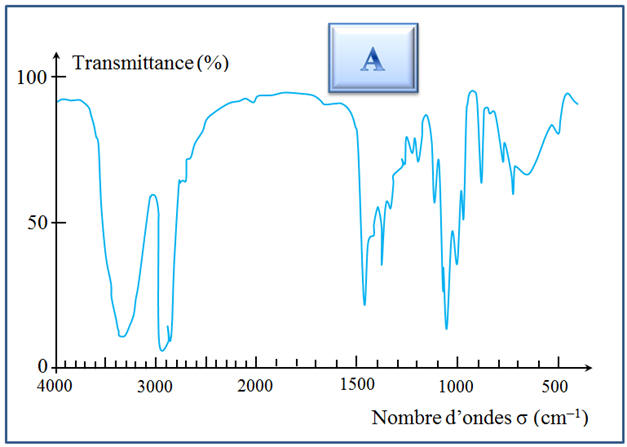
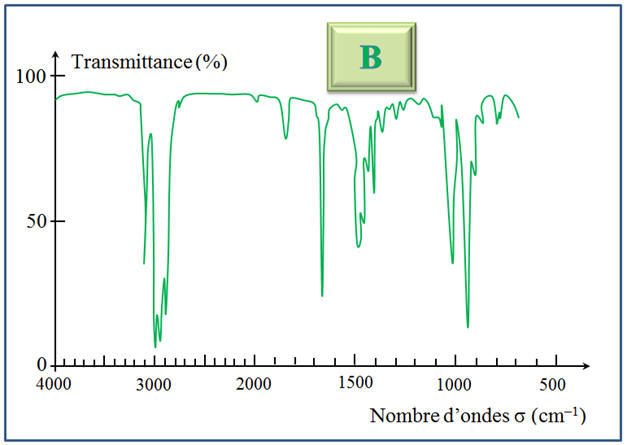
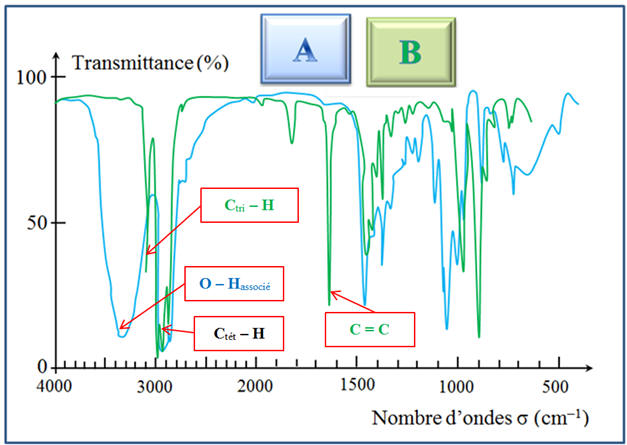
À l’aide des spectres
A du réactif
et B du
produit donnés ci-dessus, déterminer la nature de la
réaction qui a lieu. Écrire son équation.
-
Chap. N° 04 Analyse spectrale. Cours. 2)-
Quel est le rôle de l’alumine ? 3)-
Déterminer le rendement de cette synthèse. |
|
1)- Équation de la réaction.
- Superposition des
deux spectres A et B :
- Passage de A à
B :
- On s’aperçoit que la
bande à 3350 cm–1 a disparu.
- À la lecture du
tableau : bandes d’absorption caractéristiques :
- Chap. N° 04 Analyse spectrale. Cours.
- Cette bande
correspond à la liaison suivante :
-
Parallèlement, il y a
apparition d’une bande entre 1600 cm–1 et
1700 cm–1
- Cette bande
correspond à la liaison suivante :
- Au cours de la
réaction, on passe d’un alcool à un alcène.
- C’est une réaction
d’élimination, élimination d’une molécule d’eau.
2)- Rôle de l’alumine :
- L’alumine est un
catalyseur de la réaction. 3)- Rendement de
cette synthèse.
- Quantité de matière
de réactif :
- On utilise une masse
m = 17,6 g de pentan-1-ol.
- Masse molaire du
pentan-1-ol : M (C5H12O)
= M (ol) = 88,0 g / mol
-
- Quantité de matière
de produit :
- Le produit, le
pent-1-ène, est obtenu à l’état gazeux
- V = 3,2 L
- Vm = 25.2
L
-
- Rendement de la
réaction : - Le rendement d’une synthèse, noté ρ, est égal au quotient de la quantité de produit obtenu nexp,
par la quantité maximale de produit attendu nmax. - nexp = n (ène) ≈ 0,13 mol
-
et nmax
= n (ol) ≈ 0,200 mol
-
|
IX-
Exercice 29 page 296 : Identification d’un alcène.
|
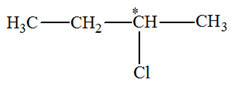
Un alcène A a pour
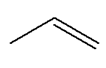
masse molaire MA = 56,0 g / mol. 1)- Quelle est la formule
brute d’un alcène possédant n atomes de carbone ? En déduire la formule brute
de A. 2)- Représenter et nommer
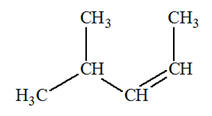
tous les isomères de A. 3)- L’addition de chlorure
d’hydrogène HCl sur A conduit au seul
mélange racémique de B et
B’. a)-
Écrire l’équation de la réaction
correspondante. Quelle est la modification de la structure réalisée ? b)-
En déduire la formule semi-développée de A,
puis celle de B et B’.
|
|
- CnH2n
- Le but est de trouver
la valeur de n :
- 12 n + 2 n
= 56
- 14 n = 56
-
n = 4
- Formule brute de A :
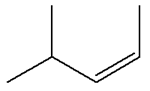
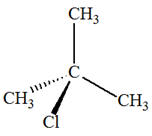
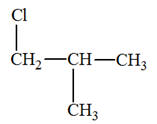
- C4H8 2)-
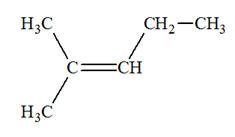
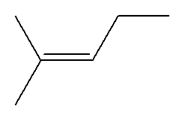
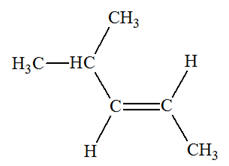
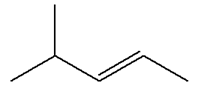
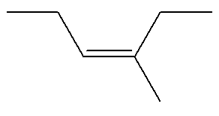
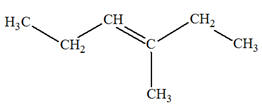
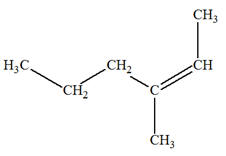
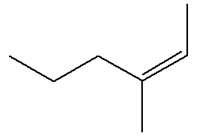
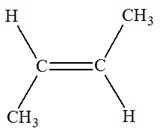
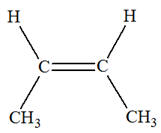
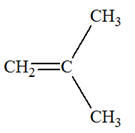
Les isomères de A :
3)-
Réaction d’addition de chlorure d’hydrogène : a)-
Équation de la réaction
correspondante :
- Addition sur le
but-1-ène :
- Cette réaction peut
donner le 1-chlorobutaneet le 2-chlorobutane. - Cette réaction ne convient pas.
- On ne peut pas avoir un mélange
racémique.
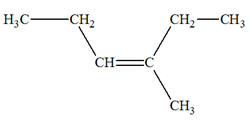
- Addition sur le
but-2-ène :
- Cette réaction peut
convenir car la molécule obtenue possède un carbone
asymétrique.
- On peut obtenir un
mélange racémique des deux stéréoisomères (des deux
énantiomères).
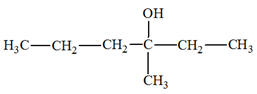
- Addition sur
2-méthylprop-1-ène
- Cette réaction peut
donner le 2-chloro2-méthylpropane le
1-chloro2-méthylpropane. - Cette réaction ne convient pas.
- On ne peut pas avoir un mélange
racémique.
- Modification de
structure réalisée :
- Une modification de
groupe caractéristique a été réalisée au cours de
cette réaction.
- On passe d’un groupe
alcène à un groupe halogène. b)-
Structure de A :
- L’addition du
chlorure d’hydrogène sur le (E)-but-2-ène et le
(Z)-but-2-ène conduit au même produit le
2-chlorobutane. - En conséquence, la structure de A n’est pas totalement déterminée.
- On ne sait pas s’il s’agit de l’isomère
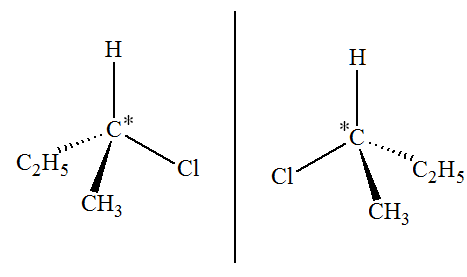
Z ou de l’isomère E du but-2-ène. c)-
Repérage de l’atome de
carbone asymétrique :
- Représentation des
molécules B et B’ :
- Les molécules B et B’ sont des énantiomères :
- Stéréoisomères
images l’un de l’autre dans un miroir plan. |
X-
Exercice 31 page 296 : Préparation de l’aniline.
|
|
|
|
|
|


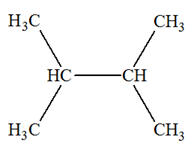
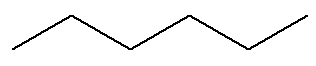
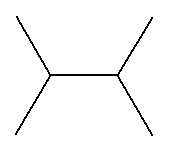
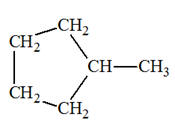
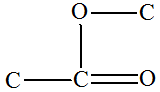 (terminaison
… oate de … yle)
(terminaison
… oate de … yle)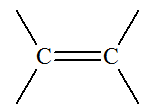 (terminaison
…ène)
(terminaison
…ène)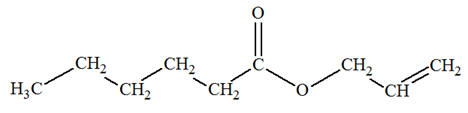
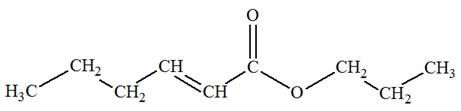
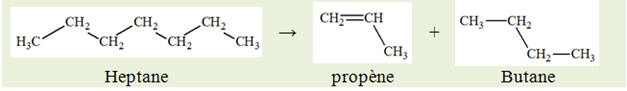
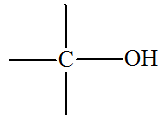 et
groupe carboxyle
et
groupe carboxyle