|
QCM N° 17 |
La Réaction chimique |
|
|
|
|
QCM N° 17
La Réaction chimique |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’apparition de la rosée sur les plantes à la tombée de la nuit est : |
une transformation chimique |
une transformation physique |
une liquéfaction |
BC |
|
2 |
Le sérum physiologique est une solution homogène de chlorure de sodium dissous dans de l’eau. À 25 °C ce système est décrit par : |
θ = 25 ° C, H2O (ℓ), NaCl (s), (Na+(aq) + Cl –(aq) ) |
θ = 25 ° C, H2O (ℓ), (Na+(aq) + Cl –(aq) ) |
θ = 25 ° C, H2O (ℓ), NaCl (s |
B |
|
3 |
Dans l’équation chimique : 2 CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (ℓ) |
CH4 (g) est un réactif |
H2O (ℓ) est un produit |
O2 (g) est un produit |
AB |
|
4 |
La combustion complète du propane admet pour équation : |
C3H8 (g) + 10 O2 (g) → 3 CO2 (g) + 4 H2O (g) |
2 C3H8 (g) + 7 O2 (g) → 6 CO (g) + 8 H2O (g) |
C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (g) |
C |
|
5 |
L’équation chimique : 2 Ag+ (aq) + Cu (s) → 2 Ag (s) + Cu2+ (aq) |
Respecte la conservation des éléments |
n’est pas ajustée |
respecte la conservation des charges |
AC |
|
6 |
L’équation chimique : Al (s) + 2 H+ (aq) → Al3+ (aq) + H2 (g) |
Respecte la conservation des éléments |
Respecte la conservation des charges |
est ajustée |
A |
|
7 |
L’équation de la réaction du métal chrome Cr (s) avec les ions hydrogène H+ (aq) s’écrit : |
Cr (s) + 3 H+ (aq) → Cr3+ (aq) + H2 (g) |
2 Cr (s) + 6 H+ (aq) → 2 Cr3+ (aq) + 3 H2 (g) |
Cr (s) + 6 H+ (aq) → Cr3+ (aq) + 3 H2 (g) |
B |
|
8 |
Lors de la combustion incomplète de l’éthane C2H6 (g) dans le dioxygène de l’air, lesréactions qui se produisent peuvent avoir pour équation : |
2 C2H6 (g) + 7 O2 (g) → 4 CO2 (g) + 6 H2O (g) |
2 C2H6 (g) + 3 O2 (g) → 4 C (s) + 6 H2O (g) |
2 C2H6 (g) + 5 O2 (g) → 4 CO (g) + 6 H2O (g) |
ABC |
|
9 |
L’équation de la réaction du métal aluminium Al (s) avec les ions étain Sn4+ (aq) s’écrit : |
Al (s) + 3 Sn4+ (aq) → Al3+ (aq) + Sn (s) |
4 Al (s) + 3 Sn4+ (aq) → 4 Al3+ (aq) + 3 Sn (s) |
4 Al (s) + Sn4+ (aq) → 4 Al3+ (aq) + Sn (s) |
B |
|
10 |
L’ébullition de l’eau à pression constante : |
dégage de la chaleur ou énergie thermique |
se fait à température constante |
absorbe de la chaleur ou énergie thermique |
BC |
|
11 |
La sublimation du diiode correspond à la réaction : |
I2 (s) → I2 (g) |
I2 (ℓ) → I2 (g) |
I2 (g) → I2 (s) |
A |
►
Réaction chimique :
-
Une transformation chimique a
lieu chaque fois qu’une nouvelle espèce chimique apparaît ou
chaque fois qu’une nouvelle espèce chimique disparaît.
-
Au cours d’une transformation
chimique : les espèces chimiques qui
disparaissent sont
appelées les
réactifs et les espèces chimiques qui
apparaissent sont appelées
les produits.
►
Lois de conservation :
-
Au cours d’une réaction chimique,
il y a conservation des éléments chimiques.
-
Les éléments présents dans les
réactifs se retrouvent dans les produits.
-
Conservation de la charge : au
cours d’une réaction chimique, la charge se conserve.
- Conservation de la masse : (Lavoisier) :
- Le chimiste français Lavoisier a montré que la
masse des réactifs qui disparaissent est égale à la masse des
produits qui apparaissent.
►
État initial et état final d’un
système chimique.
-
On appelle
état
initial
(E.I)
du système chimique, l’état de ce système avant la
transformation chimique.
-
On appelle
état
final (E.F)
du système chimique, l’état de ce système lorsque la
transformation chimique est terminée.
-
La transformation chimique permet
le passage de l’état initial à l’état final.
-
Lorsque l’évolution d’un système
chimique s’accompagne de l’apparition de nouvelles espèces
chimiques, le passage de l’état initial à l’état final est une
transformation chimique.
-
Exemple :
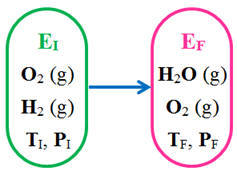
-
Il se produit une réaction
chimique car une nouvelle espèce chimique se forme :
H2O
(g)
-
Les réactifs sont
O2
(g) et H2 (g)
-
Le produit de la réaction :
H2O
(g)
►
Équation chimique :
-
L’équation chimique est
l’écriture symbolique d’une réaction chimique.
-
Par convention :
-
On écrit les formules des
réactifs dans le membre gauche de l’équation chimique
-
On écrit les formules des
produits dans le membre droit de l’équation chimique.
-
On sépare les deux membres de
l’équation par une flèche.
|
Réactifs |
Transformation
chimique |
Produits |
|
(
…
)
+
(
…
) |
→ |
(
…
)
+
(
…
) |
►
Ajustement des nombres
stœchiométriques.
-
Ajuster les nombres
stœchiométriques d’une équation, c’est choisir ces nombres de
manière à traduire la conservation de tous les éléments mis en
œuvre.
-
Par convention, le nombre
stœchiométrique se place devant la formule de l’espèce chimique.
Le nombre stœchiométrique 1 ne s’écrit pas
|
Réactifs |
Transformation
chimique |
Produit |
|
2
Al (s) +
3 S (s) |
→ |
Al2S3
(s) |
►
Combustion de l’éthanol :
|
Réactifs |
Transformation
chimique |
Produits |
|
C2H6O (ℓ)
+ 3 O2 (g) |
→ |
2 CO2 (g)
+ 3 H2O (g) |
►
Réaction du magnésium :
|
Réactifs |
Transformation
chimique |
Produits |
|
Mg
(s) + 2 H+ (aq) |
→ |
Mg2+ (aq) + H2 (g) |
►
Transformations physiques :
-
Changement d’état d’un corps
pur :
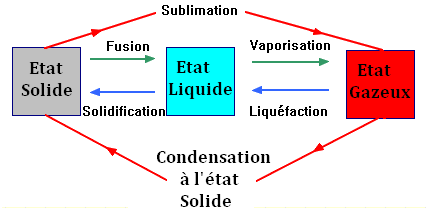
-
Ce sont des transformations
physiques qui n’affectent pas la structure des molécules du
corps pur.
-
Les changements d’état
interviennent sur les interactions entre les molécules appelées
liaisons intermoléculaires.
-
Des effets chimiques accompagnent
ces changements d’état :
-
Fusion, vaporisation et
sublimation absorbent de la chaleur.
-
Inversement, solidification,
liquéfaction et condensation à l’état solide dégagent de la
chaleur.
-
La transformation suivante :
H2O
(s) → H2O (ℓ)
-
Est une transformation physique :
une fusion
-
C’est le passage de l’eau à
l’état solide (glace) à l’eau à l’état liquide.
►
Cas d’une transformation
physique.
-
Les transformations physiques
fusion, vaporisation et sublimation absorbe de l’énergie
thermique du milieu extérieur qui se refroidit.
-
Les transformations physiques
inverses, solidification, liquéfaction et condensation, cèdent
de l’énergie thermique au milieu extérieur qui se réchauffe.
►
Sueur et effet thermique :
-
Lors d’un effort physique, la
sueur, en s’évaporant, absorbe une partie de la chaleur produite
par le corps et permet ainsi d’abaisser sa température.
►
Réaction chimique et énergie :
- Si le système absorbe plus d’énergie thermique qu’il n’en cède, on dit que la réaction chimique est endothermique,
globalement elle absorbe de
la chaleur (c’est le cas de la réaction entre l’hydroxyde de
baryum hydraté et le thiocyanate d’ammonium)
- Si le système absorbe moins d’énergie thermique qu’il n’en cède, on dit que la réaction chimique est exothermique,
globalement elle cède de la
chaleur (c’est le cas de la combustion du butane dans le
dioxygène)
- Si le système absorbe autant d’énergie thermique qu’il n’en cède, on dit que la réaction chimique est athermique,
globalement elle ne cède ni
absorbe de la chaleur.
-
C’est le cas de la réaction
d’estérification.
-
Une réaction chimique peut :
-
Céder de l’énergie au système
-
Absorber de l’énergie du système
- Ne pas céder de l'énergie au système, ni absorber de l’énergie du système
|
|
