|
Chim N° 08 |
La réaction chimique. Exercices. |
|
|
Mots clés : Cours de chimie seconde La réaction chimique, transformation physique, transformation chimique, système chimique, état initial, état final, lois de conservation, écriture d'une équation chimique, nombres stœchiométriques, effets termiques des trasformations physiques, effets thermiques des transformations chimiques, endothermique, exothermique, athermique, QCM, Vaporisation, fusion, solidification, sublimation, liquéfaction, effort physique, sueur, ... |
|
|
I- Exercice 1 page 268. Identifier une transformation.
|
Parmi les transformations suivantes, distinguer celles qui sont physiques et celles qui sont chimiques : a)- Solidification de l’eau des étangs en hiver ; b)- Fermentation de jus sucrés ; c)- Combustion du charbon ; d)- Liquéfaction du butane ; e)- Formation de la rosée à la tombée de la nuit ; f)- Évaporation de l’eau des piscines en été ; g)- Synthèse du savon ; h)- Dilution d’un mélange homogène d’eau et d’éthanol par ajout d’eau. |
|
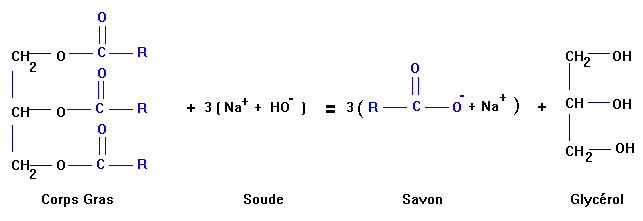
a)- Solidification de l’eau : transformation physique ; changement d’état physique ; - On passe de l’eau à l’état liquide à de l’eau à l’état solide, la glace. - Au cours de cette transformation, il y a une augmentation du volume de l’eau. - Ceci est dû aux liaisons intermoléculaires qui se forment entre les molécules d’eau. b)- Fermentation de jus sucrés : transformation chimique : - Exemple : Dans la fabrication de la bière on utilise le malt (orge germée et séchée) comme matière première. - Au cours du brassage, le malt est broyé puis mis en suspension dans l'eau. - L'amidon, principal constituant du malt, subit une transformation chimique et l'on obtient le moût. - Le moût est ensuite soumis à la fermentation alcoolique. - L'amidon est transformé en sucres, maltose puis glucose, par les enzymes développées lors du maltage, au cours du brassage. - La fermentation : cette étape consiste à ensemencer le moût avec des levures ; celles-ci transforment les sucres présents en éthanol et en CO2. - Équation simplifiée : - Oxydation du glucose : C6H12O6 → 2 C2H5OH + 2 CO2 c)- Combustion du charbon : transformation chimique : - Combustion complète du charbon : C + O2 → CO2 d)- Liquéfaction du butane : transformation physique : - Passage de l’état gazeux à l’état liquide. - La liquéfaction du butane permet de réduire considérablement son volume (1 litre de butane liquide libère environ 240 litres de gaz butane à la température de 15 °C et à la pression de 1 bar) et de le rendre aisément transportable. - La masse volumique du butane liquide est environ 585 g / L à 15 ° C. - La masse volumique du butane gazeux est environ 2,5 g / L à 15 ° C et à la pression de 1 bar. e)-Formation de la rosée à la tombée de la nuit : transformation physique. - Passage de l’état gazeux à l’état liquide. - Eau vapeur → Eau liquide f)- Évaporation de l’eau des piscines en été : transformation physique. - Passage de l’état liquide à l’état gazeux. g)- Synthèse du savon : transformation chimique. - La saponification. - Un savon s’obtient par hydrolyse basique d’un corps gras avec une solution aqueuse d’hydroxyde de sodium ou de potassium. - Avec la soude : on obtient un savon dur type savon de Marseille. - Avec la potasse : on obtient un savon mou, type savon noir. - La saponification est une réaction lente mais totale. - Une température élevée et un excès de base forte permettent d’augmenter la vitesse de cette transformation.
h)- Dilution d’un mélange homogène d’eau et d’éthanol par ajout d’eau : - Transformation physique : il y a dispersion des molécules d’éthanol dans l’eau. - On peut séparer les molécules d’eau et d’éthanol par distillation. |
II- Exercice 4 page 268. Décrire l’évolution d’un système chimique.
|
Le méthane CH4 (g), principal constituant du gaz naturel, est très souvent utilisé pour chauffer les gymnases et les salles de sport. Suivant la quantité de dioxygène O2 (g) disponible, la combustion peut être complète ou incomplète, ce qui, dans ce dernier cas, peut s’avérer très dangereux. Les produits peuvent donc être : a)- Du dioxyde de carbone CO2 (g) et de l’eau H2O (g). b)- Du monoxyde de carbone CO (g) et de l’eau H2O (g). c)- Du carbone C (s) et de l’eau H2O (g). Écrire les équations des trois réactions conduisant à ces différents produits. Les nombres stœchiométriques choisis seront des entiers les plus petits possibles. |
|
a)- Du dioxyde de carbone CO2 (g) et de l’eau H2O (g).
CH4
(g) +
2
O2
(g)
→
CO2
(g) +
2
H2O
(g) b)- Du monoxyde de carbone CO (g) et de l’eau H2O (g).
2
CH4
(g) +
3
O2
(g)
→
2 CO (g)
+
4
H2O
(g) c)- Du carbone C (s) et de l’eau H2O (g).
CH4
(g) +
O2
(g)
→
C
(g) +
2
H2O
(g)
|
III- Exercice 6 page 268. Ajuster des nombres stœchiométriques.
|
Les carburants sans plomb utilisés pour les véhicules de rallye sont principalement constitués d’isomères de formule C8H18, de divers additifs tels que le benzène C6H6, le toluène C7H8 et de composés oxygénés tel que l’éthanol C2H6O et le méthyltertiobutyléther C5H12O. Ajuster les équations des réactions de combustions complètes de ces 5 constituants. LLes nombres stœchiométriques choisis seront des entiers les plus petits possibles.
…
C8H18
(g) +
…
O2
(g) →
…
CO2
(g) +
…
H2O
(g)
…
C6H6
(g) +
…
O2
(g) →
…
CO2
(g) +
…
H2O
(g)
…
C7H8
(g) +
…
O2
(g) →
…
CO2
(g) +
…
H2O
(g)
…
C2H6O
(g) +
…
O2
(g) →
…
CO2
(g) +
…
H2O
(g)
…
C5H12O
(g) +
…
O2
(g) →
…
CO2
(g) +
…
H2O
(g)
|
|
Réponses :
2
C8H18
(g) +
25
O2
(g) →
16
CO2
(g) +
18
H2O
(g)
2
C6H6
(g) +
15
O2
(g) →
12
CO2
(g) +
6
H2O
(g)
C7H8
(g) +
9
O2
(g) →
7
CO2
(g) +
4
H2O
(g)
C2H6O
(g) +
3
O2
(g) →
2
CO2
(g) +
3
H2O
(g)
2
C5H12O
(g) +
15
O2
(g) → 10
CO2
(g) +
12
H2O
(g) |
IV- Exercice 13 page 270. Des airbags pour rouler en toute sécurité.
|
Des airbags, ou coussins gonflables, équipent de très nombreux véhicules automobiles afin d’assurer la sécurité des passagers en cas de choc. Ils sont constitués d’une enveloppe souple, susceptible d’être gonflée par un gaz produit lors d’une transformation chimique très rapide. Les réactifs mis en jeu sont trois solides : l’azoture de sodium NaN3 (s), le nitrate de potassium KNO3 (s) et la silice SiO2 (s). Lors d’un choc, le capteur détecte une brutale décélération et envoie un signal électrique qui déclenche l’explosion de l’azoture de sodium. Celui-ci de décompose en métal sodium solide et en diazote gazeux. Le sodium formé réagit alors avec le nitrate de potassium en produisant du diazote, de l’oxyde de sodium Na2O (s) et de l’oxyde de potassium K2O (s). Ces deux oxydes se combinent enfin avec la silice pour donner un verre inerte. Le diazote formé lors des deux premières réactions permet le gonflage du coussin protecteur en quelques dizaines de millisecondes. La transformation chimique mise en œuvre lors du gonflage de l’airbag se déroule en trois étapes :
1)- Recopier et compléter le schéma en indiquant la composition du système à l’issue de chacune des étapes. 2)- Écrire les équations des réactions chimiques qui se produisent dans les étapes 1 et 2. 3)- @ Il existe aujourd’hui des airbags anti-avalanches. Fonctionnent-ils sur le même principe ? |
|
1)- Le tableau :
2)- Équations des réactions chimiques qui se produisent dans les étapes 1 et 2.
2
NaN3
(s)
→
2
Na
(s)
+
3
N2
(g)
10
Na
(s)
+
2 KNO3
(s)
→
5
Na2O
(s) +
K2O
(s) 3)- @ Airbags anti-avalanches. - Intégration dans un sac à dos : - Déclenchement manuel ou automatique ? - Le gonflage se fait en 3 secondes grâce à une mini bonbonne d’air comprimé, et les sac restent gonflés pendant 1 minute le temps de l’avalanche. En plus de maintenir la personne en surface, les deux sac latéraux protègent la tête de traumatismes potentiels, mais aussi aménagent une poche d’air sous la neige lorsqu’ils se dégonflent, ce qui offre un espace suffisant pour respirer le temps que les secours arrivent.
|
V- Exercice 14 page 270. Brûler des sucres, brûler des graisses.
|
Le sucre ordinaire, ou saccharose, de formule C12H22O11, est un glucide. Les triglycérides présents dans le beurre ou les huiles végétales sont des lipides ou corps gras. La butyrine, de formule C15H26O6, est l’un des triglycérides présents dans le beurre. On appelle valeur énergétique d’un aliment, l’énergie thermique fournie par la combustion complète d’une masse m = 1,00 g de cet aliment dans du dioxygène pur. Elle s’exprime en kilojoules par gramme d’aliment (kJ / g). La valeur énergétique d’un glucide est EG = 17 kJ / g, celle d’un lipide est EL = 38 kJ / g. 1)- Écrire les équations des réactions de combustion complète : a)- Du saccharose solide ; b)- De la butyrine solide. 2)- Un cycliste qui roule en moyenne à 25 km / h consomme 2000 kJ / h. a)- Quelle masse de glucides « brulerait » un cycliste qui roulerait pendant deux heures à cette vitesse en ne consommant que du sucre ? b)- Même question à propos des lipides si le cycliste ne consommait que des corps gras ? |
|
1)- Équations des réactions de combustion complète : a)- Cas du saccharose solide :
C12H22O11
(s) +
12
O2
(g) →
12
CO2
(g) +
11
H2O
(g) b)-Cas de la butyrine solide.
2
C15H26O6
(s) +
37
O2
(g) → 30
CO2
(g) +
26
H2O
(g) 2)- Cas du cycliste : a)- Masse de glucides « brulerait » un cycliste : - Énergie dépensée par le cycliste : - E = 2000 x 2 - E ≈ 4000 kJ - Masse de glucides correspondante : - m (glucides) = E / EG = 4000 / 17 - m (glucides) ≈ 235 g b)- Masse de lipides « brulerait » un cycliste : - m (lipides) = E / EL = 4000 / 38 - m (lipides) ≈ 105 g |
|
|