|
QCM N° 17 a |
Réaction chimique |
|
|
|
|
Réaction
chimique
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Lors d’une transformation chimique : |
les réactifs sont consommés. |
les produits sont
formés. |
les réactifs changent toujours d’état physique. |
AB |
|
2 |
Au cours d’une transformation chimique : |
les espèces chimiques sont conservées. |
les éléments chimiques sont conservés. |
la charge électrique est conservée. |
BC |
|
3 |
L’état initial EI et l’état final EF d’un système chimique sont décrits ci-dessous :
|
une transformation chimique a eu lieu. |
O2 (g) et H2 (g) sont les
réactifs. |
H2O (g) et O2 (g) sont les
produits. |
AB |
|
4 |
Dans cette équation chimique : 2 Al (s) + 3 S (s) → Al2S3
(s) |
Al (s) et S (s) sont des espèces
consommées. |
Al2S3 (s) est le seul produit
formé. |
les nombres 2 et 3 à gauche de la flèche sont les nombres stœchiométriques. |
ABC |
|
5 |
La réaction de combustion complète de l’éthanol C2H6O (ℓ) admet pour réaction chimique : |
C2H6O (ℓ) + O2 (g) → CO2 (g)
+ H2O
(g) |
C2H6O (ℓ) + O2 (g) → 2 CO2 (g)
+ 3 H2O
(g) |
C2H6O (ℓ) + 3 O2 (g) → 2 CO2 (g)
+ 3 H2O (g) |
C |
|
6 |
L’équation de la réaction du métal magnésium Mg (s) avec les ions hydrogène H+ (aq) peut être : |
Mg (s) + H+ (aq) → Mg2+ (aq)
+ H2 (g) |
Mg (s) + 2 H+ (aq) → Mg2+ (aq)
+ H2 (g) |
2 Mg (s) + 2 H+ (aq) → Mg2+ (aq)
+ H2 (g) |
B |
|
7 |
H2O (s) → H2O (ℓ) Cette transformation
est : |
une liquéfaction. |
une transformation physique. |
une transformation chimique. |
B |
|
8 |
Après un effort physique, l’évaporation de la sueur de la peau : |
absorbe de l’énergie thermique du corps. |
cède de l’énergie t hermique au corps. |
permet de réguler la température du corps. |
AC |
|
9 |
Une transformation chimique : |
libère toujours de
l’énergie. |
peut libérer de l’énergie thermique. |
peut absorber de l’énergie thermique. |
BC |
|
10 |
Une transformation chimique peut
être : |
athermique. |
exothermique |
endothermique |
ABC |
►
Réaction chimique :
-
Une transformation chimique a
lieu chaque fois qu’une nouvelle espèce chimique apparaît ou
chaque fois qu’une nouvelle espèce chimique disparaît.
- Au cours d’une transformation chimique :
- les espèces chimiques qui
disparaissent sont
appelées les
réactifs et les espèces chimiques qui
apparaissent sont appelées
les produits.
►
Lois de conservation :
-
Au cours d’une réaction chimique,
il y a conservation des éléments chimiques.
-
Les éléments présents dans les
réactifs se retrouvent dans les produits.
-
Conservation de la charge : au
cours d’une réaction chimique, la charge se conserve.
- Conservation de la masse : (Lavoisier) :
- Le chimiste français Lavoisier a montré que la
masse des réactifs qui disparaissent est égale à la masse des
produits qui apparaissent.
►
État initial et état final d’un
système chimique.
-
On appelle
état
initial
(E.I)
du système chimique, l’état de ce système avant la
transformation chimique.
-
On appelle
état
final (E.F)
du système chimique, l’état de ce système lorsque la
transformation chimique est terminée.
-
La transformation chimique permet
le passage de l’état initial à l’état final.
-
Lorsque l’évolution d’un système
chimique s’accompagne de l’apparition de nouvelles espèces
chimiques, le passage de l’état initial à l’état final est une
transformation chimique.
-
Exemple :
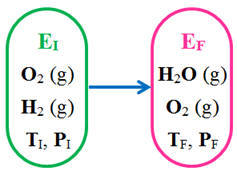
-
Il se produit une réaction
chimique car une nouvelle espèce chimique se forme :
H2O
(g)
-
Les réactifs sont
O2
(g) et H2 (g)
-
Le produit de la réaction :
H2O
(g)
►
Équation chimique :
-
L’équation chimique est
l’écriture symbolique d’une réaction chimique.
-
Par convention :
-
On écrit les formules des
réactifs dans le membre gauche de l’équation chimique
-
On écrit les formules des
produits dans le membre droit de l’équation chimique.
-
On sépare les deux membres de
l’équation par une flèche.
|
Réactifs |
Transformation
chimique |
Produits |
|
(
…
)
+
(
…
) |
→ |
(
…
)
+
(
…
) |
►
Ajustement des nombres
stœchiométriques.
-
Ajuster les nombres
stœchiométriques d’une équation, c’est choisir ces nombres de
manière à traduire la conservation de tous les éléments mis en
œuvre.
-
Par convention, le nombre
stœchiométrique se place devant la formule de l’espèce chimique.
Le nombre stœchiométrique 1 ne s’écrit pas
|
Réactifs |
Transformation
chimique |
Produit |
|
2
Al (s) +
3 S (s) |
→ |
Al2S3
(s) |
►
Combustion de l’éthanol :
|
Réactifs |
Transformation
chimique |
Produits |
|
C2H6O (ℓ)
+ 3 O2 (g) |
→ |
2 CO2 (g)
+ 3 H2O (g) |
►
Réaction du magnésium :
|
Réactifs |
Transformation
chimique |
Produits |
|
Mg
(s) + 2 H+ (aq) |
→ |
Mg2+ (aq) + H2 (g) |
►
Transformations physiques :
-
Changement d’état d’un corps
pur :
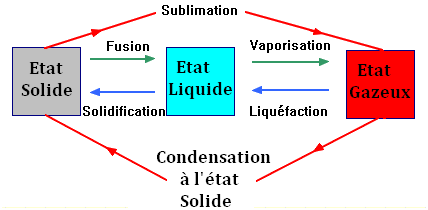
-
Ce sont des transformations
physiques qui n’affectent pas la structure des molécules du
corps pur.
-
Les changements d’état
interviennent sur les interactions entre les molécules appelées
liaisons intermoléculaires.
-
Des effets chimiques accompagnent
ces changements d’état :
-
Fusion, vaporisation et
sublimation absorbent de la chaleur.
-
Inversement, solidification,
liquéfaction et condensation à l’état solide dégagent de la
chaleur.
-
La transformation suivante :
H2O
(s) → H2O (ℓ)
-
Est une transformation physique :
une fusion
-
C’est le passage de l’eau à
l’état solide (glace) à l’eau à l’état liquide.
►
Cas d’une transformation
physique.
-
Les transformations physiques
fusion, vaporisation et sublimation absorbe de l’énergie
thermique du milieu extérieur qui se refroidit.
-
Les transformations physiques
inverses, solidification, liquéfaction et condensation, cèdent
de l’énergie thermique au milieu extérieur qui se réchauffe.
►
Sueur et effet thermique :
-
Lors d’un effort physique, la
sueur, en s’évaporant, absorbe une partie de la chaleur produite
par le corps et permet ainsi d’abaisser sa température.
►
Réaction chimique et énergie :
- Si le système absorbe plus d’énergie thermique qu’il n’en cède, on dit que la réaction chimique est endothermique,
globalement elle absorbe de
la chaleur (c’est le cas de la réaction entre l’hydroxyde de
baryum hydraté et le thiocyanate d’ammonium)
- Si le système absorbe moins d’énergie thermique qu’il n’en cède, on dit que la réaction chimique est exothermique,
globalement elle cède de la
chaleur (c’est le cas de la combustion du butane dans le
dioxygène)
- Si le système absorbe autant d’énergie thermique qu’il n’en cède, on dit que la réaction chimique est athermique,
globalement elle ne cède ni
absorbe de la chaleur.
-
C’est le cas de la réaction
d’estérification.
-
Une réaction chimique peut :
-
Céder de l’énergie au système
-
Absorber de l’énergie du système
- Ne pas céder de l'énergie au système, ni absorber de l’énergie du système
|
|
