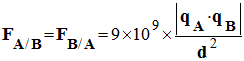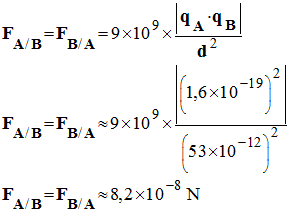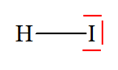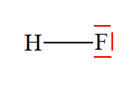|
Phys. N° 06 |
Cohésion de la matière à l'état solide. Exercices. |
|
|
Mots clés : Cohésion des solides ioniques, électrisation par frottement, loi de Coulomb, solide ionique, molécule polaire, molécule apolaire, électronégativité, polarité d'une liaison covalente, moment dipolaire, polatité d'une molécule, le chlorure d'hydrogène, cohésion des solides moléculaires, les solides moléculaires, interaction de Van Der Waals, Van Der Waals, la liaison hydrogène, chauffage d'un solide, changement d'état physique, les états de la matière, état solide, état liquide, état gazeux, transferts thermiques, applications, QCM, exercices, correction, structure de la glace, structure de l'eau liquide, structure de la vapeur d'eau, chlorure d'iode solide, ... |
|
|
I- Exercice 7 page 164. Identifier la nature des charges électriques.
|
Frottées avec de la laine, une
tige de verre T1 se charge
positivement,
alors qu’une tige de polystyrène T2
se charge négativement.
1)- Une tige T3 de plexiglas
frottée avec de la laine est repoussée par la tige
T1 :
a)- b)- 2)- Une tige de polystyrène T4,
frottée avec le la laine, est attirée par la tige de
verre T1.
Qu’observerait-on si on
approchait, de la tige T4, la tige
de polystyrène T2 ? |
|
1)- Charges électriques :
a)- - La tige T3 de plexiglas frottée avec de la laine est repoussée par la tige T1. - Or la tige T1 est chargée positivement. - Comme deux charges de mêmes signes se repoussent -
La tige T3 est chargée
positivement.
b)- - La tige T2 est chargée négativement. - La tige T3 est chargée positivement - Comme deux charges de signes opposés s’attirent -
La tige T2 est attirée par
la tige de verre T3.
2)- Tiges T4 et T2 : - La tige de polystyrène T4 est attirée par la tige de verre T1 - Or la tige T1 est chargée positivement - Comme deux charges de signes opposés s’attirent - La tige T4 est chargée négativement - Comme la tige T2 est chargée négativement - Les tiges T4 et T2 se repoussent. |
II- Exercice 9 page 164. Connaître la loi de Coulomb.
|
Dans le système
international d’unité, la valeur des forces
électriques s’exerçant entre deux charges qA
et qB distantes de d vaut :
1)- Rappeler les unités de F, qA,
qB et d dans le système
international d’unités.
2)- Dans un atome d’hydrogène, qA
= – qB = 1,6
Calculer la
valeur des forces FA/B et FB/A
s’exerçant entre le noyau et l’électron de l’atome
d’hydrogène. |
1)- Les unités de F, qA, qB et d dans le système international d’unités :- FA/B et FB/A s’expriment en newton (N). - qA et qB s’expriment en coulomb (C) -
d s’exprime en mètre (m)
2)- Valeur des forces FA/B et
FB/A s’exerçant entre le noyau et
l’électron de l’atome d’hydrogène : -
|
III- Exercice 10 page 164. Déterminer la formule de cristaux ioniques.
|
Recopier et compléter le tableau
ci-dessous en ajoutant soit la formule du solide
ionique comportant ces ions,
soit les formules de
l’anion et du cation qui le composent.
Cation
Anion
Na+
Al3+
NaF
S2–
NO3–
Mg(NO3)2
C2O42–
Al2(C2O4)3 |
|
Cation Anion |
Na+ |
Mg2+ |
Al3+ |
|
F– |
NaF |
MgF2 |
AlF3 |
|
S2– |
Na2S |
MgS |
Al2S3 |
|
NO3– |
Na NO3 |
Mg(NO3)2 |
Al(NO3)3 |
|
C2O42– |
Na2C2O4 |
Mg C2O4 |
Al2(C2O4)3 |
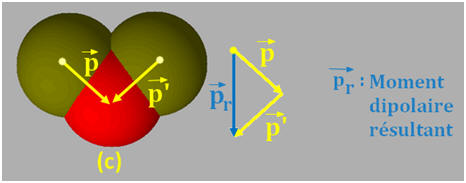
IV- Exercice 13 page 164. Rechercher des molécules polaires.
|
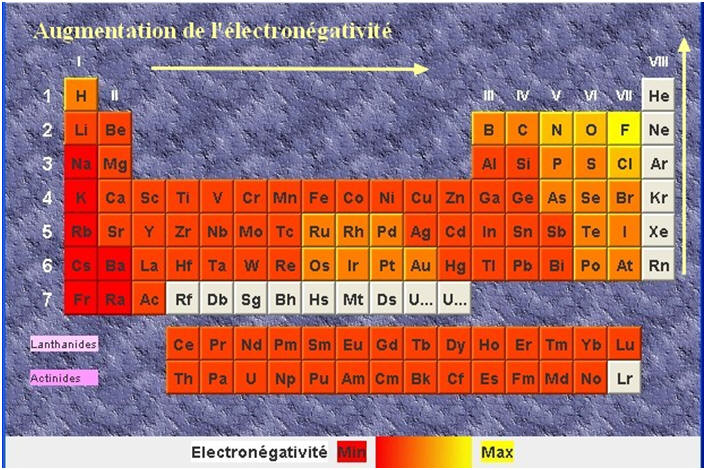
Dans une ligne ou une période de la classification périodique, l’électronégativité des éléments croît de gauche à droite, hormis pour les gaz nobles.
1)- En consultant la classification périodique, dire pourquoi chacune des liaisons présentes dans les molécules d’oxyde d’azote NO (a), de carbure de béryllium CBe2 (b), de fluorure d’oxygène F2O (c) est polarisée ? 2)- En utilisant les modèles moléculaires ci-dessus prévoir si ces trois molécules sont polaires. |
|
1)- Polarisation des liaisons : ► Molécule d’oxyde d’azote NO (a) : -
L’oxygène se situe à droite de l’azote.
- En
conséquence, l’oxygène est plus électronégatif que
l’azote. La liaison N – O est polarisée.
► Molécule de carbure de béryllium : -
Les liaisons C = Be sont polarisées
car le carbone est plus électronégatif que le
béryllium.
- Le béryllium est situé à gauche de
l’atome de carbone dans la classification
périodique. ► Le fluorure d’oxygène : -
Les liaisons O – F sont polarisées car
le fluor est plus électronégatif que l’oxygène.
2)- Molécules polaires :
-
La molécule d’oxyde d’azote est une molécule
polaire.
- Elle possède un moment dipolaire. -
La molécule de carbure de béryllium qui est
une molécule linéaire (comme de dioxyde de carbone)
n’est pas une molécule polaire.
-
La molécule de fluorure d’oxygène, qui est
une molécule coudée, est une molécule polaire.
|
V- Exercice 15 page 165. Identifier des interactions de Van Der Waals.
|
1)- Rappeler, en s’aidant d’exemples, ce qui
distingue, dans une molécule diatomique, un dipôle
électrique permanent d’un dipôle électrique
instantané.
2)- On considère les molécules des espèces
suivantes : N2, Cl2,
H2S, CBe2,
CS2, Cl2O,
IBr et HI. Les molécules H2S
et Cl2O sont coudées
alors que les molécules CBe2 et
CS2 sont linéaires. a)- b)- |
|
1)- Dipôle électrique permanent et dipôle électrique
instantané :
► Dipôle
électrique permanent dans une molécule diatomique :
-
Il correspond à une
distribution permanente non symétrique du doublet de
liaison entre les deux atomes.
-
Le barycentre des charges positives n’est pas
confondu avec le barycentre des charges négatives.
► Dipôle
électrique instantané dans une molécule diatomique :
-
Il résulte de l’existence, à
un moment donné, d’une dissymétrie dans la
répartition des charges électriques entre les deux
atomes.
-
Il se peut que la densité électronique soit plus
grande sur un atome que sur l’autre.
-
Il apparaît alors un moment dipolaire instantané.
-
C’est le cas des molécules diatomiques constituées
d’atomes identiques.
2)- Molécules polaires et apolaires :
a)- Molécules apolaires : molécules dont le
moment dipolaire est nul
-
C’est le cas des molécules diatomiques constituées
d’atomes identiques :
-
N2
(N ≡ N), Cl2 (Cl – Cl)
-
C’est le cas de molécules linéaires symétriques :
- CBe2
(Be = C = Be), CS2 (S
= C = S)
-
Le moment dipolaire résultant
est nul.
b)-
Molécules polaires : molécules dont le moment
dipolaire n’est pas nul :
-
Molécules diatomiques constituées de deux atomes
différents :
- IBr
(I – Br) et
HI (H – I).
-
Les molécules triatomiques coudées comme :
-
H2S
et Cl2O
-
Les liaisons sont polarisées
et la somme des moments dipolaires n’est pas nulle.
-
La molécule possède un moment dipolaire résultant.
|
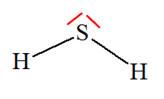
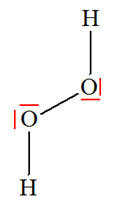
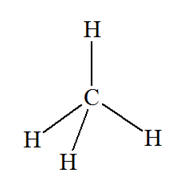
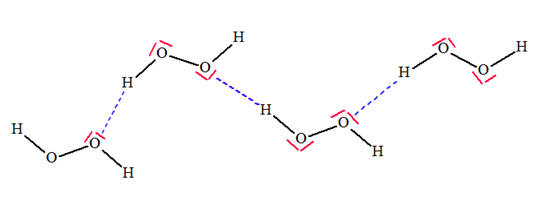
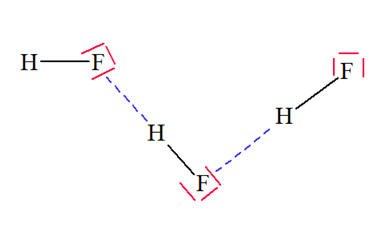
VI- Exercices 16 page 165. Rechercher la présence de liaisons hydrogène.
|
Les représentations de Lewis de l’iodure d’hydrogène HI, du sulfure de dihydrogène H2S, du peroxyde d’hydrogène H2O2 (eau oxygénée), du fluorure d’hydrogène HF, du méthane CH4 et du chloroforme CH3Cl sont les suivantes :
1)- Parmi ces molécules, quelles sont celles qui peuvent participer à des liaisons hydrogène ? 2)- Représenter quelques liaisons hydrogène pour chacune d’elles : |
|
1)- Liaisons hydrogène : - Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un atome B, également très électronégatif et porteur d’un ou plusieurs doublets non liants. - Les atomes A et B qui interviennent généralement sont : l’azote N, l’oxygène O, le fluor F et le chlore Cl. - Les trois atomes qui participent à la liaison hydrogène sont généralement alignés. - C’est le cas de la molécule HF et de la molécule H2O2. 2)- Représentation des liaisons hydrogène : - Avec la molécule H2O2 :
- Avec la molécule HF : ne pas oublier que l’atome de fluor porte quatre doublets qui se répartissent de telle sorte que l’interaction entre eux soit minimale. - C’est pour cette raison que l’enchaînement n’est pas linéaire. - L’angle que forme la liaison covalente avec la liaison hydrogène est voisin de 109 °.
|
VII- Exercice 17 page 165. Interpréter des effets thermiques.
|
Le triiodométhane ou iodoforme fond à 6 ° C et bout à 180 ° C sous la pression atmosphérique. Son moment dipolaire vaut 1,2 D. 1)- Décrire ce qui se produit à l’échelle macroscopique lorsque l’on chauffe du triiodométhane de 0 ° C à 10 ° C. 2)- La molécule de triiodométhane peut-elle participer à des liaisons hydrogène ? 3)- En déduire les évolutions qui se produisent, à l’échelle microscopique, lorsque l’on chauffe du triiodométhane de 0 ° C à 10 ° C. |
|
1)- Échelle macroscopique : On chauffe du triiodométhane de 0 ° C à 10 ° C : - La température de fusion du triiodométhane est 6 ° C - De 0 ° C à 6 ° C, on chauffe le solide. La température du triiodométhane à l’état solide augmente. -
À 6 ° C : le triiodométhane passe de l’état
solide à l’état liquide : c’est la fusion qui
s’effectue à température constant θ = 6 ° C.
- Du
triiodométhane solide se transforme à triiodométhane
à l’état liquide. - De 6 ° C à 10 ° C : lorsque tout le triiodométhane se trouve à l’état liquide, la température augmente à nouveau. - On chauffe alors le triiodométhane à l’état liquide. 2)- Liaisons hydrogène : - Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un atome B, également très électronégatif et porteur d’un ou plusieurs doublets non liants. - Les atomes A et B qui interviennent généralement sont : l’azote N, l’oxygène O, le fluor F et le chlore Cl. - Comme la molécule de triiodométhane ne possède pas d’atome, d’azote N, d’oxygène O, de fluor F ou de chlore Cl, il ne se forme pas de liaisons hydrogène. 3)- Échelle microscopique : On chauffe du triiodométhane de 0 ° C à 10 ° C : - De 0 ° C à 6 ° C : Lorsque l’on chauffe le solide moléculaire CHI3, la chaleur que reçoit le solide est transformée en énergie cinétique Ec. - L’agitation des molécules qui constituent le solide augmente. - Quand cette agitation est suffisante, des interactions de Van Der Waals, qui assurent la cohésion du cristal sont rompues. - Puis à 6 ° C l’édifice cristallin se disloque. - Les molécules restent en contact mais se séparent. - Il n’y a plus de disposition régulière dans l’espace. - C’est la fusion : on passe de l’état solide à l’état liquide. - Au cours de la fusion, l’énergie thermique fournie au cristal est utilisée pour rompre des interactions de Van Der Waals. - La température reste constante pendant toute la durée de la fusion. - De 6 ° C à 10 ° C : Une fois toute l’espèce moléculaire à l’état liquide, l’agitation thermique augmente à nouveau et la température aussi et des interactions de Van Der Waals, qui assurent la cohésion du liquide sont rompues. |
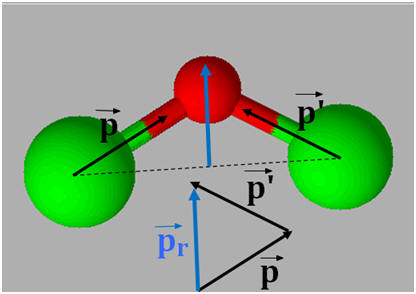
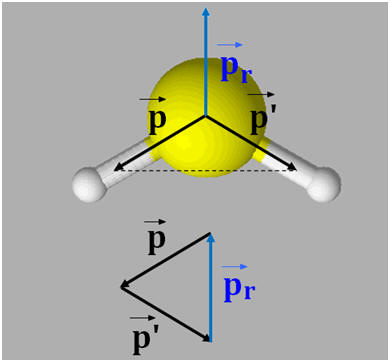
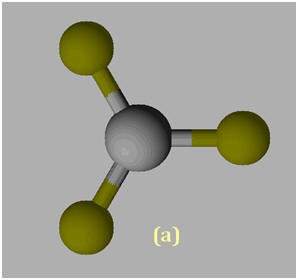
VIII- Exercice 21 page 166. Géométrie des molécules et polarité.
|
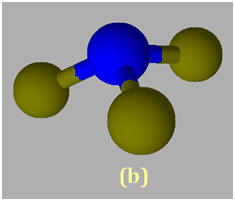
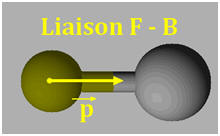
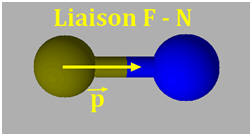
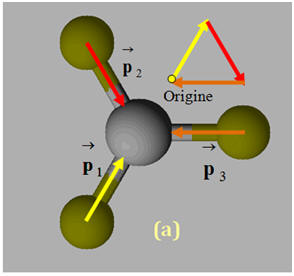
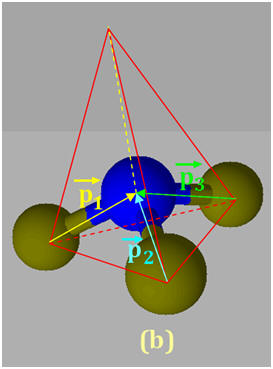
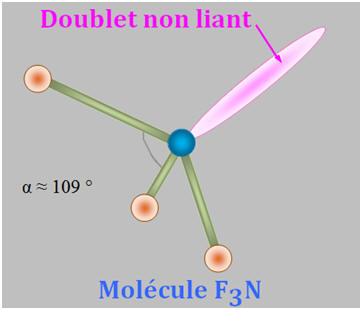
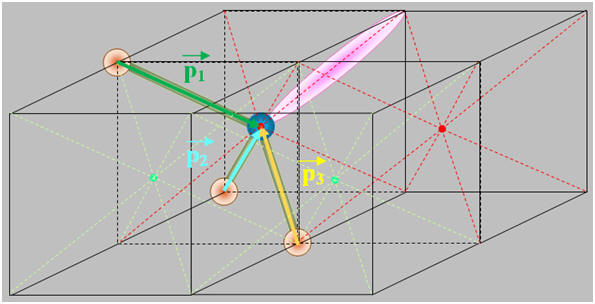
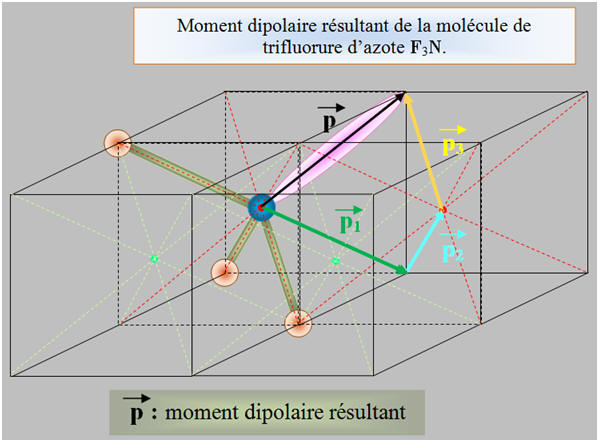
1)- Repérer, dans la classification périodique la place des éléments bore B, azote N et fluor F. En déduire que les liaisons B – F, N –F sont polarisées. 2)- Situer les charges positives et négatives des dipôles B – F et N – F et représenter, sans souci d’échelle, les vecteurs moments dipolaires associés. 3)- Justifier que le trifluorure de bore BF3 (a) est apolaire, alors que le trifluorure d’azote NF3 (b) est polaire.
|
|
1)- Repérage dans la classification périodique :
- Le fluor est plus électronégatif que l’azote, qui est plus électronégatif que le bore. - Les liaisons B – F et N –F sont polarisées : 2)- Liaisons polaires et Moments dipolaires : -
3)- Molécule apolaire et molécule polaire : - La molécule de trifluorure de bore BF3 (a) est apolaire : -
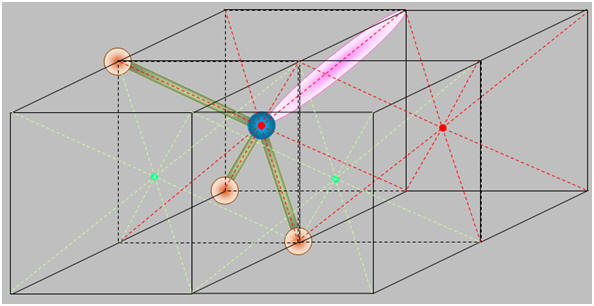
- La molécule de trifluorure d’azote NF3 (b) est polaire : -
- Pour aller plus loin :
|
|
|